 |
Quelle chimie permet aux allumettes de s’enflammer ?
|
Quelle chimie permet aux allumettes de s’enflammer ?
Rubrique(s) : Question du mois

Les allumettes que nous utilisons tant en cette saison de barbecue sont bien pratiques et faciles à utiliser. Pourtant elles sont le fruit d’une longue histoire. Elles résultent de nombreuses recherches et industrialisations suivies d’améliorations pour les rendre sûres et non toxiques. Elles nécessitent une friction pour s’enflammer et pour que ce soit d’un usage utile il faut que cette flamme dure suffisamment longtemps. Mais quels sont donc les ingrédients mis en jeu pour que cela fonctionne ?
Les composés présents sur la surface à gratter
Le grattoir est constitué de poudre de verre et de phosphore rouge.
Le phosphore rouge est la variété allotropique (1) stable du phosphore, non inflammable et non toxique.
Les composés présents sur la tête de l’allumette
La petite tige de bois de peuplier est imprégnée de phosphate d’ammonium et son extrémité est recouverte de paraffine. Sur cette extrémité est déposée une pâte constituée à environ 50 % de chlorate de potassium (KClO3) (2), de trisulfure de diantimoine (Sb2S3) et de phosphate d’ammonium (NH4)3PO4, le tout lié par une colle. Le colorant présent est ajouté pour la rendre jolie !
Cette tête est appelée le « bouton » dans le processus de fabrication.
Que se passe-t-il lors du grattage, et après ?
La poudre de verre permet la friction provoquant un échauffement. Cette augmentation locale de température provoque la transformation du phosphore rouge en phosphore blanc (3). Celui-ci, très volatil et inflammable, s’enflamme immédiatement en présence du dioxygène de l’air. Cette étape sert à amorcer la flamme.
Celle-ci se communique alors à la tête de l’allumette.
Le chlorate, oxydant, se décompose sous l’effet de la chaleur de la flamme en chlorure et libère de l’oxygène selon KClO3 → KCl + 3/2 O2 (gaz)
Le trisulfure de diantimoine est un réducteur et sert de combustible, permettant ainsi à la flamme de se maintenir.
Il se forme simultanément du trioxyde de diantimoine et du dioxyde de soufre, responsable de l’odeur que l’on perçoit.
Les réactions mises en jeu sont :
Sb2S3 + 9/2 O2 → Sb2O3 + 3 SO2
ou globalement Sb2S3 + 3 KClO3 → Sb2O3 + 3 SO2 + 3 KCl
Et ce bel enchaînement de réactions ne dure que quelques dixièmes de secondes !
La cire de paraffine, qui est aussi un bon combustible, va permettre à la flamme de se propager le long de la tige de bois.
Quant au phosphate d’ammonium dont le bois est imprégné, il joue le rôle de retardateur de combustion afin que l’allumette ne brûle pas trop vite, et limite la formation des fumées lorsque l’allumette s’éteint.
La fabrication des allumettes en France a pendant plus d’un siècle été un monopole d’état (représenté par la SEITA). La dernière usine de Saintines dans l'Oise a fermé en 1993, elle fabriquait environ 15 milliards d'allumettes sur les 22 milliards consommées en France et consommait alors 8400 m3 de bois de peuplier. Depuis la consommation chute de 2 à 4% par an, concurrencée par les allume-gaz et les briquets.
Pour voir en images et au ralenti le processus d’inflammation d’une allumette tout en identifiant les réactions qui se passent, regardez la vidéo « How Do Matches Work ? » sur la chaine Youtube de l’American Chemical Society.
Françoise Brénon
(1) Une variété allotropique correspond à une forme cristalline ou moléculaire. Le phosphore rouge a un enchainement structural semblable à un polymère :
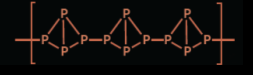
source http://www.compoundchem.com/2014/11/20/matches/
(2) On utilise du chlorate de potassium qui est non hygroscopique (absorbe peu ou pas l’humidité de l’air) contrairement au chlorate de sodium.
(3) Le phosphore blanc est une autre variété allotropique du phosphore . Sa structure découle d’une « dépolymérisation « du phosphore rouge et est :
 source : https://fr.wikipedia.org/wiki/Phosphore_blanc
source : https://fr.wikipedia.org/wiki/Phosphore_blanc
Il est très inflammable. On pourra lire à son sujet la ressource « Le phosphore et l’invention des allumettes ».
