

 |
Pourquoi utiliser de l’ammoniac ou de l’ammoniaque dans des applications domestiques ?
|
Pourquoi utiliser de l’ammoniac ou de l’ammoniaque dans des applications domestiques ?
La molécule de formule NH3 appelée ammoniac(i) [3] est un gaz, très soluble dans l’eau. On donne aussi le nom d’« ammoniaque » ou « solutions ammoniacales » à ses solutions aqueuses.
La forme gazeuse est présente à l’état naturel lors de la décomposition de substances protéiques. 80% de sa production industrielle par le procédé Haber-Bosch(ii) [4] sert à la synthèse des engrais.
Pour ce qui est des applications domestiques, on trouve la solution aqueuse en magasin de bricolage, dans les rayons de produits ménagers ou sur Internet, avec les informations d’utilisations suivantes « nettoyant, décapant », « dégraisse, détache les tissus, ravive les couleurs », « nettoyer les tapis et moquettes, nettoyer les surfaces vitrées… ». Il existe aussi des mélanges prêts à l’emploi.
En ce qui concerne le nettoyage de l’argenterie, l’utilisation des solutions d’ammoniac est discutable(iii).
La solution d’ammoniac est également une des composantes utilisée pour réaliser des « frisures permanentes » sur cheveux(iv), ou dans des colorations capillaires.
Ammoniaque alcali 22° baumé ; ammoniaque 13° ; ammoniac 13% ; ammoniaque alcali 13 % ; alcali 13% ; ammoniaque (ou ammoniac) alcali 22° hydroxyde d’ammonium ref alcali en solution à 20% (en poids d’ammoniaque dans l’eau).
Ces noms recouvrent-ils la même chose et quelles sont les significations de toutes ces informations ?
Lors de la dissolution du gaz ammoniac dans l’eau il s’établit un équilibre dont l’équation bilan (A) est la suivante :
(A) NH3 (aq) + H2O (l) = NH4+(aq) + OH-(aq)
Mais cet équilibre ne produit qu’une très faible quantité d’ions ammonium NH4+. Ainsi la solution contient très majoritairement des molécules d’ammoniac hydratées. Par exemple, pour 17 g de gaz ammoniac NH3 dissout dans 1 L d’eau cela conduit à l’équilibre à avoir 99,6 % sous forme NH3,aq(v). Il se forme seulement 0,4 % sous forme NH4+ et simultanément la même faible quantité d’ions hydroxyde OH-.
Ainsi écrire que l’ammoniaque (correspondant à l’ammoniac en solution) aurait pour formule chimique NH4OH est donc inexact et source d’erreur(vi). Cette formulation date du XIXe siècle(vii).
La solution aqueuse d’ammoniac est aussi une solution basique en raison de la présence des ions OH-(viii).
Le mot « alcali » a pris plusieurs définitions au cours des siècles. En tant qu’adjectif il signifie que le produit est une base forte et donc que sa solution a concrètement un pH allant de 10 à 14 selon sa concentration(ix), ce qui est le cas de la solution d’ammoniac. En tant que nom, « l’alcali » ou « alcali volatil » est synonyme de solution d’ammoniac. Ce terme est toutefois désuet.
L’ammoniac NH3 peut donner des complexes en s’associant aux molécules responsables de la tache et ainsi « l’encapsuler » ou faire passer sous forme ionique un colorant qui sera alors soluble dans l’eau. Son caractère basique participe aussi au processus de dégraissage.
Ces propriétés étaient utilisées dès l’Antiquité ! À Pompéi et dans la Rome antique il existait des ateliers de foulonnerie où l’on nettoyait les vêtements des dignitaires. Le linge était foulé avec les pieds par des esclaves dans des bacs contenant des argiles et de l’urine humaine récoltée dans la ville. En effet l’urine contient de l’urée qui se transforme en ammoniac grâce à une enzyme uréase (naturellement présente dans l’urine) selon :
(NH2)2CO (urée) + H2O → CO2 + 2 NH3
En raison de son caractère basique, il est conseillé d’utiliser des gants lors de la manipulation d’une solution aqueuse d’ammoniac et d’éviter le contact avec les yeux et les muqueuses.
L’odeur caractéristique de l’ammoniac ne vous échappera pas ! Au moment de manipuler ce produit il est vivement conseillé d’ouvrir les fenêtres pour aérer la pièce et d’éviter de respirer les vapeurs.
Ne pas stocker ni manipuler le produit près d’une source de chaleur, car NH3 dissous peut facilement redonner de l’ammoniac gazeux s’échappant du flacon.
Ne pas stocker la bouteille d’ammoniac à proximité d’une bouteille d’acide chlorhydrique (éventuellement possédée comme détartrant). En effet les vapeurs de NH3 comme celles de chlorure d’hydrogène (HCl) pouvant s’échapper des flacons donneront des cristaux blancs de chlorure d’ammonium(xi), qui se déposeront sur les bouchons. On peut observer que les grandes surfaces ne respectent pas toujours ces règles de stockage !
Dans diverses circonstances vous pouvez identifier la présence d’ammoniac. Par exemple :
Pour les étiquettes indiquant un pourcentage, il s’agit du pourcentage massique(xiii) correspondant au rapport entre la masse de la quantité d’ammoniac introduite(xiv) dans l’eau sur la masse totale de la solution obtenue. Donc l’information « solution à 13% » signifie que 100 g de solution contient 13 g de NH3.
Il est étonnant de trouver encore une information en degré Baumé, unité exclue des unités légales françaises depuis 1961. À 20 °C, la correspondance entre la densité et les degrés Baumé (noté B) pour les liquides moins denses que l'eau (densité < 1) est : d = 140 / (B + 130). Cela donne pour la solution d’ammoniac à 22° d = 140/(22+130) = 0.921 et donc une masse volumique(xv) de 0,921 kg/L.
Dans les laboratoires de chimie l’étiquette indique un pourcentage massique, P, une masse volumique ρ en g par litre (g.L-1) et une masse molaire M en g par mole (g.mol-1). Ces 3 données permettent de déterminer la concentration molaire en ammoniac, [NH3,aq], exprimée en mol par litre (mol.L-1) ; la relation à utiliser est C = P* ρ /M où bien sûr la masse molaire de l’ammoniac est M = 17 g.mol-1 et non 35 g.mol-1, comme on le trouve de façon erronée sur certains flacons, sur des sites Internet grand public et même sur la fiche officielle associée à son numéro CAS(xvi) ! Cette masse molaire erronée provient de l’hypothèse fausse que l’ammoniaque aurait pour formule NH4OH(xvii).
Si l’ammoniac est connu depuis l’Antiquité par ses usages qui perdurent et satisfont les consommateurs, son identification ne date que de la fin du XVIIIe siècle et est due à Claude Louis Berthollet(xviii).
Et qu’en est-il des dénominations ammoniac ou ammoniaque et des formules chimiques NH3 ou NH4OH associées ? Cette chronique illustre que la chimie est une science étudiant des phénomènes complexes à modéliser dont l’interprétation ne fait pas nécessairement l’unanimité et évolue en fonction des connaissances.
Lydie Amann et Françoise Brénon et l’équipe question du mois
(i) du grec Ammoniakon, « de Ammôn », nom grec d'Amon, dieu égyptien, car on extrayait près du temple d’Ammon en Lybie un minerai nommé salmiac, qui libérait ce gaz. Le salmiac contient du chlorure d’ammonium NH4Cl.
(ii) Consulter Comment fabriquer des engrais avec de l'air ? La synthèse de l'ammoniac [5]
(iii) Pour l’argenterie, le noircissement de l’argent étant lié à la formation de sulfure d’argent très stable, l’ammoniac ne suffit pas à le détruire par complexation. Pour en savoir plus : Nettoyer l’argenterie par « une recette de grand-mère » : comment ça marche ? [6]
(iv) Pour en savoir plus Pourquoi ça frise ou ça défrise ? [7]
(v) Ce calcul résulte de la valeur de la constante d’équilibre
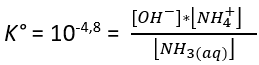
On notera que 17 g de NH3 correspond à 1 mol d’ammoniac soit environ la dissolution de 25 L de gaz à température ambiante.
(vi) Voir la bonne définition du Larousse https://www.larousse.fr/dictionnaires/francais/ammoniaque/2936 [8]
(vii) On lira avec intérêt cet article du Chemical Education Why We Are all Using a Nonexistent Substance: NH4OH [9]
(viii) L’acidité et la basicité d’une solution aqueuse sont mesurées sur une même échelle par le pH, grandeur reliée à la concentration en ions H+aq par pH = - log[H+aq].
Les concentrations en H+aq et OH-aq étant toujours liées par la relation [H+aq] * [OH-aq] = Cte. On considère qu’une solution est basique si son pH est supérieur à 7 et acide si pH <7.
(ix) En prenant le même exemple que précédemment (cf. note v), le pH de cette solution vaut 11,6.
(x) On peut consulter la fiche de toxicologie de l’ammoniac sur le site de l’INRS ici [10].
(xi) La réaction mise en jeu est : HCl (gaz) + NH3 (gaz) → NH4Cl (s). À ce sujet consulter l’anecdote historique La chimie contre les mauvaises odeurs [11].
(xii) La teneur en ammoniac dans l’air y est de l’ordre de 23 ppm (partie par million en volume dans l’air (mL/m3) d’après le CIGC - Comité Interprofessionnel de Gestion du Comté).
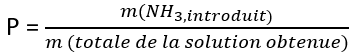
(xiv) Compte tenu de l’équilibre (A) très peu déplacé, la masse d’ammoniac introduite est quasiment égale à la masse de NH3(aq) à l’équilibre.
(xv) La masse volumique se calcule par la relation ρ = d*ρ(eau) sachant que ρ(eau) = 1 kg/L
(xvi) Le numéro CAS de la solution aqueuse est : 1336-21-6 et celui du gaz est 7664-41-7.
Il s’agit de son numéro d'enregistrement unique auprès de la banque de données de Chemical Abstracts Service.
(xvii) Exemple : Le chimiste dans son laboratoire prend une bouteille et étudie l’étiquette pour en connaitre les caractéristiques. Il lit par exemple : P = 28% ρ = 0,90 kg/L et M = 35,05 g/mol. Une autre bouteille donne les mêmes informations sauf au niveau de la masse molaire M = 17 g/mol.
Or, l’expression de la concentration molaire exprimée en mol /L a pour expression : C = P* ρ /M .
Ainsi, l’application numérique pour la bouteille 1 donne donc C voisine de 7,2 mol. L-1 et pour la bouteille 2 de 15 mol. L-1, le facteur 2 provenant du facteur 2 entre les 2 masses molaires. Pourtant les dosages acido-basiques de ces 2 solutions montrent que chacune des 2 bouteilles a une concentration en ammoniac NH3 voisine de 15 mol/L. L’erreur provient du fait que l’ammoniaque est assimilée à l’hydroxyde d’ammonium NH4OH en solution (d’où M = 14 + 16 + 5 = 35 g.mol-1) ce qui est erroné comme l’a montré l’étude de l’équilibre de dissolution dans lequel l’ammoniac reste essentiellement sous la forme NH3(aq).
(xviii) voir Berthollet et la découverte de la composition de l’ammoniac [12]
Crédits illustration : DR. F. Brénon pour Mediachimie
Liens:
[1] https://www.mediachimie.org/send-friend/3958/?ajax
[2] https://www.mediachimie.org/print/print/3958
[3] https://www.mediachimie.org/actualite/pourquoi-utiliser-de-l%E2%80%99ammoniac-ou-de-l%E2%80%99ammoniaque-dans-des-applications-domestiques#not-i
[4] https://www.mediachimie.org/actualite/pourquoi-utiliser-de-l%E2%80%99ammoniac-ou-de-l%E2%80%99ammoniaque-dans-des-applications-domestiques#not-ii
[5] https://www.mediachimie.org/ressource/comment-fabriquer-des-engrais-avec-de-lair-la-synthèse-de-lammoniac
[6] https://www.mediachimie.org/actualite/nettoyer-l%E2%80%99argenterie-par-%C2%AB-une-recette-de-grand-m%C3%A8re-%C2%BB-comment-%C3%A7a-marche
[7] https://www.mediachimie.org/actualite/pourquoi-ça-frise-ou-ça-défrise
[8] https://www.larousse.fr/dictionnaires/francais/ammoniaque/2936
[9] https://chimia.ch/chimia/article/view/2021_679/6
[10] https://www.inrs.fr/publications/bdd/fichetox/fiche.html?refINRS=FICHETOX_16
[11] https://www.mediachimie.org/ressource/la-chimie-contre-les-mauvaises-odeurs
[12] https://www.mediachimie.org/ressource/berthollet-et-la-découverte-de-la-composition-de-l’ammoniac