

Lise Meitner, brillante physicienne d’origine autrichienne, a fait la découverte majeure de la fission nucléaire. Mais elle n’a pas pour autant reçu le Prix Nobel mérité. Pacifiste, elle a refusé de s’associer au programme menant à la bombe atomique.
Il y a trois cents ans, le 10 juillet 1724, en Suède, nait Eva de La Gardie, plus connue sous le nom de son époux Eva Ekeblad. Elle côtoie les paysans, cherche un moyen de lutter contre les famines et propose de généraliser la culture de la pomme de terre. Cette dernière a été introduite en Suède en 1658 par le naturaliste Olof Rudbeck (1630-1702) dans le jardin botanique d’Uppsala.
En 1746, Eva Ekeblad écrit à l’Académie royale des sciences de Suède afin de présenter les travaux qu’elle a effectués sur la pomme de terre. Cette Académie a été fondée en 1739. Eva Ekeblad a transformé les pommes de terre en farine de pomme de terre et en alcool. Dans sa cuisine, elle a cuit les pommes de terre, les a écrasées puis les a séchées afin d’obtenir une poudre fine comparable à la farine de blé. Cette farine est utilisée en pâtisserie. Eva Ekeblad va aussi faire fermenter puis distiller cette pomme de terre écrasée afin d’obtenir de l’éthanol. Cet alcool va donner de la vodka. Jonas Alströmer (1685-1761) et Jacob Faggot (1699-1777), membres de l’Académie, étudient les travaux et deux ans plus tard, Eva Ekeblad devient la première femme membre de l’Académie royale des sciences de Suède. Ses travaux sont publiés dans les Actes de l’Académie en 1748 sous son nom de jeune fille Eva de La Gardie avec pour titre Tentatives de fabrication de pain, d’eau de vie, d’amidon et de poudre de pomme de terre. Il n’existe aucune trace de sa présence aux réunions de l’Académie et en 1751, elle est qualifiée de membre honoraire car seuls les hommes sont admis. En 1752, dans les Actes de l’Académie, un nouveau texte parait sous son nom de jeune fille « Description du savon adapté au blanchiment du fil de coton ».
Dans les cosmétiques, Eva Ekeblad remplace les produits dangereux par de la farine de pomme de terre. La farine de pomme de terre ne doit pas être confondue avec la farine de fécule de pomme de terre. Pour préparer de la farine de pomme de terre on utilise des pommes de terre entières, la farine a la même composition et le goût de la pomme de terre. La farine de fécule de pomme de terre ne contient que l’amidon de la pomme de terre, elle n’a pas de goût, c’est une poudre légère et qui sert d’épaississant en cuisine.
Eva Ekeblad aurait orné sa coiffure de fleurs de pommes de terre.
Son travail a permis la généralisation de la culture de la pomme de terre, il a réduit les risques de famine et les crises alimentaires.


À gauche : Portrait d'Eva de la Gardie (1724-1786) par Gustaf Lundberg (1695-1786).
À droite : Solanum tuberosum L., Atlas des plantes de France (1891).
Pour en savoir plus
Crédits illustrations :
- Portrait d'Eva de la Gardie, source Wikimedia Commons, domaine public.
- Solanum tuberosum L., Atlas des plantes de France (1891), source Wikimedia Commons, domaine public.
Les plantes peuvent soigner mais peuvent aussi être des poisons mortels, d'où l'intérêt de la célèbre romancière pour ces substances, qu'elle a connues comme pharmacienne pendant la guerre de 14-18 dans un hôpital militaire. La coca a vu de nombreuses applications, dont un fameux soda.
Dominant le Jardin des Plantes à Paris, la Gloriette du Muséum est une des plus anciennes constructions métalliques, fabriquée au XVIIIe siècle dans les forges de Buffon. Mais les métaux, ça s’oxyde…
Comment le chimiste Pierre Potier parvient à extraire des feuilles de l'if européen des molécules pour conduire à l'un des médicaments anticancéreux les plus utilisés dans le monde. Une vraie success story !
L’eau, un corps simple ? Pas si simple. Depuis l’Antiquité, la compréhension de ce fluide vital n’a cessé d’évoluer.
L’œuvre du grand chimiste Antoine Laurent de Lavoisier et sa réception sont indissociables du travail de son épouse : dessins minutieux des appareils de laboratoire et des expériences, tenue des cahiers de laboratoire, relation avec les chimistes étrangers, diffusion de son œuvre.
En 1856, le jeune William Perkin âgé de 18 ans étudie la chimie au Royal College of Chemistry de Londres sous la direction d’August Wilhelm von Hofmann (1818-1892), chimiste organicien expert en goudron de houille. Von Hofmann, élève de Justus Liebig (1803-1873) à Giessen, avait été recruté en 1845 comme directeur d’une nouvelle école de chimie pratique à Londres sous l’égide du Royal College of Chemistry. Ses recherches sur le goudron de houille, puis sur le gaz de ville (ou naphta) l’avaient conduit à découvrir l’aniline.
Dans ses mémoires, William Perkin explique que, en réponse à un concours lancé par Hofmann, il a effectué des recherches pendant les vacances de Pâques, dans son petit laboratoire personnel. Son projet était de réaliser la synthèse de la quinine dont la structure moléculaire n’était pas alors connue, avec pour objectif de « combattre le paludisme qui touchait les troupes qui défendaient aux Indes l’honneur britannique ». Perkin précise : « Après plusieurs essais j’en arrivais à oxyder un dérivé de l’aniline, la N-allyl-toluidine ». Car pour obtenir la quinine, il pensait qu’on pouvait y arriver par l’oxydation de deux molécules de N-allyl-toluidine. C’est ce qui pouvait être imaginé, sur la base des formules brutes, en comptant le nombre des atomes des molécules avant et après l’oxydation prévue. Les formules développées n’étaient pas alors connues, mais les formules brutes l’étaient. Pour le jeune Perkin, l’oxydation de la N-allyl-toluidine (C10H13N) était supposée former la quinine (C20H24N2O2) selon l’équation :
2 C10H13N + 3O -> C20H24N2O2 +H2O
Mais les structures développées du produit obtenu et de la quinine n’ont aucun rapport.
Cependant, lorsque Perkin a fait cette réaction avec du dichromate de potassium, il n’a obtenu qu’une boue brunâtre irrécupérable qu’il dut mettre à l’évier. C’est alors qu’il refait la réaction en oxydant par du bichromate de potassium de l’aniline contenant comme impuretés des α- et β-toluidines. Il décrit ainsi sa découverte : « J’obtins vite un splendide précipité rouge brun. Bien sûr, ce composé n’avait rien à voir avec la quinine artificielle que je recherchais, mais il éveilla ma curiosité de chimiste, car ayant renversé une petite éprouvette, je vis qu’il produisait sur le parquet et sur ma blouse des tâches certes de belle couleur, mais surtout indélébiles. Sans le savoir je venais d’inventer ce colorant de bonne tenue dont l’industrie textile avait tant besoin ».
De la pâte goudronneuse obtenue, il extrait par de l’éthanol une solution violette colorée par une substance qu’il nomme mauvéine.
De nos jours nous connaissons les formules développées de tous ces composés.
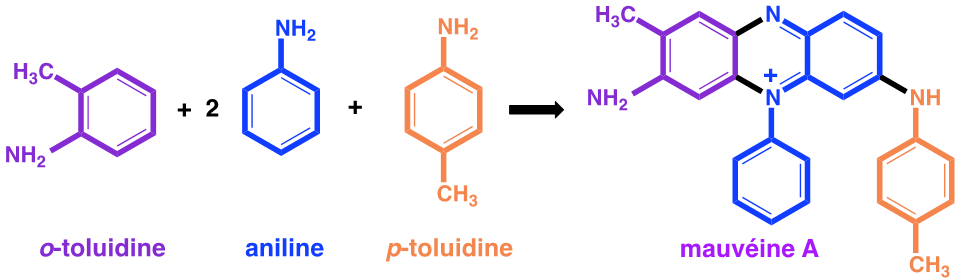
Figure 1 : Synthèse de la mauvéine A
On constate que la structure de la mauvéine ne ressemble pas du tout à celle de la quinine dont la formule est :
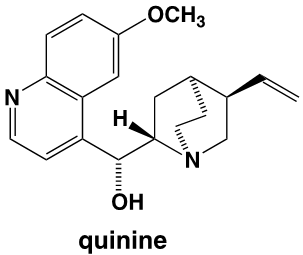
Les colorants naturels étaient très coûteux et difficiles à obtenir. C’est sur le conseil de sa femme qu’il donnera le nom de mauvéine à cette couleur en référence à la fleur « mauve (Malva sylvestris) ». Perkin dépose un brevet le 26 août 1856, démissionne de la Royal Society of Chemistry contre l’avis d’Hofmann et mobilise sa famille pour fonder avec son père et son frère une entreprise à Greenford dans la banlieue de Londres pour développer son invention. Elle a marqué la naissance de l’industrie chimique organique. Il lui faudra perfectionner sa fabrication, stabiliser la fixation du colorant sur les tissus et rendre le prix attractif. La concurrence des teinturiers étrangers dont les lyonnais qui apprennent en 1857 l’arrivée de ce nouveau produit sera rude, et surtout va susciter de nombreuses contrefaçons en Europe où le brevet anglais ne s’appliquait pas. Pour Perkin, qui a une longueur d’avance sur les autres chimistes, le succès sera éclatant. Par ailleurs, à partir des années 1860-1870, les chimistes allemands créeront une puissante industrie de matières colorantes, en particulier la Badische Anilin und Soda Fabrik (BASF).
Très rapidement la couleur mauve devient à la mode dans toute l’Europe et une véritable fureur va en effet s’en emparer. En 1862, la reine Victoria apparut à l’Exposition internationale de Londres dans une robe en soie teinte en mauve par le colorant de Perkin et porte cette couleur dans toutes les grandes occasions. À Paris l’impératrice Eugénie s’en entiche et porte aussi des robes mauves. Ce sera la couleur du timbre anglais de 2 pence en 1882.
Perkin se retire des affaires en 1874 à 36 ans. Il continue ensuite des recherches en chimie organique, découvre la « réaction de Perkin » qui lui permet de réaliser la synthèse de coumarines, à la base de l’industrie des parfums synthétiques. Il publie environ 60 articles, principalement dans le Journal of the Chemical Society, devenu « JCS Perkin ». Il meurt en 1907 d’une pneumonie à Arrow dans la banlieue de Londres. Cette découverte est un exemple type de sérendipité* en chimie.

L'usine de Greenford en 1858. Credit: Wellcome Collection. Licence CC BY 4.0
* La sérendipité est la science des découvertes imprévues. Les Trois Princes de Serendip est un conte oriental décrivant les nombreuses aventures de ces princes au cours desquelles ils utilisent de ténus indices pour remonter logiquement à des faits dont ils ne pouvaient avoir connaissance. (Sérendip est le nom en persan de Ceylan, aujourd’hui Sri Lanka). L’exemple type de cette démarche est Christophe Colomb qui cherche la route des Indes et trouve l'Amérique. C’est aussi ce que Pasteur nommera « le hasard dans un esprit préparé ».
Pour en savoir plus
Si Mendeleïev est très connu pour sa classification des éléments, ses premiers travaux de chimie ont porté sur un sujet bien différent : la contraction des mélanges eau/alcool. Par la suite, à tort, on lui a attribué une découverte étonnante concernant la vodka !
Une pile : quel nom étrange ? Quelles sont donc les « choses empilées » dans cet objet ? Pour cela, il faut remonter à la fin du 18e siècle et aux observations de Galvani sur ce qu’il appelait alors « l’électricité animale ».
Luigi Galvani (1737 - 1798) était professeur d’anatomie à l’université de Bologne en Italie, ville pionnière pour l’enseignement de cette science. Au cours de la dissection d’une grenouille dans un laboratoire où étaient présentes des machines électrostatiques, l’un des assistants de Galvani, en touchant avec son scalpel le nerf crural de la grenouille, constata la contraction du muscle de la cuisse, en même temps qu’une étincelle éclatait dans une machine électrostatique à proximité.
Très intrigué par cette découverte, et après de nombreux autres essais, Galvani s’aperçu que cette contraction pouvait aussi être obtenue lorsque l’on mettait en contact deux fils constitués de deux métaux différents, reliés l’un au nerf crural et l’autre au muscle de la cuisse (l’« arc galvanique »). Il en tira la conclusion que les contractions seraient dues à une « électricité animale » qui proviendrait de l’animal et se déchargerait lorsque nerf et muscle seraient reliés par les métaux.
Alessandro Volta (1745-1827) était, lui, professeur de physique à l’université de Pavie. Très intéressé par les expériences de Galvani, il les reproduisit mais eut rapidement des doutes sur l’origine animale de l’électricité. Il lui est venu l’idée, pour amplifier l’effet, d’empiler alternativement des disques de métaux différents, d’abord du zinc et de l’argent, puis du zinc et du cuivre, séparés par des rondelles de carton imprégnées d’une solution saline, par analogie avec les « humeurs » au sein des organismes animaux. Il observa que cette pile pouvait le « frapper » quand il touchait les deux extrémités avec les mains nues, de façon analogue à une bouteille de Leyde (1). Mais, contrairement à cette dernière, déchargée après le premier contact, et à sa surprise, le « choc » était renouvelé à chaque fois qu’il touchait la pile. La pile électrique était donc née.
Les chimistes vont s’approprier cette invention, présentée par Volta, en 1800, à Paris, à l’Académie des Sciences devant Bonaparte, puis à Londres. Davy, à Londres, l’utilise pour isoler le sodium et le potassium, en 1807. Ensuite Gay Lussac et Thenard, isoleront en 1810, à leur tour, ces deux métaux, en utilisant « la grande pile », installée à l’école Polytechnique et construite grâce à un financement de l’empereur Napoléon. C’est la naissance de l’électrochimie.
(1) La bouteille de Leyde, connue depuis 1745, est constituée par une bouteille en verre d’où sort par le goulot une tige métallique, remplie de feuilles d’étain chiffonnées et entourée d’une feuille métallique. Elle était utilisée comme curiosité dans les foires pour donner des chocs électrostatiques.
Pour en savoir plus
Ressources issues du site Histoire de l’électricité et du magnétisme (CNRS) :

Gravure de U. Parent, extraite de L. Figuier, Les Merveilles de la science, 1867, p. 669 (collection privée)
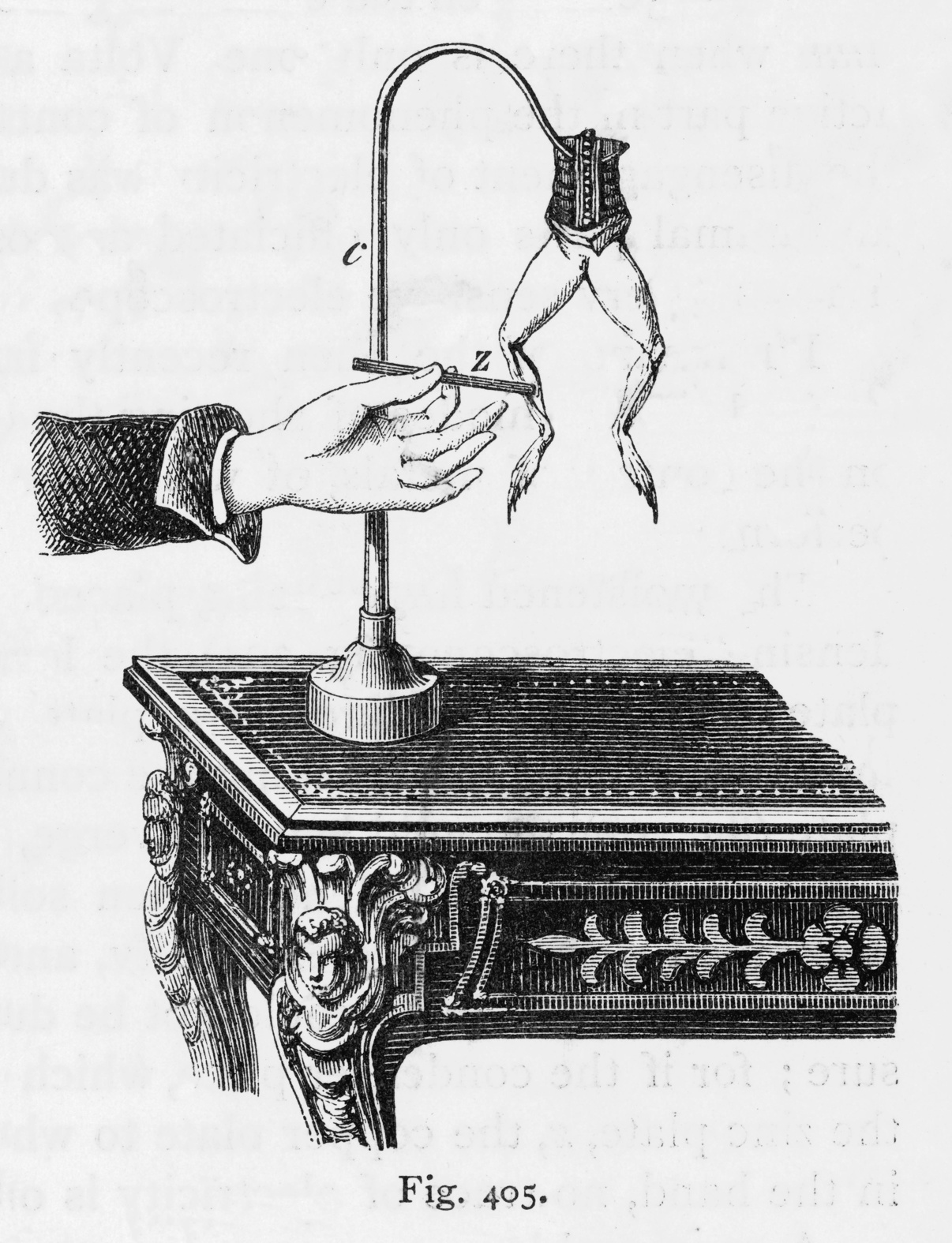
Expérience de Galvani sur une grenouille (image : Archivist Adobe Stock)