Zoom sur les radicaux : quelques aspects particuliers…

Les radicaux sont des espèces chimiques possédant au moins un électron non apparié. La spectroscopie paramagnétique électronique (RPE) permet de détecter ces espèces radicalaires.
Structure des radicaux carbonés [1]
Il existe essentiellement quatre types d’espèces carbonées dans lesquelles l’atome de carbone n’est pas tétravalent : il s’agit des carbanions, des carbocations, des carbènes (R2C portant à la fois une lacune électronique et un doublet non liant) et des radicaux carbonés. Parmi eux seuls les carbanions respectent la règle de l’octet.
Exemples
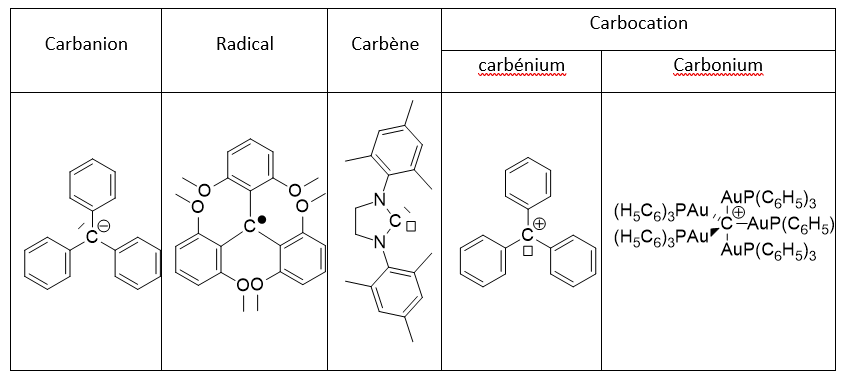
L’activité optique d’une molécule ne possédant qu’un atome de carbone asymétrique est « perdue » lorsqu’on forme le radical carboné associé : on peut considérer alors que la structure devient plane. Cependant des mesures par RPE montrent que le radical tert-butyle est pyramidal avec une barrière d’inversion très faible, autour de 7-8 kJ.mol-1. On peut donc dire qu’à température ambiante le radical carboné apparaît « dynamiquement » plan, autrement dit tout se passe comme s’il était plan !
Il en est de même pour les radicaux éthyléniques Z ou E qui sont en équilibre et ne conservent pas l’information de la configuration Z ou E.
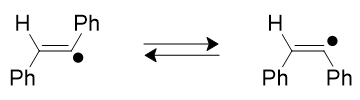
Figure 1
Stabilité des radicaux carbonés [2]
- Les radicaux sont des espèces très réactives avec en général une durée de vie très courte. Par exemple le radical méthyle a une demi-vie de l’ordre de 10 minutes. Cependant quelques radicaux sont stables, citons le radical (C6Cl5)3C▪ qui est stable pendant plusieurs jours en solution et stable sous forme solide.
- Un radical peut être stabilisé par la présence d’hétéroatomes adjacents possédant un « doublet non liant » : l’interprétation est la stabilisation par la délocalisation électronique dans le cadre de la théorie des orbitales moléculaires entre l’orbitale à deux électrons de l’hétéroatome et l’orbitale moléculaire occupée par 1 électron de l’atome radical.
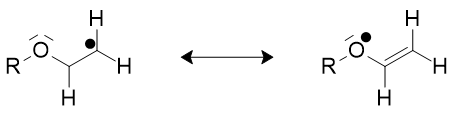
Figure 2
Source des radicaux [3]
Si la rupture homolytique d’une liaison donne naissance a priori à deux espèces moléculaires radicalaires, les conditions expérimentales sont difficiles à mettre en œuvre. On peut employer un amorceur comportant une liaison fragile thermiquement permettant d’initier ultérieurement la rupture de la liaison souhaitée. On peut aussi provoquer la rupture par apport d’énergie sous forme de lumière à des longueurs d’onde bien spécifiques comme le montrent les exemples suivants :
- les composés peroxydes possédant une liaison O-O de faible enthalpie de liaison de l’ordre de 130 kJ.mol-1 conduisent à des radicaux par la cassure de cette liaison vers 100°C ;
- les composés azoïques possédant une liaison N=N se rompent dès 60°C ;
- les molécules avec une liaison Sn-Sn sont décomposées à l’issue d’une excitation lumineuse ;
- les composés stanneux avec une liaison Sn-H, comme l’hydrure de tributylétain Bu3SnH, découvert par D.Barton (Prix Nobel de chimie en 1969) permettent l’obtention d’un radical Bu3Sn▪. Ce composé a été très employé, mais sa toxicité observée lors d’expositions prolongées a entraîné une diminution progressive de son utilisation ;
- on a utilisé depuis des composés contenant du bore en particulier des alkylboranes, tels que Et3B, qui en présence du dioxygène de l’air, conduisent à la formation du radical éthyle (Et▪) ;
- ou encore des composés contenant du silicium tels que H-SiCl3 mais nécessitant l’emploi d’un catalyseur de photodissociation à l’iridium ;
- actuellement des décharges dans des plasmas (par onde sonore, laser ou UV) permettent de générer des espèces radicalaires à pression atmosphérique et à température ambiante sans amorceur !
Principe de la réactivité des radicaux [4]
De nombreuses réactions radicalaires font intervenir un processus mécanistique « en chaîne » qui est un mécanisme à séquence fermée comportant trois étapes principales : l’amorçage, la propagation et la terminaison (par recombinaison). Il est important de mentionner aussi les réactions de transfert d’un radical à une autre espèce chimique moléculaire présente dans le milieu réactionnel.
Il est intéressant de prévoir approximativement la réactivité des radicaux par la théorie des orbitales frontalières : l’électron célibataire occupe l’orbitale moléculaire la plus haute appelée SOMO (en anglais Singly Occupied Molecular Orbital) selon les règles de remplissage de Pauli. L’expérience montre qu’il existe des radicaux nucléophiles et des radicaux électrophiles.
Dans le cadre de la théorie des orbitales frontalières un radical possédant un groupe électrodonneur (ou respectivement électroattracteur) a une SOMO rehaussée (ou respectivement abaissée) et possède alors un caractère nucléophile (ou électrophile). Un radical nucléophile (ou électrophile) réagira de préférence avec une molécule par l’intermédiaire de sa BV (ou sa HO) d’une autre molécule, et ceci d’autant plus si les deux niveaux d’énergie des deux orbitales sont proches : c’est en particulier ce qui explique la réactivité des radicaux avec les composés éthyléniques activés par des groupes attracteur ou donneur. Par exemple dans le styrène le groupe phényle est électrodonneur.
Figure 3
Cependant il existe des composés éthyléniques qui possèdent, à la fois sur un des deux atomes de carbone de la double liaison, un groupe attracteur et un autre donneur d’électron qui sous l’action d’un amorceur conduisent à des radicaux stabilisés par délocalisation électronique par exemple
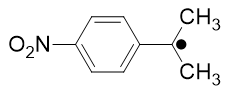
Figure 4
On parle alors d’effet captodatif selon la nomenclature de Viehe qui a isolé de tels radicaux en 1988 à l’Université de Louvain en Belgique.
Un point anecdotique mais révélateur de l’intérêt des radicaux : la réaction du chlorure de méthylmagnésium dans le solvant THF sur de l’éthanal, traditionnellement expliquée par une coupure hétérolytique C-Mg, est plutôt envisagée actuellement par un mécanisme à plusieurs étapes avec en particulier une coupure homolytique de la liaison carbone-métal sur un état intermédiaire parmi les états intermédiaires et de transition, provenant de travaux de simulation théorique. Cette interprétation provient notamment des travaux de O. Eisenstein à Montpellier publiés en 2020 soit plus de cent vingt ans après la découverte de cette réaction par Victor Grignard !
Polymérisation radicalaire [4]
La polymérisation des alcènes est difficile à contrôler à cause des réactions de transfert d’un radical au polymère et/ou au monomère qui créent des ramifications lors de l’allongement de la chaîne. Cependant depuis vingt ans, des travaux ont permis de réaliser une polymérisation radicalaire contrôlée par transfert de chaîne réversible par addition-fragmentation appelée Reversible Addition- Fragmentation Chain Transfer (RAFT) en anglais. Les principaux agents de transfert sont des dérivés soufrés du type
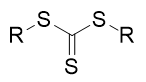
Figure 5
Ainsi S. Zard (École Polytechnique) en France a développé en collaboration avec Rhodia, devenu depuis Solvay, la technologie MADIX (en anglais Macromolecular Design by Interchange of Xanthates) qui met en jeu des xanthates S (C=S) OR. Ces derniers permettent alors la formation du radical R▪ qui a une durée de vie suffisante lui permettant de réagir même avec un alcène non activé par une fonction. Les résultats excellents obtenus au laboratoire ont entraîné le dépôt de plusieurs centaines de brevets depuis 1997 ! Les applications sont multiples dans le domaine des adhésifs, des traitements de surface, tensioactifs et cosmétiques. Par exemple l’équipe de S. Zard a mis au point et la société Rhodia a commercialisé des copolymères diblocs employés principalement dans le domaine du traitement de l’eau.
Formation des molécules dans le milieu interstellaire (MIS) [5], [6]
Le MIS englobe tout l’espace qui se trouve entre les étoiles ou à leur voisinage.
Une partie des molécules interstellaires observées dans le MIS résultent de chaînes de réactions impliquant des radicaux en phase gazeuse. Mais certaines molécules nécessitent la présence de grains de poussière interstellaires pour activer des réactions chimiques entre les atomes à leur surface (catalyse hétérogène). L’omniprésence de la molécule de dihydrogène, avec une densité allant de 100 à 108 atomes d’hydrogène par cm3, s’explique par la dissociation du dihydrogène en atomes sous l’excitation du fort rayonnement solaire suivie par une recombinaison en molécules sur les grains de poussière dans des zones non illuminées par le rayonnement solaire.
Le MIS contient de nombreuses molécules possédant l’élément carbone. Pour des photons d’énergie suffisante, l’étape photochimique de départ engendre des radicaux qui peuvent entrer dans des chaînes de réaction conduisant à des molécules de plus en plus complexes jusqu’à des systèmes dits prébiotiques tels que les acides nucléiques comme la cytosine et l’uracyle.
Signalons que le di-radical éthynyle de formule 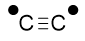 noté C2▪▪ a été observé dès la fin du XIXe siècle dans les comètes ; en particulier Jackson en 1976 a montré dans la comète de Halley l’existence de l’acétylène (éthyne) qui provient du radical C2▪▪, observé en spectroscopie en lumière visible lors de phénomènes de relaxation.
noté C2▪▪ a été observé dès la fin du XIXe siècle dans les comètes ; en particulier Jackson en 1976 a montré dans la comète de Halley l’existence de l’acétylène (éthyne) qui provient du radical C2▪▪, observé en spectroscopie en lumière visible lors de phénomènes de relaxation.
Radicaux non carbonés
Rappelons que le dioxygène moléculaire est un diradical moléculaire dans son état stable ! Le remplissage des orbitales moléculaires selon les règles de Pauli et de Hund conduit en effet à l’occupation de chacune des deux orbitales antiliantes de type pi. Ainsi l’oxydation de l’isopropylbenzène par l’oxygène de l’air donne le radical cumyle (Me)2 C▪-Ph qui conduit au phénol et à l’acétone, procédé réalisé industriellement.
L’exemple le plus important est la molécule NO. C’est une espèce radicalaire stable possédant une double liaison entre N et O et un électron non apparié. Il a été mis en évidence dès 1986 dans plusieurs systèmes biologiques par des mesures de spectrométrie de masse et de chimiluminescence. Dans la nature il peut réagir avec le dioxygène moléculaire (diradical !) ou des métaux de transition engagés dans des molécules complexes telles que l’hémoglobine. La durée de vie de quelques secondes des radicaux intermédiaires conduit à des réactions très rapides rendant difficile la détection dans les milieux biologiques. Le monoxyde d’azote NO a une action antibactérienne (également sur des cellules tumorales) et antiparasitaire. Cependant, il ne faut pas oublier que NO est un polluant présent dans la fumée de cigarette ou dans certains milieux urbains et industriels. En effet, à des concentrations de 100 ppm dans l’air il altère les tissus pulmonaires ; sa toxicité provient de son oxydation par la molécule de dioxygène qui conduit au dioxyde d’azote NO2 réputé très toxique !
Note : Je tiens ici à remercier vivement Julien Lalande pour ses nombreuses corrections de syntaxe ainsi que les formules des molécules et aussi pour les belles discussions sur le sujet !
Bibliographie :
[1] Cours de J.Y. Lallemand de l’École polytechnique : communication personnelle (1998)
[2] Livre de J. Fossey et coll. : les réactions radicalaires en chimie organique (1995) chez Masson
[3] L. Fensterbank – Nouvelles catalyses pour accéder à la complexité moléculaire article téléchargeable de l’Actualité Chimique, N° 435 décembre 2018, pages 13 et suivantes
[4] S. Zard et coll., Une quête de nouvelles réactions pour la synthèse organique article téléchargeable de l’Actualité Chimique, N° double 393-394 février-mars 2015 page 48 et suivantes
[5] Coordinateurs S.Leach et E. Amouyal, Molécules et interstellaires et photochimie dans l’espace, dossier téléchargeable de 4 articles de l’Actualité Chimique N° 315 janvier 2008 pages I à XXIII
[6] Michel Guelin, Molécules dans l’Univers : Où ? Quand ? Comment ? Pourquoi ? conférence et article, site Mediachimie.org, Colloque Chimie, aéronautique et espace du 8 novembre 2017, Chimie, aéronautique et espace (2018) EDP Sciences, ISBN9782759822836 p. 183
Crédit illustration : image par PublicDomainPictures de Pixabay
