La photosynthèse artificielle : une utilisation du dioxyde de carbone comme matière première
Non le gaz carbonique n’est pas un polluant, chimistes et biochimistes répètent à l’envie : le CO2 c’est aussi la vie ! (1) En effet si le carbone est l’élément essentiel du monde vivant, couplé à deux oxygènes et caressant une feuille sous le soleil et en présence d’eau, il permet aux végétaux de produire des molécules organiques telles que les sucres et la cellulose, âmes de la biomasse. Cette réaction naturelle de la photosynthèse fascine depuis longtemps les chercheurs qui rêvent de la reproduire (2).
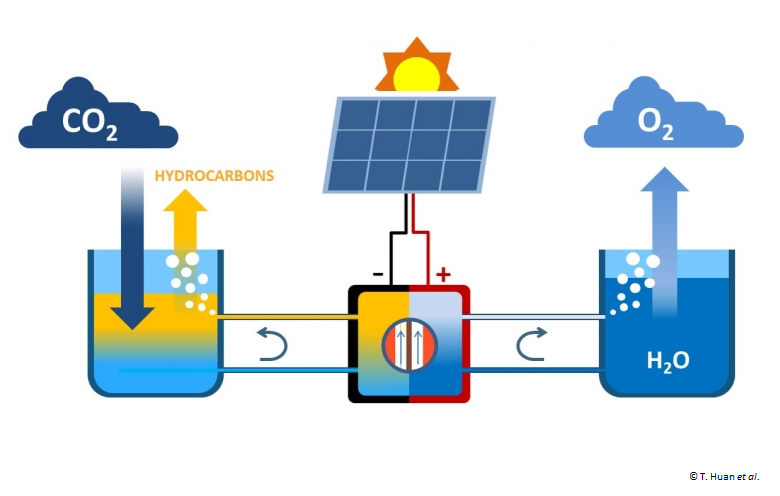
Depuis plus de vingt ans, l’imagination des électrochimistes a permis de belles avancées (3). Le schéma le plus efficient couple une cellule photovoltaïque (4) qui sous rayonnement solaire fournit des électrons à une cellule électrochimique qui oxyde l’eau à l’anode et réduit le CO2 à la cathode.
Plusieurs réalisations ont déjà vu le jour fournissant à partir du CO2 du CO, des alcools, des acides organiques et même du méthane. Les rendements ont été parfois très corrects et supérieurs à celui de la photosynthèse naturelle, mais ils nécessitent le plus souvent des matériaux peu abondants et coûteux - des semiconducteurs de type AsGa, des catalyseurs à base de métaux précieux (rhodium, iridium, platine…) - rendant ces cellules difficilement extrapolables à grande échelle.
Pour passer à une échelle industrielle, ces systèmes mimant la photosynthèse naturelle doivent remplir plusieurs conditions :
- une réduction catalytique efficace du CO2 avec des électrocatalyseurs ne comportant pas de métaux rares ou chers (5) ;
- un milieu électrolytique stable et de pH peu acide pour limiter la corrosion ;
- un design de cellule avec une répartition des compartiments anodiques et cathodiques optimales pour éviter les pertes ohmiques ;
- un couplage à un système photovoltaïque robuste et peu coûteux.
C’est ce qu’a réussi un groupe de chercheurs européens coordonné par le Laboratoire de Chimie des Processus Biologiques (LCPB) du Collège de France (*). Après des années de recherche ce groupe a mis au point un système comprenant :
- une cellule d’électrocatalyse optimisée avec une distance anode-cathode réduite permettant un courant stable sous une tension inférieure à 3V ;
- des solutions électrolytes peu corrosives comportant des concentrations stabilisantes de bicarbonate ou carbonate de cesium ;
- des matériaux d’électrodes à base de cuivre où à la cathode sont présentes des couches d’oxyde Cu2O et CuO (6), la dernière montrant une structure dendritique nanostructurée poreuse ;
- une cellule photovoltaïque originale constituée de pérovskite (7) de type CH3NH3 Pb I3-x Brx fabriquée simplement par multicouches fonctionnelles avec des éléments abondants.
En fonctionnement, sous un flux de gaz CO2, la réduction de ce gaz et l’oxydation de l’eau fournissent des mélanges d’hydrocarbures tels que C2H4, C2H6, et CO, H2 bases de la chimie organique. Le rendement calculé par rapport à CO2 est de 2,3% (plus élevé que les 1% de la photosynthèse naturelle). Ce qui est important à souligner est que ce nouveau procédé mêle au moins deux innovations :
- une cellule électrocatalytique utilisant un métal abondant et très utilisé le cuivre
- et un générateur photovoltaïque à base de pérovskite se fabriquant à température ordinaire par sérigraphie de multicouches de matériaux peu coûteux, dont la fabrication industrielle commence.
Bien sûr des études complémentaires de procédés sont à faire car la cellule fonctionne avec du dioxyde de carbone pur alors que dans l’atmosphère (8) il est dilué à 400 ppm. L’augmentation des surfaces de contact ou le captage et la concentration peuvent être des solutions futures pour le développement industriel (9). Alors on peut se mettre à rêver à une économie de carbone en cycle fermé, en imaginant que nos combustibles seraient issus du même dioxyde de carbone produit par leur combustion. Voilà une belle solution à l’épuisement des ressources carbonées fossiles.
Jean-Claude Bernier et Catherine Vialle
Mai 2019

Pour en savoir plus
(1) Le CO2, matière première de la vie (Chimie et … Junior)
(2) Que faire du CO2 ? De la chimie !
(3) Les nouvelles cellules solaires nanocristallines
(4) Le soleil comme source d’énergie – le photovoltaïque
(5) Énergie électrique et réduction du dioxyde de carbone : quels électrocatalyseurs ?
(6) Expérience de réduction de l’oxyde de cuivre II (The reduction of copper oxide)
(7) Cristaux, cristallographie et cristallochimie
(8) Atmosphère ! Atmosphère ! Alerte !
(9) Le dioxyde de carbone : enjeux énergétiques et industriels
(*) Low-cost high-efficiency system for solar-driven conversion of CO2 to hydrocarbons, Tran Ngoc Huan, Daniel Alves Dalla Corte, Sarah Lamaison, Dilan Karapinar, Lukas Lutz, Nicolas Menguy, Martin Foldyna, Silver-Hamill Turren-Cruz, Anders Hagfeldt, Federico Bella, Marc Fontecave, Victor Mougel, Proceedings of the National Academy of Sciences Mar 2019, 201815412
DOI: 10.1073/pnas.1815412116
