Le prix Nobel 2017 de chimie
Cette année, le prix Nobel de chimie a été décerné à trois scientifiques Jacques Dubochet de l’université de Lausanne, Joachim Frank de l’université Columbia à New York et Richard Henderson de Cambridge. Les trois lauréats ont été récompensés pour avoir mis au point la technique de cryo-microscopie électronique capable de déterminer la structure à haute résolution des protéines. La structure et l’image des grosses protéines sont des challenges en sciences du vivant, ne serait-ce que pour trouver les moyens chimiques de les modifier pour altérer et tuer bactéries et virus. Les Rayons X grâce aux faisceaux des synchrotrons et les microscopes électroniques sont les outils de déterminations structurales classiques mais dont l’application aux objets du vivant n’est pas facile.
Les efforts en ce sens ont débuté dans les années 1970 où l’anglais Richard Henderson a cherché à perfectionner les meilleurs microscopes électroniques. En effet, si la microscopie électronique permet d’approcher la dimension des atomes dans les solides, le flux du faisceau d’électrons et le vide poussé dégradent et assèchent très vite les tissus biologiques. Les premiers perfectionnements ont consisté d’abord à obtenir des images sous vide partiel mais elles restaient imprécises. À partir des années 1980, Jacques Dubochet et son équipe eurent l’idée de « vitrifier » très rapidement les échantillons à la température de l’azote liquide (- 190°C), les images « figées » se sont alors améliorées. En 1991, l’américain Joachim Frank, grâce à un outil informatique de sa conception par analyse d’images, réussit à augmenter drastiquement la résolution de celles-ci. C’est ainsi qu’avec la méthode de « congélation » plus l’analyse informatique il obtint l’image tridimensionnelle du ribosome, une énorme molécule qui synthétise les protéines du vivant. Richard Henderson pour sa part avec ces méthodes fut le premier à présenter la structure atomique d’une grosse protéine commune à plusieurs bactéries.
Aujourd’hui la méthode de cryo-microscopie électronique a permis d’identifier la structure de nombreux virus. Elle est devenue indispensable pour trouver des cibles sur des protéines et molécules des bactéries et virus.
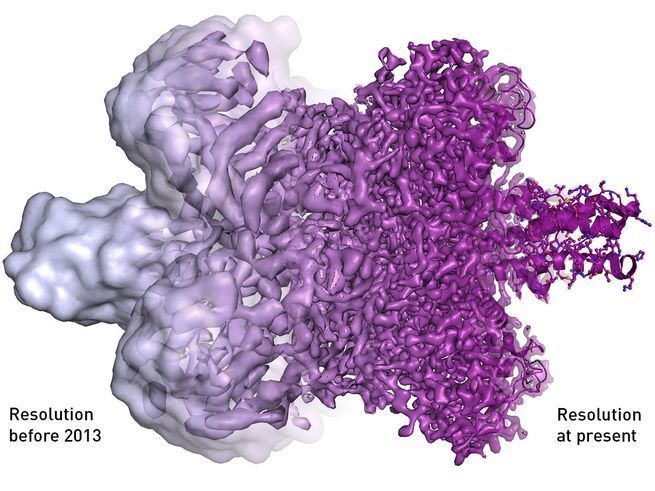
The resolution progression of cryo-EM. © Martin Högbom, Stockholm University
