En 1856, le jeune William Perkin âgé de 18 ans étudie la chimie au Royal College of Chemistry de Londres sous la direction d’August Wilhelm von Hofmann (1818-1892), chimiste organicien expert en goudron de houille. Von Hofmann, élève de Justus Liebig (1803-1873) à Giessen, avait été recruté en 1845 comme directeur d’une nouvelle école de chimie pratique à Londres sous l’égide du Royal College of Chemistry. Ses recherches sur le goudron de houille, puis sur le gaz de ville (ou naphta) l’avaient conduit à découvrir l’aniline.
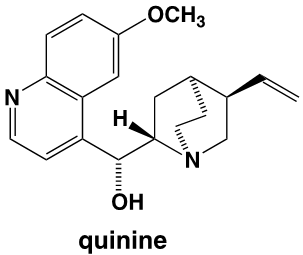
Dans ses mémoires, William Perkin explique que, en réponse à un concours lancé par Hofmann, il a effectué des recherches pendant les vacances de Pâques, dans son petit laboratoire personnel. Son projet était de réaliser la synthèse de la quinine dont la structure moléculaire n’était pas alors connue, avec pour objectif de « combattre le paludisme qui touchait les troupes qui défendaient aux Indes l’honneur britannique ». Perkin précise : « Après plusieurs essais j’en arrivais à oxyder un dérivé de l’aniline, la N-allyl-toluidine ». Car pour obtenir la quinine, il pensait qu’on pouvait y arriver par l’oxydation de deux molécules de N-allyl-toluidine. C’est ce qui pouvait être imaginé, sur la base des formules brutes, en comptant le nombre des atomes des molécules avant et après l’oxydation prévue. Les formules développées n’étaient pas alors connues, mais les formules brutes l’étaient. Pour le jeune Perkin, l’oxydation de la N-allyl-toluidine (C10H13N) était supposée former la quinine (C20H24N2O2) selon l’équation :
2 C10H13N + 3O -> C20H24N2O2 +H2O
Mais les structures développées du produit obtenu et de la quinine n’ont aucun rapport.
Cependant, lorsque Perkin a fait cette réaction avec du dichromate de potassium, il n’a obtenu qu’une boue brunâtre irrécupérable qu’il dut mettre à l’évier. C’est alors qu’il refait la réaction en oxydant par du bichromate de potassium de l’aniline contenant comme impuretés des α- et β-toluidines. Il décrit ainsi sa découverte : « J’obtins vite un splendide précipité rouge brun. Bien sûr, ce composé n’avait rien à voir avec la quinine artificielle que je recherchais, mais il éveilla ma curiosité de chimiste, car ayant renversé une petite éprouvette, je vis qu’il produisait sur le parquet et sur ma blouse des tâches certes de belle couleur, mais surtout indélébiles. Sans le savoir je venais d’inventer ce colorant de bonne tenue dont l’industrie textile avait tant besoin ».
De la pâte goudronneuse obtenue, il extrait par de l’éthanol une solution violette colorée par une substance qu’il nomme mauvéine.
De nos jours nous connaissons les formules développées de tous ces composés.
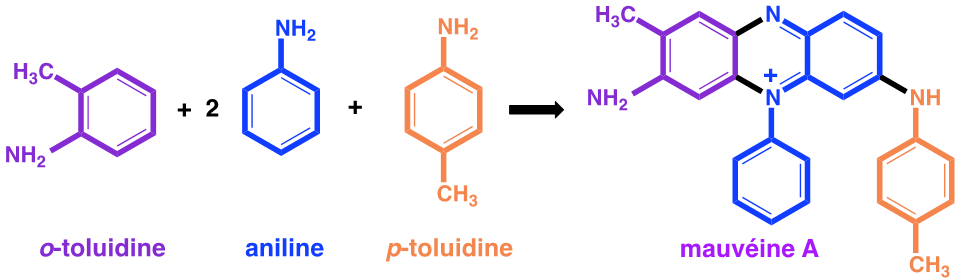
Figure 1 : Synthèse de la mauvéine A
On constate que la structure de la mauvéine ne ressemble pas du tout à celle de la quinine dont la formule est :
Les colorants naturels étaient très coûteux et difficiles à obtenir. C’est sur le conseil de sa femme qu’il donnera le nom de mauvéine à cette couleur en référence à la fleur « mauve (Malva sylvestris) ». Perkin dépose un brevet le 26 août 1856, démissionne de la Royal Society of Chemistry contre l’avis d’Hofmann et mobilise sa famille pour fonder avec son père et son frère une entreprise à Greenford dans la banlieue de Londres pour développer son invention. Elle a marqué la naissance de l’industrie chimique organique. Il lui faudra perfectionner sa fabrication, stabiliser la fixation du colorant sur les tissus et rendre le prix attractif. La concurrence des teinturiers étrangers dont les lyonnais qui apprennent en 1857 l’arrivée de ce nouveau produit sera rude, et surtout va susciter de nombreuses contrefaçons en Europe où le brevet anglais ne s’appliquait pas. Pour Perkin, qui a une longueur d’avance sur les autres chimistes, le succès sera éclatant. Par ailleurs, à partir des années 1860-1870, les chimistes allemands créeront une puissante industrie de matières colorantes, en particulier la Badische Anilin und Soda Fabrik (BASF).
Très rapidement la couleur mauve devient à la mode dans toute l’Europe et une véritable fureur va en effet s’en emparer. En 1862, la reine Victoria apparut à l’Exposition internationale de Londres dans une robe en soie teinte en mauve par le colorant de Perkin et porte cette couleur dans toutes les grandes occasions. À Paris l’impératrice Eugénie s’en entiche et porte aussi des robes mauves. Ce sera la couleur du timbre anglais de 2 pence en 1882.
Perkin se retire des affaires en 1874 à 36 ans. Il continue ensuite des recherches en chimie organique, découvre la « réaction de Perkin » qui lui permet de réaliser la synthèse de coumarines, à la base de l’industrie des parfums synthétiques. Il publie environ 60 articles, principalement dans le Journal of the Chemical Society, devenu « JCS Perkin ». Il meurt en 1907 d’une pneumonie à Arrow dans la banlieue de Londres. Cette découverte est un exemple type de sérendipité* en chimie.

L'usine de Greenford en 1858. Credit: Wellcome Collection. Licence CC BY 4.0
* La sérendipité est la science des découvertes imprévues. Les Trois Princes de Serendip est un conte oriental décrivant les nombreuses aventures de ces princes au cours desquelles ils utilisent de ténus indices pour remonter logiquement à des faits dont ils ne pouvaient avoir connaissance. (Sérendip est le nom en persan de Ceylan, aujourd’hui Sri Lanka). L’exemple type de cette démarche est Christophe Colomb qui cherche la route des Indes et trouve l'Amérique. C’est aussi ce que Pasteur nommera « le hasard dans un esprit préparé ».
Pour en savoir plus
- What did W. H. Perkin actually make when he oxidised aniline to obtain mauveine?, Otto Meth-Cohn and Mandy Smith, J. Chem. Soc. Perkin Trans. 1 (1994) 5-7
- La Royal Society of Chemistry commémore la découverte de la mauvéine, Dr Anne Prost (2008)
- William Henry Perkin (1838-1907) et la mauvéine, Camille Nerestan, Colorants et textiles de 1850 à nos jours, Carnet de recherche de l'Institut national d'histoire de l'art (INHA) 18 avril 2018
- Mauve Mania, Sophie Waring, site du Science Museum
- Reconstructing the historical synthesis of mauveine from Perkin and Caro: procedure and details, Tânia F. G. G. Cova, Alberto A. C. C. Pais & J. Sérgio Seixas de Melo, Scientific reports 7 (2017) 6806
Vidéo : Réalisation : François Demerliac ; Auteur scientifique : Bernard Bodo ; Production : Fondation de la Maison de la Chimie / Virtuel
Niveau de lecture : pour tous
Nature de la ressource : vidéo

