La Fondation de la maison de la Chimie s’est associée à la manifestation culturelle et scientifique organisée par la ville du Havre « Sur les épaules des géants » autour du thème de la lumière.
Nous vous proposons la lecture de ce petit dictionnaire Mediachimique qui suscitera sans aucun doute votre curiosité et vous donnera envie d’en savoir plus sur les liens de la chimie et la lumière.
L’absorption de lumière permet d’effectuer certaines transformations chimiques tandis que d’autres peuvent s’accompagner d’une émission de lumière. Nous allons voir, à travers les deux exemples proposés, que l’interaction entre la lumière et la matière permet la conversion d’énergie chimique en énergie de rayonnement et réciproquement.
Partie A : La chimiluminescence. Partie B : La photosynthèse, source d’inspiration pour les chimistes
Parties des programmes de physique-chimie associées
- Programme de physique-chimie de la seconde générale et technologique. Partie « Constitution et transformations de la matière »
- Programme de physique-chimie de la première générale. Parties « Constitution et transformations de la matière » et « ondes et signaux »
- Programme de la spécialité physique-chimie de terminale générale. Partie « Constitution et transformations de la matière »
- Programme de physique-chimie de première STI2D. Partie « Matière et matériaux » / Propriétés des matériaux et organisation de la matière
Pour lutter contre le changement climatique, diminuer la consommation d’énergie fossile est nécessaire. Cette diminution accroit les besoins en ressources minérales, de nombreux produits présents dans notre quotidien mettant en jeu des matières premières qualifiées stratégiques. La dépendance de l’Europe aux importations de ces matières premières a mis en évidence, dans un contexte géopolitique et économique incertain, sa vulnérabilité face aux enjeux des transitions écologique et numérique. Une sécurisation de l’approvisionnement en métaux considérés comme essentiels s’impose à l’Europe comme à la France. Comment la France peut-elle relever les défis stratégiques pour garantir un accès durable, sûr et écoresponsable à ces ressources ?
Parties des programmes de physique-chimie associées
- Programme de physique-chimie de seconde générale et technologique – Constitution de la matièrede l’échelle macroscopique à l’échelle microscopique, A) Description et caractérisation de la matière à l’échelle macroscopique
- Programme de sciences physiques et chimiques en laboratoire de première STL – Chimie et développement durable, Sécurité et environnement
- Programme de physique-chimie et mathématiques de première STI2D – Matière et matériaux, Propriétés des matériaux et organisation de la matière
- Programme d’innovation technologique et d’ingénierie et développement durable de première et d’ingénierie, innovation et développement durable de terminale STI2D – 1. Principes de conception des produits et développement durable, 1,5. Approche environnemental
- Programme d’enseignement scientifique de terminale générale – Thème 2 : Le futur des énergies
Le colloque « Chimie et sports en cette année olympique et paralympique » du 7 février 2024, a permis de faire le point sur quelques aspects liés à la performance sportive dépendant des facteurs physiques, psychologiques et techniques. Le monde de la recherche est pleinement mobilisé depuis des décennies pour améliorer les matériaux et équipements sportifs qu’il soit amateur ou professionnel. Lancé en 2018 par quinze grandes écoles et regroupant 60 chercheurs, le programme de recherche Sciences2024® s’est mis au service des équipes de France en vue des Jeux Olympiques et Paralympiques de Paris 2024. Mais tout ceci ne se limite pas aux matériels du sportif, car notre corps est une « véritable usine chimique mobile » dans laquelle les relations entre la performance sportive, la biologie et la santé sont étroites. Mais si la chimie de notre corps peut apporter le meilleur, certains excès peuvent apporter le pire et la traque aux molécules dopantes ou simplement nocives est un défi permanent...
Parties des programmes de physique-chimie associées :
- Programmes de physique-chimie et de mathématiques de première STI2D et terminale STI2D – Partie « Matière et matériaux »
- Programmes de Spécialité de physique-chimie pour la santé de première ST2S – Parties « Prévenir et sécuriser » et « Analyser et diagnostiquer »
- Programme de spécialité de biologie et physiopathologie humaines de première ST2S – Parties : « Appareil digestif et nutrition : Comment les aliments sont-ils transformés pour être assimilés par l’organisme ? En quoi l’alimentation est-elle un facteur de développement et de santé ? »
- Programme de la spécialité physique-chimie de terminale générale – Partie « Constitution et transformations de la matière », 4. Élaborer des stratégies en synthèse organique
Les abeilles sont indispensables par le service qu'elles rendent à la pollinisation : sans leur présence, nous perdrions 70 % des espèces cultivées en Europe. Mais leur disparition est bien évidemment préjudiciable à la production du miel. La France ne produit que le tiers de ses besoins en miel qui sont de 40.000 tonnes/an. Elle est donc obligée d'en importer. Or le miel est un produit onéreux : il est donc tentant pour les fournisseurs de proposer des produits de moindre coût de revient en les présentant comme des miels de qualité et d'origine conformes. C'est ce qu'on appelle l'adultération du produit. Il est important de contrôler la qualité des miels sur notre marché (1).
Le miel : un peu d'histoire
Son histoire (2) est très ancienne : le mot vient du latin mel, lui-même dérivé du grec μελί (meli). L'abeille est apparue sur Terre il y a environ 80 millions d'années, et le miel est le premier produit sucré découvert par l'espèce humaine. Les hommes préhistoriques le trouvaient dans les troncs d'arbres ou sous des rochers. Les civilisations les plus anciennes ont adopté le miel, lui attachant systématiquement une grande portée symbolique. Ainsi, les sumériens et les habitants de Babylone l’utilisaient au cours de leurs cérémonies religieuses, tout comme les Égyptiens qui s’en servaient pour l’embaumement des morts. L'abeille était alors considérée comme une véritable « messagère des dieux ». Dans certaines cultures, le miel était considéré comme l’aliment des aliments. Dans l'Odyssée, dès qu'Ulysse est accueilli quelque part, on lui apporte du miel, des olives et du fromage. Beaucoup voyaient en lui un véritable élixir de longue vie, et de nombreuses propriétés médicinales lui ont été prêtées au fil des âges. Il était également utilisé pour la conservation des aliments. Par exemple, au Ve siècle, l’historien Hérodote rapporte que les Grecs chassaient les faisans dans ce que l’on nomme aujourd’hui la Géorgie, et les immergeaient dans des amphores de miel pour le voyage de retour. On utilise aussi de la cire, par exemple pour imperméabiliser les récipients.
Ce n’est qu’à la fin du XVIIIe siècle qu’apparaît la ruche à cadres amovibles, qui permet à l’apiculteur de ne prélever qu’une partie des réserves sans anéantir la colonie d’abeilles. C’est une révolution. Au fil du temps, l’être humain a appris à sélectionner les miels en fonction des dates de floraison, pour obtenir des parfums très variés. Ainsi, on peut aujourd’hui répertorier plusieurs dizaines de miels de qualités organoleptiques différentes (trèfle, lavande, thym, sapin, montagne...).
Comment les abeilles fabriquent-elles le miel ?
Le miel (3)(4) est une substance sucrée élaborée par les abeilles à miel à partir du nectar (i). L'élaboration du miel commence dans le jabot de l'ouvrière, pendant son vol de retour vers la ruche. L'enzyme invertase (ii) présente dans le jabot, catalyse l'hydrolyse du saccharose qui donne du glucose et du fructose (fig. 1). Arrivée dans la ruche, la butineuse régurgite le nectar à une receveuse, qui le régurgitera et le ré-ingurgitera en le mêlant à de la salive et des sucs digestifs. Il est alors stocké dans les alvéoles et déshydraté par la ventilation assurée par certaines abeilles. Il arrive à maturité lorsque la concentration en eau est inférieure à 18 %, et sa durée de conservation est alors extrêmement longue. Pour produire 500 g de miel, les abeilles doivent effectuer plus de 17 300 voyages, visiter 8,7 millions de fleurs, rapporter 2 kg de nectar, le tout représentant plus de 7 200 heures de travail. Elles l'entreposent dans la ruche et s'en nourrissent tout au long de l'année, en particulier lors de périodes climatiques défavorables.
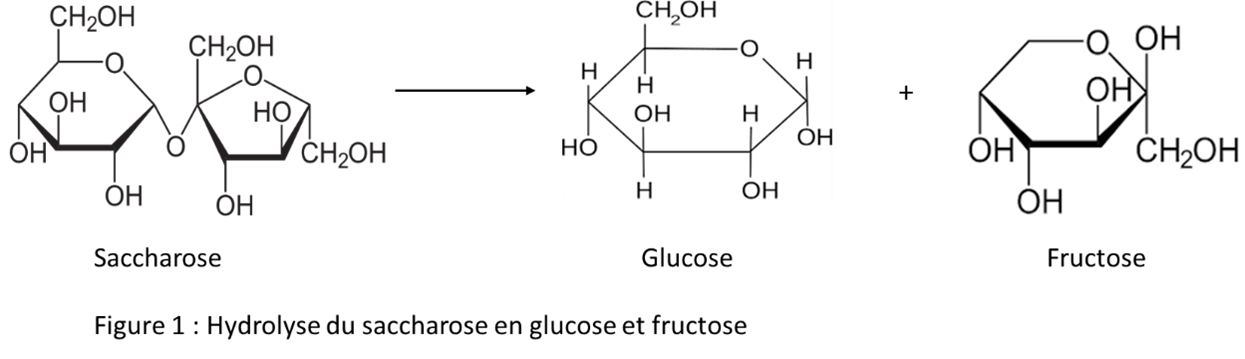
Quelle est la composition du miel ?
Le Codex alimentaire (5) donne les compositions maximales ou minimales en différents composés chimiques qui elles-mêmes dépendent de l’origine florale et géographique du miel. Ainsi par exemple pour un miel de nectar (iii), non pressé, et de composition florale « classique » (pas de lavande, ni de bruyère, ni de luzerne ou d’eucalyptus) le pourcentage d’eau ne doit pas dépasser 20 % ; tandis que la teneur de fructose et de glucose réunis doit être supérieure à 60 % et que celle en saccharose doit être inférieure à 5 % ; la teneur en matières insolubles dans l’eau doit être inférieure à 0,1 %.
Mais d’autres glucides (iv) se retrouvent dans le miel (on a en très souvent une teneur proche de 80 %) et leur présence ainsi que leur concentration permettent de déterminer l’origine florale ou géographique du miel.
Le miel contient aussi des protéines, des enzymes et des minéraux.
Les pollens permettent aussi de déterminer l’origine (6)(7).
Le miel ne contient pas de lipides et les quantités de résidus de pesticides, d’antibiotiques doivent être inférieures à des doses définies par la Commission européenne (8).
| Composés | Quantité (g/100 g) |
| eau | < 20 |
| Sucres Fructose + glucose saccharose | 79,8 > 60 < 5 |
| Matières insolubles | < 0,1 |
Quels sont les producteurs mondiaux du miel ?
Dans le monde, le premier producteur est la Chine, suivie de la Turquie, de l'Argentine, de l'Iran.
Le principal producteur de miel de l'UE est la Roumanie, suivie de l'Espagne, la Hongrie, l'Allemagne, l'Italie, la Grèce, la France et la Pologne. On trouve en France des miels AOP (Appellation d'origine protégée : Corse, sapin des Vosges) et IGP (Indication géographique protégée : Alsace, Provence).
Les fraudes suspectées sur le miel
Environ 46 % des miels importés dans l'Union européenne, principalement en provenance de Chine et de Turquie, seraient frauduleux, en particulier dilués pour en diminuer le prix et en augmenter la quantité et beaucoup contiendraient des produits toxiques (pesticides, en particulier néonicotinoïdes, chloramphénicol, métaux lourds).
D'autre part, les produits importés, en particulier de Chine et de Turquie, sont réexportés comme produits locaux, si bien qu'un tiers des miels dans l'Union européenne ne seraient pas conformes à la provenance indiquée.
En résumé les fraudes peuvent présenter plusieurs formes :
- la présence d'impuretés (des résidus de pesticides par exemple) ;
- l'existence d'une dilution avec des sirops de sucre ;
- l'ajout d'additifs non déclarés (du sucre brut, du sucre raffiné, du sirop de maïs à forte teneur en fructose (HFCS) (v), du sucre de palme ;
- avoir une fausse origine botanique (miel « de lavande » par addition d'essence de lavande à un miel ordinaire) ;
- avoir une fausse origine géographique et contenir des miels bon marché (de Chine et autres) ;
- un étiquetage insuffisant. En effet, l'étiquetage (vi) est important et est rarement respecté.
Quelles méthodes employer pour contrôler les miels ? (9)
Il faut donc vérifier si ces miels sont :
- conformes à la réglementation
- respectueux de l'environnement
- authentiques
- sans danger
Il y a longtemps que le contrôle de la qualité et l'authenticité des aliments est pratiquée. L’identification et le dosage des éléments présents se font principalement par des méthodes chromatographiques.
Recherche de résidus (10)
Ainsi par exemple la chromatographie liquide couplée en tandem à la spectrométrie de masse (LC-MS/MS) et la chromatographie gaz couplé à un temps de vol pour l’analyse en spectrométrie de masse (GC-ToF) permet de déterminer une grande quantité de résidus de pesticides (insecticides, acaricide…) ou d’antibiotiques. Ainsi on peut détecter des résidus de coumaphos, utilisé auparavant (mais maintenant interdit en France) pour lutter contre le Varroa, parasite bien connu des apiculteurs. En France, c’est le Service Commun des Laboratoires et plus particulièrement celui de Marseille qui recherche ce type de composés dans le miel.
La fraude à la dilution par ajout de sirop de sucre (11)
Suivant le type de plante, le rapport isotopique 13C/12C diffère. Ainsi le miel provenant de plantes florales aura un δ13C réf de l’ordre de -28 ‰ alors que celui du sirop de maïs ou de canne à sucre est de l’ordre de -14 ‰. Ainsi une analyse élémentaire par spectroscopie de masse de rapport isotopique (EA-IRMS) peut indiquer une addition d’un sirop de sucre au miel. Pour affiner la mesure on détermine aussi la différence des rapports isotopiques des glucides (majoritaires dans le miel) et des protéines qui seront d’autant plus différents que la quantité de sirop ajouté sera grande.
La fraude à l’origine botanique ou géographique
Cela consiste à vendre un miel soi-disant issu de telle fleur et de tel lieu, mais qui est en réalité mélangé à un miel (moins cher) d’une autre provenance. Pour la mise en évidence de ce type de fraude, on utilise des spectres de résonance magnétique du proton (RMN 1H) (12), ou proche infrarouge (NIR), ou des chromatogrammes par détection UV-Visible après une chromatographie liquide haute performance ((HPLC-UV) (13). On utilise alors des méthodes non ciblées qui analysent l'ensemble du produit sans a priori, et qui permettent de détecter des fraudes non connues. On compare les résultats à des bases de données produites à partir d'échantillons connus et traçables. Le traitement de toutes ces données est facilité par l'apport de l'Intelligence Artificielle. Les méthodes utilisées sont des méthodes non supervisées telles que l’analyse en composante principale (PCA) ou les analyses discriminantes par les moindres carrés partiels (PLS-DA) (vii) (13). On pourra ainsi détecter l'ajout de substances de charge (sirop de sucre), d'altérations (ajout d'autres miels), et même le contrôle de l'origine géographique.
Enfin pour déterminer la provenance d’un miel, on peut aussi étudier les pollens contenus dans le miel et comparer ces pollens à la composition florale du miel. Ceci est ce qu’on appelle la mélissopalynologie (viii) (7).
L’identification des sucres présents
D’autres méthodes ciblées complètent le tableau ; ainsi la chromatographie à échange d’anions à détection ampérométrique (HPAEC-PAD) (6) ou des mesures enzymatiques ou des mesures de photométrie permettent de déterminer les quantités de chacun des sucres présents (glucose, fructose, maltose, HMF (ix) …).
Les laboratoires
Il existe des laboratoires spécialisés dans ces contrôles, comme le Centre de Compétence Authenticité Eurofins de Nantes (14)(15). Sur dix produits susceptibles d'adultération, le miel est en bonne place, avec l'huile d'olive, le vin, les épices, les cafés et thés. Historiquement, c'est en 1981 qu'a été inventée à Nantes la méthode SNIF-NMR® (Site-specific Natural Isotopic Fractionation studied by deuterium Nuclear Magnetic Resonance) pour le vin et l'alcool. Le laboratoire Eurofins a été créé en 1987, FINS étant l'acronyme français de SNIF.
L’ANSES (Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail) a un dossier complet sur les abeilles (16).
C’est la combinaison de l’ensemble des analyses qui permet de déterminer la qualité d’un miel.
À propos de la disparition des abeilles
Depuis quelque temps, vous n'ouvrez plus votre poste de radio sans entendre parler du frelon asiatique : il serait de plus en plus envahissant et, par suite de son agressivité, très dangereux pour les abeilles.
Certains pesticides aussi sont responsables de la disparition des abeilles. Le cas des néonicotinoïdes est particulièrement préoccupant, car ils peuvent induire chez l'abeille des troubles de l'apprentissage et de la mémoire qui dégradent ou détruisent sa capacité à retrouver des aliments ou sa ruche, au point de parfois menacer la santé de la ruche entière. Ils sont suspectés de jouer un rôle clé dans l'effondrement mondial des populations de pollinisateurs domestiques et sauvages (17).
Et leur disparition est bien évidemment préjudiciable à la production du miel.

Photographie Bernd Amann (20/06/2015)
(i) Le nectar (du latin nectarium, breuvage des dieux !) est un suc secrété généralement par les nectaires, au cœur des plantes. Il constitue la matière première du miel. Les plantes produisant du nectar en abondance sont dites nectarifères et les plantes présentant un intérêt pour la production de miel sont dites mellifères.
(ii) L'enzyme inverse le pouvoir rotatoire [α] D20, qui passe de +66,5° pour le saccharose à -39,3° pour le mélange glucose (+52,7°) + fructose (-92°).
(iii) Il existe des miels de nectar mais aussi de miellat (miel de sapin, par exemple : le miellat est fabriqué par les pucerons sur les sapins).
(iv) Les glucides (ou saccharides) sont composés de monosaccharides (glucose, fructose, galactose…) de disaccharides (maltose, saccharose…), trisaccharides (mélézitose, raffinose…), polysaccharides.
(v) HFCS = High Fructose Corn Sirup
(vi) Détail des réglementations sur l’étiquetage : • Origine, provenance • Dénomination de vente complète • Origine florale • Origine territoriale • Critères spécifiques de qualité [Mode de production, AOP, IGP; et d’autres termes (crémeux, de printemps…)] • Quantité nette• Date de Durabilité Minimale et/ou N° de lot • Nom ou raison sociale et adresse de l’exploitant.
(vii) PCA : analyse en composante principale et PLS : Partial Least Squares ; ces méthodes consistent à réduire les dimensions des données ; par exemple à partir d’un spectre d’1 miel, on obtient un couple de point (X,Y). On trace ensuite pour l’ensemble des N miels donnés, les N points (X,Y) et on cherche si des clusters se forment et s’ils correspondent à une propriété donnée (par exemple miel de sapin ou miel de Corse…).
(viii) du grec mel, miel et palunein, répandre de la farine (ici le pollen ou les spores).
(ix) HMF : Hydroxy-Méthyl-Furfural produit de la déshydratation du fructose
Références : merci à J-P Dal Pont pour de précieux numéros des annales de la Société des Experts Chimiques de France
(1) Marcincal A., Royer M., (2022) Le miel, un produit naturel. L'abeille, un enjeu stratégique ?, Annal. Fals. Exp. Chim. Tech. N°996, p74.
(2) L’histoire du miel (site Les rochers du Tigou) https://www.tigoo-miel.com/le-miel-et-son-histoire/
(3) Miel sur Wikipedia
(4) Boutonnier, J.-L., (2023) Miels, Techniques de l'ingénieur (Janvier 2023)
(5) Norme pour le miel (PDF) – source OMS 2022, NORME POUR LE MIEL CXS 12-1981 dernière modification 2022
(6) Michel, Killian, Détection des fraudes en sucres dans les miels : appui au développement d'une méthode se basant sur la technique HPAEC-PAD. Ecole polytechnique de Louvain, Université catholique de Louvain, 2023. Pages 19 et 20 Prom. : Luis Alconero, Patricia ; Massaux, Carine. https://hdl.handle.net/2078.1/thesis:42099
(7) Lobreau-Callen D., Clement M-D., Marmion V., Les miels, Techniques de l'ingénieur Juin 2000
(8) Journal Officiel UE Limites maximales de résidus de pesticides 2017 (PDF)
(9) Guyon F., Landuré M., Gaudefroy M., Angioni C., Fino L., Le contrôle et le développement de nouveaux outils des contrôles des miels : un enjeu stratégique salutaire pour la filière française ! SECF webinaire MIEL Episode 1, 4 avril 2022
(10) Wiest, L., & Vulliet, E., Analyse multi-résidus de pesticides dans le miel : enjeux et défis analytiques. In Annales des falsifications, de l'expertise chimique et toxicologique, Vol. 985 (2016) pp. 17-27
(11) Official Methods of Analysis (OMA) par International Association of Official Agricultural Chemists, AOAC 9941-41 et AOAC 978-17
(12) Rhee Y., Shilliday E.R., Matviychuk Y., Nguyen T., Robinson N., Holland D.J., Connolly P.R.J. and Johns M.L., Detection of honey adulteration using benchtop 1H NMR spectroscopy, Anal. Methods 15 (2023) 1690 https://doi.org/10.1039/D2AY01757A
(13) Egido C., Saurina J., Sentellas S., Núnez O., Honey fraud detection based on sugar syrup adulterations by HPLC-UV fingerprinting and chemometrics, Food Chemistry 436 (2024) 137758 https://doi.org/10.1016/j.foodchem.2023.137758
(14) Thomas F., (2022) Analyse non ciblée en authenticité : l'IA pour la gestion des bases de données et l'interprétation dans le contrôle alimentaire, Annal. Fals. Exp. Chim. Tech. N°996, p.48
(15) Thomas F., (2022) Comment lutter contre la fraude économique et préserver l'authenticité des miels ? SECF webinaire MIEL Episode 1, 4 avril 2022 https://www.la-sca.net/actualites-apicoles-142/sorties-conferences-expositions/conference-le-miel-un-produit-naturel-l-abeille-un-enjeu-strategique
(16) Les abeilles, des pollinisateurs essentiels dont la santé est menacée - ANSES anses.sante-des-abeilles
(17) Mitchell E.A.D, Mulhauser B., Mulot M., Mutabazi A., Glauser G. & Aebi A., A worldwide survey of neonicotinoids in honey, Science, Vol. 358 (2017) issue 6359, pp. 109-111 https://doi.org/10.1126/science.aan3684
Crédit illustration : Bernd Amann (20/06/2015).
La dynastie des Becquerel et leur intérêt pour la phosphorescence
Antoine César Becquerel (1788-1878), fondateur de la dynastie des Becquerel au Muséum, a été nommé professeur titulaire de la chaire de Physique appliquée aux sciences naturelles, à sa création en 1838 à l’initiative de Joseph Gay-Lussac. Au cours d’un voyage à Venise, Antoine César avait observé que la nuit, la mer devenait phosphorescente et il a commencé à s’intéresser à ce phénomène.
Son fils Edmond Becquerel (1820-1891) a succédé à son père comme professeur en 1878. On lui doit la découverte de l’effet photovoltaïque (1839) et la réalisation de la première photographie en couleur représentant le spectre solaire sur plaque argentée (1848). Mais ses recherches ont principalement porté sur les différentes formes de luminescence (*), fluorescence et particulièrement la phosphorescence des sels d’uranium. Pour mesurer la durée de phosphorescence, il a inventé le phosphoroscope (1857), appareil permettant de mesurer le temps qu'il faut à un matériau phosphorescent pour cesser de briller après avoir été excité par de la lumière.
Enfin, Henri Becquerel (1852-1908), fils d’Edmond qui lui a succédé comme professeur en 1892, a porté un intérêt scientifique, entre autres sujets, à la phosphorescence de sels d’uranium. Tous ont été polytechniciens, sauf Edmond reçu à cette Ecole, mais qui a préféré travailler dans le laboratoire de son père. Tous ont été membres de l’Académie des sciences.
La découverte des rayons X par Röntgen et sa présentation par Henri Poincaré à l’Académie
En novembre 1895 Wilhelm Conrad Röntgen, professeur à l’université de Würzburg, découvrit les rayons X alors qu’il faisait fonctionner un tube de Crookes dans l'obscurité. Ayant placé ce tube dans l’obscurité, il observa une fluorescence sur un écran en papier recouvert de platinocyanure de baryum. Il a noté que cette fluorescence accompagne la production des rayons X et que si les rayons X ne sont pas visibles par l’œil, ils impressionnent les plaques photographiques, même protégées par du papier noir.
Peu de temps après, le 20 janvier 1896, Henri Poincaré présenta devant ses collègues de l’Académie des sciences, la découverte de Röntgen et attira l’attention d’Henri Becquerel dont il connaissait l’intérêt pour la phosphorescence des sels d’uranium, lui suggérant de voir si elle ne s’accompagnait pas de l’émission de rayons X.
La découverte des rayons uraniques d’Henri Becquerel
Après plusieurs expériences négatives avec différents corps phosphorescents, Becquerel a utilisé des cristaux de sulfate double d’uranyle et de potassium « qu’il avait préparé une quinzaine d’années avant ». Il les déposa sur une plaque photographique « Lumière » soigneusement enveloppée dans du papier noir pour la protéger de la lumière, puis exposa le dispositif plusieurs heures au soleil.
Ensuite, il développa la plaque et observa qu’elle est impressionnée, malgré sa protection par le papier noir. Il en déduisit que les sels d’uranium émettaient des rayons X après excitation par la lumière du soleil et présenta ce résultat à l’Académie dans une note le 24 février 1896 (1).
Puis, il voulut recommencer l’expérience, mais, pendant plusieurs jours, le soleil ne se montra pas. Dans l’attente de son retour, il rangea le dispositif expérimental dans un tiroir à l’obscurité. Quand le 28 février le soleil revint, il reprit son expérience et prépara un nouveau dispositif. Mais il ne jeta pas le dispositif préparé auparavant, pensant que faute de soleil et donc de phosphorescence, la plaque ne serait pratiquement pas impressionnée. Il la développa normalement, et à sa grande surprise l’impression de la plaque restée dans le noir fut beaucoup plus intense que celle de la première expérience. Il en conclut que le sel d’uranium émettait donc spontanément des rayons pénétrants, qu’il ait été ou non exposé à la lumière du soleil et nomma ce rayonnement « rayons uraniques ». Il présenta ce nouveau résultat à l’Académie le 1er mars 1896 (2). C’était là, la découverte capitale d’Henri Becquerel, celle des « rayons uraniques », fruit du hasard dans un esprit préparé d’un expérimentateur rigoureux.
Pierre Curie et son frère Jacques (**), un autre élève de l’Ecole de Chimie d’Edmond Frémy au Muséum, réalisèrent un appareil (quartz-piézzo électrique) qui permettra de faire des recherches quantitatives sur les substances radioactives, les travaux de Becquerel étant purement qualitatifs. Cette possibilité a permis à Marie Curie de découvrir en 1898 dans la pechblende des substances plus radioactives que l’uranium : le polonium et le radium (3) (4). Le nom de « radioactivité » a été donné au phénomène par Marie Curie.
Pour leurs travaux sur la découverte de la radioactivité, le prix Nobel de physique de 1903 a été décerné à Henri Becquerel, Pierre Curie et Marie Curie.

Pierre et Marie Curie dans leur laboratoire parisien, avant 1907
Notes
* Les phénomènes de luminescence, fluorescence ou phosphorescence, apparaissent lorsqu’un corps absorbe la lumière visible ou ultraviolette, puis la réémet à une longueur d’onde plus grande (décalée vers la partie rouge du spectre). Les deux phénomènes de phosphorescence et fluorescence sont quasiment identiques. La différence est que le matériau phosphorescent continue d'émettre de la lumière dans le noir même si on arrête de l'éclairer. Après exposition à la lumière un matériau phosphorescent diffuse la lumière dans le noir alors qu’un matériau fluorescent n'émet pas de lumière dans l'obscurité, mais produit une couleur vive si on l'éclaire.
** Pierre Curie et Jacques, âgés de 21 et 25 ans, découvrent en 1880, la piézoélectricité. L’effet piézoélectrique est une propriété de certains cristaux, comme le quartz, d’émettre de petites quantités d’électricité lorsqu’ils sont comprimés ou étirés. En 1885, ils font construire un instrument pour leur laboratoire, qu’ils appellent tout simplement “quartz piézoélectrique”. Cet instrument, permet de faire des mesures quantitatives de la radioactivité d’échantillons. Cet instrument est introduit par Marie et Pierre Curie dès 1898 dans leur méthode de mesure de la radioactivité, appelée aujourd’hui « méthode Curie ». Lors de cette mesure, les deux scientifiques compensent la charge électrique inconnue produite par l’échantillon radioactif, avec la charge électrique connue générée par le quartz. La méthode de compensation leur permet de mesurer, en utilisant un électromètre à quadrant, des courants très faibles, de l’ordre de 10-13 ampères. Ces mesures, très précises, leur permettent de détecter dès 1898, dans les minerais d’uranium, la présence de quantités infimes de deux nouveaux éléments chimiques radioactifs : le polonium et le radium. « Pour mesurer les courants très faibles que l’on peut faire passer dans l’air ionisé par les rayons de l’uranium, j’avais à ma disposition une méthode excellente étudiée et appliquée par Pierre et Jacques Curie. » Marie Curie, Pierre Curie, 1923.
Bibliographie
1 - Henri Becquerel. Sur les radiations émises par phosphorescence. C.R. Acad. Sci. 122 (1896) p. 420-421.
2 - Henri Becquerel. Sur les radiations invisibles émises par les corps phosphorescents. C.R. Acad. Sci. 122 (1896) p. 501-503.
3 - Pierre Curie et Marie Curie, Sur une substance nouvelle radio-active (polonium), contenue dans la pechblende. C.R. Acad. Sci. 127 (1898) p.175-178.
4 - Pierre Curie, Marie Curie et Gustave Bémont, Sur une nouvelle substance fortement radio-active (radium), contenue dans la pechblende. C.R. Acad. Sci. 127 (1898) p. 1215-1217.
Illustration : Pierre et Marie Curie dans leur laboratoire parisien, avant 1907. Source : Wikimedia commons
La découverte de la radioactivité par Henri Becquerel, Pierre et Marie Curie remonte à plus d’un siècle (1896-1898) et a conduit à leur décerner le prix Nobel de physique en 1903. Toutefois, des énigmes marquent le début de cette découverte.
Quand des élèves de Frémy discutent entre eux
Gabriel Bertrand dans un article publié en 1946 aux Comptes Rendus de l’Académie des Sciences, rapporte une histoire intrigante « Sur l’origine de la découverte de la Radioactivité » lorsqu’il travaillait encore au Muséum (1).
Mais qui était Gabriel Bertrand (1867-1962) ? Après avoir suivi les cours de l’École de chimie d’Edmond Frémy au Muséum, il s'inscrit à l'École supérieure de pharmacie et devient pharmacien en 1894. Il reste au Muséum, d'abord comme préparateur de Léon Maquenne (1889), au laboratoire de Physiologie végétale appliquée à l’agriculture de P.P. Dehérain, et ensuite, à 23 ans il est nommé préparateur à la chaire de Chimie appliquée aux corps organiques dirigée par le professeur Albert Arnaud successeur de Chevreul au Muséum. Puis en 1897, Émile Duclaux, qui avait succédé à Pasteur à la direction de l'Institut Pasteur, l'appelle au poste de chef de service. Gabriel Bertrand soutient sa thèse de doctorat en 1904, sur la biochimie de la bactérie du sorbose, ce qui lui vaut d'être nommé chargé de cours à la Sorbonne en 1905. Titulaire de la chaire de chimie biologique de cette l'université, il restera simultanément chef de service à l'Institut Pasteur.
Dans cet article de 1946 mentionné en préambule, Gabriel Bertrand rapporte un échange qu’il a eu avec Henri Becquerel en 1893 (1) (2). Rappelons que ce dernier a découvert et publié les propriétés des rayons uraniques trois ans plus tard, au début de 1896. Bertrand écrit : « Notre illustre Confrère vint un jour me voir au laboratoire que j’occupais dans la rotonde de l’amphithéâtre du Muséum, à quelques pas de la maison qu’il habitait et du laboratoire où il travaillait (maison de Cuvier). Il me présenta un petit bloc noir que je reconnus immédiatement à son aspect et à sa densité pour de la pechblende. Il avait enfermé dans un tiroir une plaque photographique, enveloppée dans du papier à aiguilles, après avoir posé dessus le morceau de pechblende. Lorsque, après quelques jours, il se servit de la plaque, une grande tache apparut au développement, tache qu’il reconnut de la grandeur et de la forme du morceau de pechblende. Pouvez-vous, ajouta-t-il en terminant, me donner comme chimiste une explication de ce phénomène ?
J’avais eu l’occasion d’étudier la pechblende quelques années avant dans le laboratoire de Frémy et d’en faire une analyse aussi complète que possible. Je répondis à Henri Becquerel que ce minerai était ordinairement très complexe, pouvait contenir des sulfures, que sous l’influence de l’air humide son échantillon avait peut-être dégagé des traces d’hydrogène sulfuré, imperceptibles à l’odorat, mais auquel la couche de gélatino-bromure d’agent était très sensible. Etant donnée la compacité de la pechblende, je ne tenais pas cette explication pour très probable, mais elle n’était pas impossible.
Quelques jours plus tard, H. Becquerel revint me voir et m’informa que mon explication n’était pas exacte mais, ajouta-t-il, j’en ai trouvé une. Je n’eus pas l’indiscrétion de lui demander en quoi elle consistait…. C’est la première observation qui fut faite par Becquerel de la radioactivité (rayons uraniques). L’impression fortuite d’une tache provoquée par la pechblende sur une plaque photographique. A quelle date se situe cette observation mémorable ? Elle est très notablement et même curieusement antérieure aux publications de 1896. Alors Becquerel n’était plus mon voisin. La chaire de chimie avait quitté le grand amphithéâtre et s’était installée au 63 rue Buffon (dans les locaux de l’école de Frémy, puis fermée en 1894). Ce devait être avant la fin de 1893. Mais on ne saura avec certitude ce qui s’est passé dans le laboratoire de physique du Muséum, entre 1893 et 1896 ».
Niépce de Saint-Victor : de la photographie aux rayons invisibles émis par les sels d’uranium ou une énigme peut en cacher une autre
De quelles informations H. Becquerel avait-il connaissance en 1893 ? Connaissait-il les travaux de Niépce de Saint-Victor, cousin de Nicéphore Niépce l’inventeur de la photographie. Ses expériences dans les années 1857-1867 utilisaient la photographie et recherchaient si la lumière pouvait se stocker dans des corps, autrement que par la phosphorescence ou la fluorescence (*). Niépce de Saint-Victor avait observé, par ce qu’il nommait une « photographie de l’invisible », qu’il ne s’agissait pas d’une phosphorescence, mais d’un rayonnement invisible ne traversant pas le verre. Niépce exposait à la lumière solaire une feuille de carton imprégnée d’une solution de sel d’urane formant un dessin, après insolation il l’appliquait sur une feuille de papier sensible et disposait le tout dans un tube métallique bouché, à l’obscurité. Le dessin se reproduisait en impressionnant le papier sensible. Bref, il avait observé un rayonnement particulier de l’uranium et ses observations avaient été transmises à l’Académie des Sciences par Eugène Chevreul.
En 1861, Niépce avait remarqué que le carton conservé à l’obscurité est encore actif six mois après son insolation. Une substance très efficace pour ces expériences était une solution aqueuse d’acétate d’uranium dont il imprégnait la feuille de papier. Cette activité à distance n’était donc pas due à la phosphorescence. Les travaux décrits dans les mémoires de Niépce de Saint-Victor sur la lumière, ses causes et ses effets étaient connus d’Edmond Becquerel. Il avait également remarqué que ce ne pouvait être dû à un phénomène de phosphorescence, dont la durée n’est pas aussi longue.
Niépce de Saint-Victor avait-il découvert l’activité des rayons uraniques avant Henri Becquerel ? Ce n’est pas clair, mais les Becquerel connaissaient très vraisemblablement les travaux de Niépce. Paul et Josette Fournier (3) ont bien mis en évidence la complexité des filiations pour aboutir à la découverte de la radioactivité, en particulier dans les recherches sur la photographie et la luminescence* qui préoccupaient physiciens et chimistes dans la deuxième moitié du XIXe siècle.

Photographie de Henri Becquerel par Paul Nadar
Note
* Les phénomènes de luminescence, fluorescence ou phosphorescence, apparaissent lorsqu’un corps absorbe la lumière visible ou ultraviolette, puis la réémet à une longueur d’onde plus grande (décalée vers la partie rouge du spectre). Les deux phénomènes de phosphorescence et fluorescence sont quasiment identiques. La différence est que le matériau phosphorescent continue d'émettre de la lumière dans le noir même si on arrête de l'éclairer. Après exposition à la lumière un matériau phosphorescent diffuse la lumière dans le noir alors qu’un matériau fluorescent n'émet pas de lumière dans l'obscurité, mais produit une couleur vive si on l'éclaire.
Bibliographie
1 - Gabriel Bertrand. Sur l’origine de la découverte de la Radioactivité. C.R. Acad. Sci., 223 (1946) p. 698-700.
2 - Michel Genet. La découverte des rayons uraniques : un petit pas pour Henri Becquerel, mais un grand pas pour la science. L’Actualité chimique, n° 220 (1998) p. 34-41.
3 - Paul Fournier et Josette Fournier. Hasard ou mémoire dans la découverte de la radioactivité. Rev. Hist. Sci., 52 (1999) p. 51-79. - Paul Fournier et Josette Fournier. Découverte de la radioactivité. Mediachimie.org. Petites histoires de la chimie.
Illustration : Photographie de Henri Becquerel par Paul Nadar / Adam Cuerden, Wikimedia Commons. Source de l'image : gallica.bnf.fr / BnF
Modes opératoires, liste produits et matériels ; conseils et notions à développer, explications.
Les modes opératoires proposés permettent de mettre en évidence l’interaction lumière matière et tout particulièrement l’excitation de molécules par l’absorption du rayonnement UV puis l’émission de lumière colorée par ces mêmes molécules lors de la désactivation.
Objets de ces 3 expériences
- Expérience 1 - Émission de lumière colorée par une molécule fluorescente soumise aux UV
La luminescence est un phénomène d’émission de lumière, ici visible donc colorée, par réarrangement électronique dans une molécule, par suite d’excitation de celle-ci par les UV. Quand ce phénomène n’a lieu que durant l’exposition à une source énergétique et cesse avec l’arrêt de l’exposition, le phénomène est appelé fluorescence (étudié ici). Si le phénomène perdure après l’arrêt à l’exposition aux UV il s’agit de phosphorescence (ce 2ème phénomène n’est pas étudié dans ces 3 expériences). - Expérience 2 - Chimiluminescence : émission de lumière provoquée par une réaction chimique réalisée avec le luminol
La chimiluminescence consiste en une émission de lumière visible provoquée par une réaction chimique. - Expérience 3 - Expérience combinée de chimiluminescence et de fluorescence réalisée avec du luminol et de la fluorescéine
Il est possible de combiner le phénomène de chimiluminescence et de fluorescence. Il y a alors émission de lumière visible par une molécule fluorescente préalablement excitée par l’énergie libérée par une réaction chimique.
Acquis préalables et notions générales à faire comprendre au cours des expériences
Rappeler que la lumière blanche est composée de lumières colorées et présenter un spectre obtenu par décomposition de la lumière blanche.
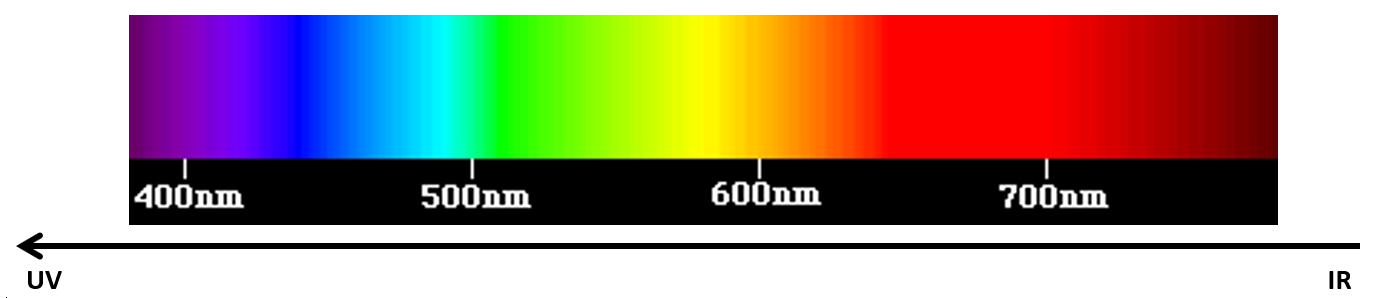
Spectre de la lumière visible
Rappeler que la lumière blanche est la superposition intégrale de toutes ces lumières (synthèse additive).
Observer que lorsqu’on va du rouge vers le bleu on va vers des rayonnements de plus en plus énergétiques.
Les UV sont des rayonnements de forte énergie (juste à gauche du violet sur le graphe) mais invisibles à nos yeux (ils nous paraissent incolores).
Faire comprendre la notion de niveau d’énergie et d’excitation des molécules puis de retour à un état plus stable.
Accompagner éventuellement le discours d’une représentation graphique des niveaux d'énergie.
Faire comprendre que s’il y a émission de lumière colorée par une molécule cela diffère de la couleur des objets qui nous entourent, qui elle résulte de l’absorption d’une partie de la lumière blanche provenant du soleil (absorption sélective ou synthèse soustractive).
Faire observer que le phénomène de fluorescence n'est observable que durant l'exposition à une source d’énergie (UV ou libération d’énergie provoquée par une réaction chimique) et que cela cesse dès qu'on arrête l'excitation.
Expérience 1 - Émission de lumière colorée par une molécule fluorescente soumise aux UV
Matériel
- 2 récipients au choix (éprouvette, bécher de 150 ou 200 mL, fiole jaugée ….) le plus photogénique !
- 1 lampe UV 365 nm
Produits
- Fluorescéine : en faire une solution bien jaune
- Schweppes® tonic (seul le tonic contient de la quinine)
- Papier blanc
- Surligneurs « fluos » de diverses couleurs
Mode opératoire
- Introduire dans le récipient choisi la solution de fluorescéine. Observer la couleur jaune à la lumière du jour (cette couleur jaune résulte de l’absorption sélective du bleu par la fluorescéine).
- Éclairer par la lampe UV et observer la lumière verte « flashie » (ou vert brillant) qui apparait sous UV et disparait sans UV.
- Insister ici sur le fait qu'il y a émission de lumière par la molécule (c’est ce qui donne l’aspect brillant).
- Puis arrêter les UV et retrouver la couleur jaune mat (sans émission de lumière).
- Faire de même avec du Schweppes® tonic. On observe une lumière bleue.
- Faire de même avec papier blanc. On observe une lumière bleue.
- Faire de même avec des encres de surligneurs préalablement étalées sur un papier.
Explications à adapter selon le public, élèves de lycée ou grand public
La fluorescéine est une molécule qui présente en son sein des électrons qui peuvent acquérir de l’énergie, cad monter à un niveau supérieur instable. Les électrons sont dits dans un état excité et tendent à revenir à un état stable. Lors de ce retour à l’état stable, ils émettent de l’énergie sous forme lumineuse. Ici il s’agit de la lumière verte.
Ce phénomène s’arrête si on éteint la lampe UV. Ce phénomène est appelé fluorescence. Et la fluorescéine est dite une molécule fluorescente.
On peut proposer un résumé du type :
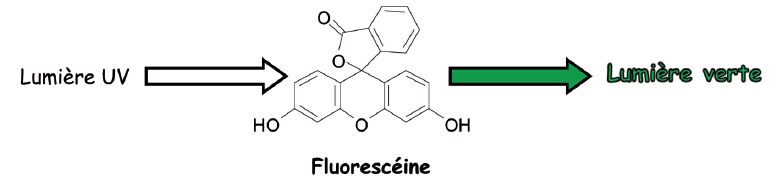
Source : Le laboratoire des couleurs – Anne Guillerand - BUP vol. 104 ( Déc. 2010)
Avec du Schweppes® on observe une lumière brillante bleue sous UV. Elle est dû à la molécule fluorescente de quinine présente dans le Schweppes®.
.png)
formule de la quinine
Avec du papier blanc
Pourquoi observe-t-on que le papier blanc émet du bleu quand on l’éclaire par la lampe UV ?
Dans la composition du papier il a été ajouté des produits fluorescents dits azurants (comme l’azur : bleu).
Pour faire un lien avec la vie de tous les jours, on trouve aussi ces additifs dans les lessives pour améliorer la sensation de blanc des tissus (« plus blanc que blanc » comme disent certaines publicités ou comme le caricaturait Coluche). Cette impression est due au fait que la lumière du soleil contient aussi des UV qui excitent les électrons des azurants.
C’est le même effet que l’on observe avec les chemises blanches dans les boites de nuits où l’on danse en lumière dite noire (qui sont en réalité des UV proches du visible).
Le phénomène est le même avec les traces de surligneurs qui ont été étalées sur du papier. Leur encre visible et résistante à la lumière sans pour autant masquer le texte lui-même,contient des agents fluorescents.
On peut citer d’autres composés fluorescents connus :
- Nombreux minéraux : fluorites (à l’origine du nom de la propriété), quartz, topaze…
- Monde végétal et vivant : chlorophylle, certains champignons, scorpions…
- Produit pharmaceutique : éosine
- Tubes d’éclairage fluorescents
- Utilisation de cette propriété dans l'art, aussi bien dans des peintures utilisant des pigments fluorescents que pour analyser les constituants des couches supérieures de peintures
- Utilisation pour certains diagnostics médicaux
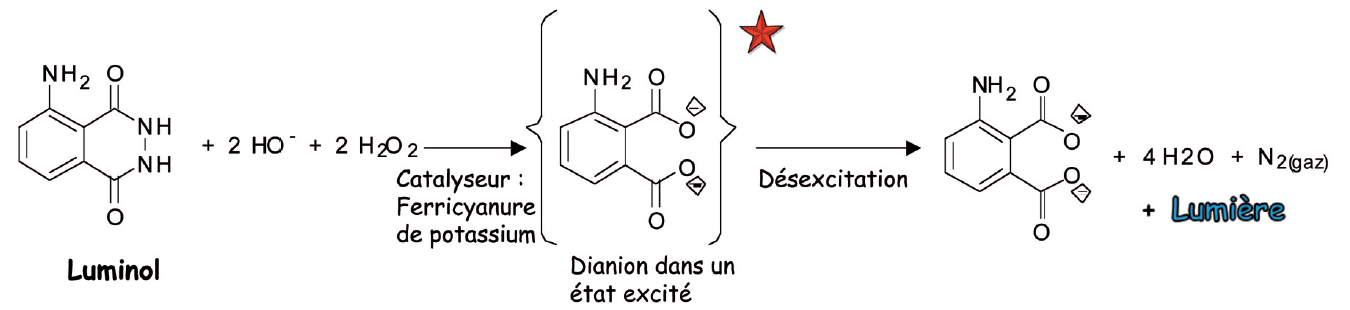
Expérience 2 - Chimiluminescence : émission de lumière provoquée par une réaction chimique réalisée avec le luminol
Matériel
- 1 balance au 1/100e avec capsules plastiques pour pesées + spatules
- 2 grandes éprouvettes de 500 mL
- 1 très grande éprouvette de 1000 mL
- 2 éprouvettes de 5 mL ou pipettes graduées de 5 mL
- 1 pipette graduée de 3 mL ou 5 mL
- 1 propipette
- 1 cristallisoir
Produits
- luminol 0,1 g (le nom du luminol en nomenclature est la 5-amino-1,2,3,4-tétrahydrophtalazine-1,4-dione)
- solution d’hydroxyde de sodium NaOH (soude) à 10% 5 mL
- eau distillée (1 L)
- ferricyanure de potassium (ou (hexacyanoferrate(III) de potassium) solide 1,5 g
- eau oxygénée (ou solution aqueuse de peroxyde d’hydrogène) à 30% (3 mL)
Mode opératoire
- Préparer sous hotte devant le public ou avoir préparé à l’avance (sauf l’ajout de l’eau oxygénée qui doit se faire au dernier moment)
- Éprouvette A (ou fiole jaugée A facile à boucher si réalisée à l’avance) : dissoudre 0,1 g de luminol dans 400 mL d’eau et ajouter 5 mL de soude à 10%.
- Éprouvette ou fiole jaugée B : dissoudre 1,5 g de ferricyanure de potassium dans 400 mL d’eau. Ajouter à la dernière minute 3 mL d’eau oxygénée à 30%
- Rendre sombre la pièce, verser simultanément le contenu des 2 éprouvettes A et B dans un grand entonnoir déposé sur la grande éprouvette à pied : il se produit une magnifique lumière bleue !
On peut aussi dans l’éprouvette B ne mettre que l’eau et l’eau oxygénée et le mode opératoire est alors le suivant.
Introduire quelques cristaux de ferricyanure de potassium solide dans la grande éprouvette où aura lieu l’expérience. Rendre sombre la pièce, verser simultanément le contenu des 2 éprouvettes A et B via un grand entonnoir dans la grande éprouvette à pied : il se produit une magnifique lumière bleue !
Notions à développer sous forme de commentaires et à adapter selon le public pendant la démonstration
Présentation préalable des produits présents dans les éprouvettes :
Éprouvette B :
L’eau oxygénée : que tout le monde connait et a dans sa pharmacie ; mais ici elle est beaucoup plus concentrée. C’est un produit très réactif et oxydant, surtout si elle est concentrée.
Le ferricyanure est un composé contenant du fer à l’état oxydé [Fe (III)] C’est ici un catalyseur c’est à dire un produit qui va accélérer la réaction que l’on veut observer.
Éprouvette A :
La soude : elle créé un milieu basique propice à la réaction (on peut dire que tout le monde connait la soude soit sous ce nom soit sous forme de Destop par exemple et en a dans sa cuisine sous les lavabos !! ce qu’il ne faut pas faire pour protéger les enfants !!!).
Le luminol est une molécule complexe fragile en présence d’oxydant telle que l’eau oxygénée.
Si le public est un peu plus averti on peut ajouter que la fragilité concerne une partie seulement de la molécule, là où il y a 2 atomes d’azote liés entre eux. On peut aussi montrer le dessin de la molécule ou un modèle moléculaire et montrer les 2 atomes d’azote concernés.
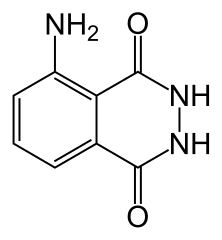
formule du luminol
Explications
Quand les 4 produits sont mis en contact, le luminol et l’eau oxygénée en milieu basique, en présence de ferricynanure de potassium (comme catalyseur) réagissent vivement (ce qui libère une forte énergie) et il se forme du diazote, de l’eau et un di-anion aminophtalate dérivé du luminol, dans un état excité. Cet état résulte de l’énergie libérée par la réaction. Puis ce di-anion se désactive et émet une lumière bleue. La réaction chimique a ainsi créé de l’énergie que l’on observe sous forme lumineuse.
On peut proposer un résumé du type :
Source : Le laboratoire des couleurs – Anne Guillerand - BUP vol. 104 ( Déc. 2010)
Exemples dans la vie courante
- Cette expérience est réalisée par la police scientifique pour rechercher des traces de sang. En effet l’hémoglobine du sang contient du fer à l’état oxydé Fe(II) qui en présence de l’eau oxygénée passe à l’état de Fer(III) qui joue alors le rôle de catalyseur (à la place du ferricyanure que nous avons utilisé). Ce procédé a été repris dans un certain nombre de séries TV policières !
- Dans le monde animal, tout le monde a eu l’occasion de voir, lors de promenades nocturnes, des vers luisants ou des lucioles émettre des petites lumières jaunes à verdâtre. Cette lumière résulte d’une réaction chimique, propre à l’animal, dans le corps de la luciole. On parle aussi de bioluminescence. Ces émissions de lumière permettent aux couples de se trouver pour assurer la reproduction.
- Certains planctons et phytoplanctons sont aussi bioluminescents. Ce processus pouvant à la fois servir selon l’espèce pour le camouflage, l’attraction sexuelle, mais aussi la répulsion ou la communication.
Si on est en présence d’un public un peu plus averti, on peut préciser que dans les réactions de bioluminescence observées dans divers organismes vivants, le composé chimique à l'origine de la luminescence est presque toujours la luciférine. Celle-ci émet de la lumière en subissant une oxydation par le dioxygène grâce à l'intervention d’une enzyme, la luciférase qui joue le rôle de catalyseur.
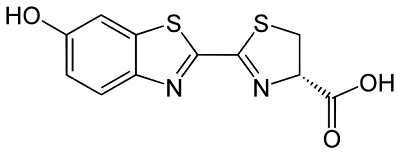
formule de la luciférine
Expérience 3 - Expérience combinée de chimiluminescence et de fluorescence réalisée avec du luminol et de la fluorescéine
- Même matériel et mêmes produits qu’en 2 + solution de fluorescéine ou fluorescéine en poudre.
- Même mode opératoire qu’en 2, mais ajouter dans la solution A initiale de la fluorescéine en poudre ou en solution, de manière à obtenir une solution bien jaune.
- On peut sans doute utiliser pour cette derrière expérience les produits en quantités divisées par 2.
- Observer alors une lumière verte
Explications
La même réaction chimique du luminol et de l’eau oxygénée conduit au di-anion qui en se désactivant excite la molécule de fluorescéine. Celle-ci en se désactivant à son tour donne la couleur verte qu’elle émettait sous UV (rappel de la 1ère expérience).
Cela peut avoir lieu avec tout autre molécule fluorescente ajoutée. On obtiendra l’émission de la couleur caractéristique de la molécule ajoutée.
Exemples dans la vie courante
Les bâtons lumineux festifs que l’on peut acheter lors de concerts ou fêtes et que l’on doit casser délicatement. Lors de la fracture du petit tube de verre intérieur, qui séparait les produits, les réactifs sont mis en contact et il se produit une réaction comparable à celle que nous venons d’observer, avec l’eau oxygénée, le luminol et la fluorescéine.
Il y a différentes couleurs selon les réactifs fluorescents introduits dans chacun des bâtons.
Le phénomène s’arrête quand tous les produits chimiques contenus dans le bâton ont été consommés.
Illustration : Capture d'écran vidéo Fluorescence © Mediachimie/Blablareau au labo
Source : luminol, fluorescéine, UV, émission de lumière, bioluminescence, investigation policière, sang,
