Pourquoi des cristaux de synthèse ? Longtemps les cristaux naturels trouvés dans la roche, pierres rares, transparentes, incolores ou colorées par des impuretés, ont été utilisés principalement en joaillerie.
Sous forme de monocristal, un composé peut posséder des propriétés physico-chimiques particulières et depuis longtemps les chercheurs ont recours au monocristal pour accéder à la structure et aux propriétés qui en découlent. Certains cristaux sont désormais indispensables dans des applications modernes : cristaux de quartz (piézoélectricité), cristaux de silicium ou de germanium (semi-conducteurs), cristaux utilisés pour les besoins de l’optique (transparence, biréfringence), de l’électronique, des lasers solides… L'électronique et l'informatique s’appuient sur les propriétés de cristaux ultra-purs.
Or les cristaux naturels (pierres précieuses, quartz, etc.) ont souvent des défauts et/ou sont issus de processus géologiques de plusieurs millions d’années. Leur rareté mais aussi l’impact environnemental et économique de leur extraction les rendent très coûteux.
De nombreuses techniques de synthèse ont été développées pour obtenir, dans des conditions de croissance reproductibles, des cristaux ultra-purs (ou volontairement dopés par des atomes spécifiques), exempts de défauts et répondant aux exigences industrielles (dimension, densité de défauts, homogénéité, orientation, couches minces, etc).
Cristallisation
La cristallisation est le processus de formation d'un cristal. C’est le passage des atomes d'un état plus ou moins désordonné (liquide, gazeux, solide vitreux ou amorphe) à un état ordonné à plus ou moins longue distance. Cela requiert du temps et de l’énergie, pour faire migrer les atomes vers leur position finale, dans le réseau ordonné.
Plusieurs méthodes existent pour obtenir un monocristal de synthèse (cristallogenèse), selon la température de fusion, la fusion congruente ou non, le changement de structure en fonction de la température etc. Les principales méthodes sont basées sur :
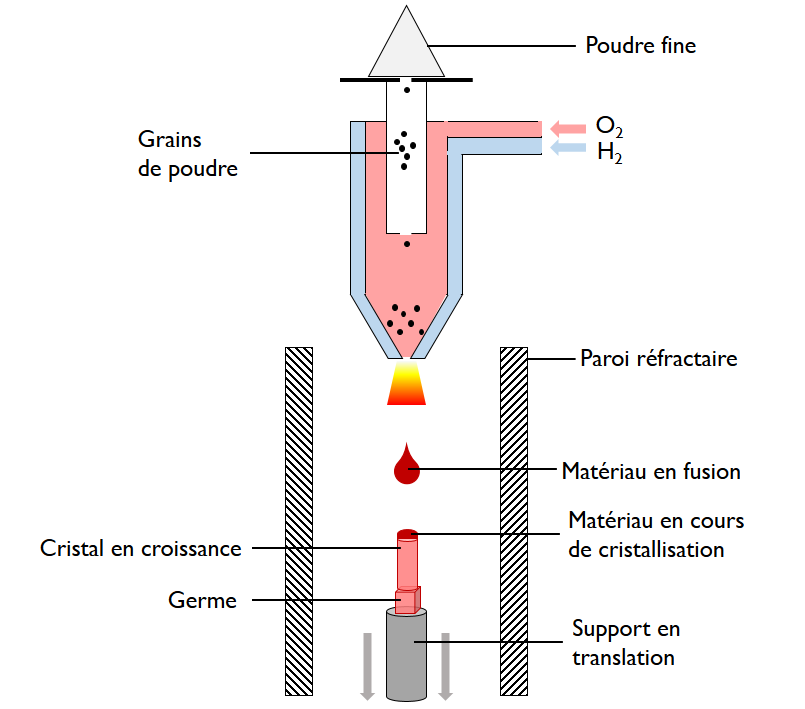
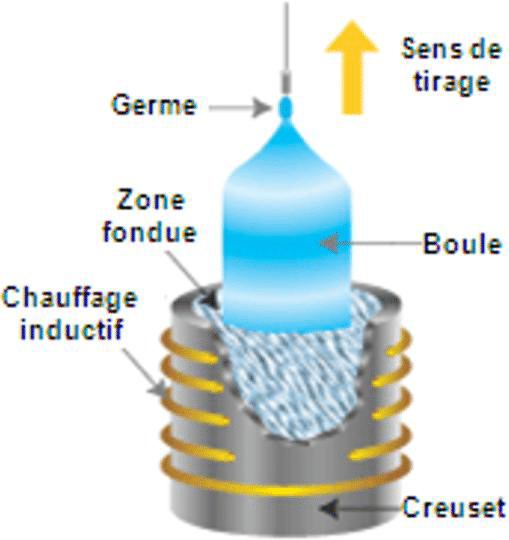
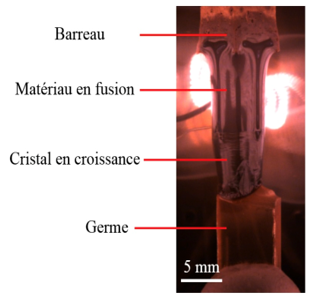
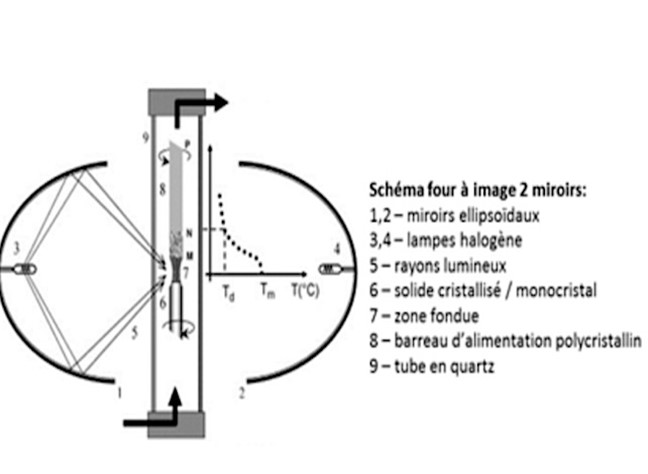
- le refroidissement lent d’un composé en fusion : méthodes de Verneuil (1), Czochralski (2), zone fondue verticale ou four à image (3);
- le dépôt à partir d’une solution sursaturée d’un composé : croissance hydrothermale (4) à partir d’une solution aqueuse, méthode des flux à partir de sels fondus (5);
- le dépôt en phase vapeur.
 |  |
| Figure 1 : Procédé Verneuil. Schéma Benoît Grosjean.Site CultureSciences Chimie licence CC-BY-NC-SA | Figure 2 : Procédé Czochralski. Damien Sangla. Nouveaux concepts pour des lasers de puissance : fibres cristallines dopées Ytterbium et pompage direct de cristaux dopés Néodyme, Thèse Université Claude Bernard Lyon 1 (2009) ⟨tel-00448320⟩ |
 |  |
| Figure 3a : Four à image. Equipe Matériaux pour la Photonique et l'Opto-électronique, Chimie ParisTech, CNRS, Institut de Recherche de Chimie Paris | Figure 3b : Four à image. Equipe SP2M- ICMMO, Université Paris-Saclay |
Quelques cristaux de synthèse à vocation technologique
Les exemples de cristaux de synthèse largement utilisés permettent d’illustrer ces méthodes, développées d’abord en laboratoire puis à l’échelle industrielle.
Rubis (Tfus = 2050 °C)
Le rubis naturel est une pierre précieuse rouge, très rare, très dure et transparente. C’est de l’alumine contenant du chrome qui lui donne sa couleur rouge, Al2O3Cr.
- En raison de leur grande résistance à l'usure, les rubis sont depuis longtemps utilisés en horlogerie où ils améliorent l’efficacité des rouages mécaniques.
- En 1960 le rubis est la source du premier effet laser, un des seuls lasers émettant dans le visible, qui a depuis connu un développement ininterrompu, dans l’industrie, la médecine, la vie quotidienne, comme dans la recherche.
Pour ces raisons, les scientifiques ont très tôt cherché à obtenir le rubis en laboratoire. Les premières synthèses sont dues au chimiste français Verneuil, « inventeur » de la cristallogenèse (1891-1902). Souvent appelée Procédé Verneuil (1), sa méthode de fabrication est la croissance par fusion à la flamme, toujours largement employée aujourd'hui. Pour l’optique (lasers), on emploie des rubis synthétiques de très haute qualité, fabriqués par tirage vertical à partir d'un bain fondu, méthode dite de Czochralski (2). Le four à image ou four à concentration de rayonnement (3) est aussi utilisé pour produire des barreaux de rubis.
Diamant (Tfus = 3547°C à l’abri de l’air…)
Le diamant est une des variétés cristallisées du carbone dont la forme stable est le graphite. Il est constitué de carbone pur, on ne peut donc pas parler de « synthèse ».
Outre son fort pouvoir réflecteur, dû à son indice de réfraction élevé (2,42) qui lui donne un éclat unique, c’est le plus dur des minéraux connus, très utilisé en milieu industriel ; c’est un isolant électrique, ses propriétés mécaniques, optiques, thermiques et électroniques sont exceptionnelles.
- En 1772 Lavoisier démontre que le diamant est constitué de carbone, les premiers essais de synthèse commencent à la fin du 19e siècle (1880 - J. B. Hannay, 1893 - H. Moissan). La première véritable synthèse a lieu en 1954 (6).
- Les diamants de culture sont obtenus par technologie HPHT (Haute Pression, Haute Température) qui reproduit la formation des diamants naturels (7).
Le diamant peut aussi être produit par dépôt chimique en phase vapeur qui produit plus vite des diamants de meilleure qualité (8).
Quartz (Tfus = 1750°C)
Le quartz est une des variétés cristallines de la silice SiO2. Les cristaux de quartz sont piézoélectriques et largement utilisés dans l’horlogerie (montres à quartz), les sonars et pour définir les fréquences de fonctionnement des appareils électroniques (téléphones, ordinateurs, GPS…).
- Le quartz naturel (ou cristal de roche) est très abondant, mais présente de nombreux « défauts » tels que macles, dislocations, inclusions, changement de structure en fonction de la température etc. Il est donc nécessaire de le synthétiser.
- La cristallogenèse se fait par procédé hydrothermal, reproduisant les conditions naturelles de formation des cristaux de roche (4). C'est un processus lent qui peut durer plusieurs semaines.
Silicium (Tfus =1414°C)
Le silicium Si est encore le matériau essentiel de l'ère du numérique, même si d’autres éléments prennent la relève. Il est semi-conducteur et c’est un des constituants de base des panneaux solaires, transistors, circuits intégrés, microprocesseurs et autres dispositifs électroniques. La pureté requise varie selon l’application visée : pour les cellules solaires photovoltaïques, il faut du silicium de pureté 99,999 9%, alors que pour les puces électroniques il faut du silicium de pureté électronique, soit 99,999 999 99%.
- La matière première à partir de laquelle il est obtenu est la silice SiO2. Comme c’est une source abondante (environ 60 % de la croûte terrestre), l'industrie des semi-conducteurs a largement développé la synthèse de cristaux de silicium purs ou dopés à partir de la silice.
Dans un premier temps, la silice est réduite par du carbone (selon la réaction SiO2 + C → Si + CO2) puis le silicium polycristallin obtenu est purifié et recristallisé par fusion/ refroidissement (tirage Czochralski, ou zone fondue).
En particulier, le procédé par zone fondue permet de purifier des composés cristallisés stables à la fusion et d'obtenir de très hauts degrés de pureté (99,999 % en masse dans le cas du silicium). En effet, lors de la recristallisation, les impuretés restent préférentiellement dans la zone fondue.
Peut-on différencier les cristaux naturels de ceux obtenus en laboratoire ?
Le cristal synthétique présente, par définition, mêmes composition, structure et aspect que son équivalent naturel et les mêmes caractéristiques physiques et chimiques.
Mais chaque méthode laisse des marques de croissance, voire des impuretés (azote, carbone…) inconnues dans le matériau naturel, et des signes distinctifs qui peuvent être décelés à l'aide d'instruments optiques professionnels. D’autre part, les dimensions diffèrent, parfois fortement ! Alors que le plus gros diamant de laboratoire pèse 155 carats (9), le plus gros diamant naturel de joaillerie connu, le Cullinan, pesait 3 106 carats, soit 621 grammes ! Inversement, le rubis de synthèse peut atteindre plusieurs kilos et des dimensions de 20 à 30 cm.
Longtemps réticents envers les « gemmes » de synthèse, les grands joailliers commencent à les utiliser ! Toutefois on ne peut passer sous silence les réactions « contre » le diamant de synthèse, dont la fabrication est très énergivore et prive de ressources et d’emplois les pays riches en diamants naturels - ce dernier argument paraît contestable lorsqu’on connaît l’existence des diamants de sang.
Conclusion
L’évolution des domaines de haute technologie dépend clairement des monocristaux de synthèse. Les chimistes ont su « reproduire » la nature et les techniques n'ont cessé d’évoluer. Celles présentées ici ont de nombreuses variantes, qui dépendent du matériau et de l’application visée. Mais la recherche y recourt également pour étudier les relations entre structure et propriétés d’un composé (et les éventuelles applications).
Andrée Harari
(1) Procédé Verneuil, C. R. Acad. Sc. (1902) p. 791. Procédé Verneuil : le matériau en poudre fond dans une flamme de chalumeau oxhydrique avant de recristalliser lentement au contact d’un monocristal préalablement orienté qui sert de germe.
(2) Méthode Czochralski (1918) : J. Czochralski, Z. Physik Chem. 92 (1918) p. 219
Le matériau (par exemple Al2O3Cr) est fondu dans un creuset. Le liquide se solidifie sur un germe monocristallin de petite taille, suspendu au contact du liquide. On tire ce germe vers le haut tout en le faisant tourner lentement. La taille des cristaux obtenus peut atteindre plusieurs centimètres.
(3) Four à image (zone fondue verticale). Le rayonnement d’une source d’énergie (lampe, laser, soleil) est concentré, grâce à des miroirs, pour chauffer et fondre les matériaux passant dans ce faisceau. La migration lente et contrôlée hors de la zone chaude entraîne la recristallisation par refroidissement lent.
(4) Croissance hydrothermale. Dans un cylindre rempli d'eau, on dispose, par exemple, un cristal de quartz naturel (germe sur lequel le cristal artificiel va croître) et de la silice sous une forme soluble. L'ensemble est soumis à une forte pression (environ 100 MPa) et porté à 400 °C mais de sorte que la partie supérieure soit légèrement moins chaude. La solution saturée en silice qui se forme en partie basse est entraînée par convection vers le haut du récipient, où elle devient sursaturée (la solubilité décroît en fonction de la température). La silice précipite alors sous forme de quartz au contact du germe.
(5) W. G. Pfann, Principles of Zone Melting, Transactions of the American Institute of Mining and Metallurgical Engineers 194 (1952) p. 747.
(6) H.T. Hall, General Electric - U.S. Patent 2,947,608 or "Diamond Synthesis", Aug. 2, 1960
(7) Les diamants se sont formés il y a 2,5 milliards d’années, à 200 km sous la surface de la Terre, dans des conditions extrêmes de pression (5 GPa, environ 50 000 bars et de température (1500 °C environ). C’est leur expulsion brutale au sein du magma, lors des éruptions volcaniques, qui les a apportés à la surface.
Dans la méthode HTHP, un petit germe de diamant est placé dans une presse remplie de graphite et soumise à des températures de 1500 à 2000 °C et des pressions supérieures à 70 000 bar. Les atomes de carbone du graphite s’agrègent autour du grain de diamant et lui permettent de croître, très lentement. On obtient ainsi des cristaux de quelques carats (1 ct = 0,2 g).
(8) Dépôt chimique en phase vapeur. La technique utilise un mélange méthane + hydrogène, chauffé pour créer un plasma de carbone au-dessus d'un substrat, sur lequel les atomes de carbone se déposent pour former les couches cristallines successives.
(9) Schreck, M. et al., Ion bombardment induced buried lateral growth: the key mechanism for the synthesis of single crystal diamond wafers, Sci. Rep. 7 (2017) 44462; doi: 10.1038/srep44462
Pour en savoir plus
- B. Grosjean, Les procédés de cristallogenèse, piliers méconnus de la technologie moderne (2017) Site Culture Sciences Chimie ENS
- Procédés de fabrication des gemmes synthétiques, Site Gemmo.eu
- Méthodes d'élaboration de cristaux massifs pour l'optique, B. Ferrand, LETI/DOPT/SCOPI/LCDO/Matériaux/CEA Grenoble Collection SFO 8 (2003) 3-21
- J.-C. Bouilliard, Et l’homme créa la pierre. Les synthèses de cristaux. AMIS. 1996. voir https://www.amis-mineraux.fr/publications/toutes-les-publications.html
Crédit illustration : Un diamant synthétique taillé, conçu avec la méthode CVD. Steve Jurvetson - https://www.flickr.com/photos/jurvetson/156830367/, licence CC BY 2.0, Lien
Les radicaux sont des espèces chimiques possédant au moins un électron non apparié. La spectroscopie paramagnétique électronique (RPE) permet de détecter ces espèces radicalaires.
Structure des radicaux carbonés [1]
Il existe essentiellement quatre types d’espèces carbonées dans lesquelles l’atome de carbone n’est pas tétravalent : il s’agit des carbanions, des carbocations, des carbènes (R2C portant à la fois une lacune électronique et un doublet non liant) et des radicaux carbonés. Parmi eux seuls les carbanions respectent la règle de l’octet.
Exemples
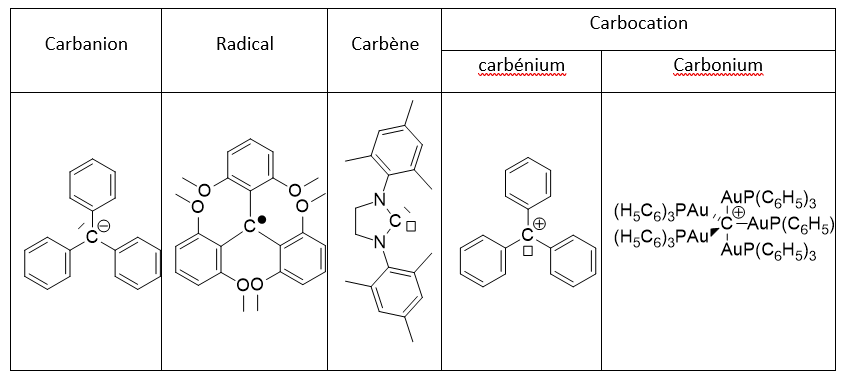
L’activité optique d’une molécule ne possédant qu’un atome de carbone asymétrique est « perdue » lorsqu’on forme le radical carboné associé : on peut considérer alors que la structure devient plane. Cependant des mesures par RPE montrent que le radical tert-butyle est pyramidal avec une barrière d’inversion très faible, autour de 7-8 kJ.mol-1. On peut donc dire qu’à température ambiante le radical carboné apparaît « dynamiquement » plan, autrement dit tout se passe comme s’il était plan !
Il en est de même pour les radicaux éthyléniques Z ou E qui sont en équilibre et ne conservent pas l’information de la configuration Z ou E.
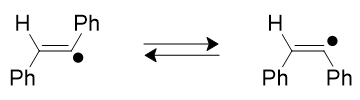
Figure 1
Stabilité des radicaux carbonés [2]
- Les radicaux sont des espèces très réactives avec en général une durée de vie très courte. Par exemple le radical méthyle a une demi-vie de l’ordre de 10 minutes. Cependant quelques radicaux sont stables, citons le radical (C6Cl5)3C▪ qui est stable pendant plusieurs jours en solution et stable sous forme solide.
- Un radical peut être stabilisé par la présence d’hétéroatomes adjacents possédant un « doublet non liant » : l’interprétation est la stabilisation par la délocalisation électronique dans le cadre de la théorie des orbitales moléculaires entre l’orbitale à deux électrons de l’hétéroatome et l’orbitale moléculaire occupée par 1 électron de l’atome radical.
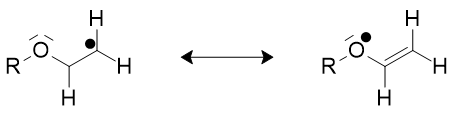
Figure 2
Source des radicaux [3]
Si la rupture homolytique d’une liaison donne naissance a priori à deux espèces moléculaires radicalaires, les conditions expérimentales sont difficiles à mettre en œuvre. On peut employer un amorceur comportant une liaison fragile thermiquement permettant d’initier ultérieurement la rupture de la liaison souhaitée. On peut aussi provoquer la rupture par apport d’énergie sous forme de lumière à des longueurs d’onde bien spécifiques comme le montrent les exemples suivants :
- les composés peroxydes possédant une liaison O-O de faible enthalpie de liaison de l’ordre de 130 kJ.mol-1 conduisent à des radicaux par la cassure de cette liaison vers 100°C ;
- les composés azoïques possédant une liaison N=N se rompent dès 60°C ;
- les molécules avec une liaison Sn-Sn sont décomposées à l’issue d’une excitation lumineuse ;
- les composés stanneux avec une liaison Sn-H, comme l’hydrure de tributylétain Bu3SnH, découvert par D.Barton (Prix Nobel de chimie en 1969) permettent l’obtention d’un radical Bu3Sn▪. Ce composé a été très employé, mais sa toxicité observée lors d’expositions prolongées a entraîné une diminution progressive de son utilisation ;
- on a utilisé depuis des composés contenant du bore en particulier des alkylboranes, tels que Et3B, qui en présence du dioxygène de l’air, conduisent à la formation du radical éthyle (Et▪) ;
- ou encore des composés contenant du silicium tels que H-SiCl3 mais nécessitant l’emploi d’un catalyseur de photodissociation à l’iridium ;
- actuellement des décharges dans des plasmas (par onde sonore, laser ou UV) permettent de générer des espèces radicalaires à pression atmosphérique et à température ambiante sans amorceur !
Principe de la réactivité des radicaux [4]
De nombreuses réactions radicalaires font intervenir un processus mécanistique « en chaîne » qui est un mécanisme à séquence fermée comportant trois étapes principales : l’amorçage, la propagation et la terminaison (par recombinaison). Il est important de mentionner aussi les réactions de transfert d’un radical à une autre espèce chimique moléculaire présente dans le milieu réactionnel.
Il est intéressant de prévoir approximativement la réactivité des radicaux par la théorie des orbitales frontalières : l’électron célibataire occupe l’orbitale moléculaire la plus haute appelée SOMO (en anglais Singly Occupied Molecular Orbital) selon les règles de remplissage de Pauli. L’expérience montre qu’il existe des radicaux nucléophiles et des radicaux électrophiles.
Dans le cadre de la théorie des orbitales frontalières un radical possédant un groupe électrodonneur (ou respectivement électroattracteur) a une SOMO rehaussée (ou respectivement abaissée) et possède alors un caractère nucléophile (ou électrophile). Un radical nucléophile (ou électrophile) réagira de préférence avec une molécule par l’intermédiaire de sa BV (ou sa HO) d’une autre molécule, et ceci d’autant plus si les deux niveaux d’énergie des deux orbitales sont proches : c’est en particulier ce qui explique la réactivité des radicaux avec les composés éthyléniques activés par des groupes attracteur ou donneur. Par exemple dans le styrène le groupe phényle est électrodonneur.
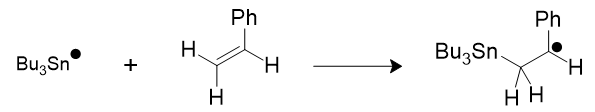
Figure 3
Cependant il existe des composés éthyléniques qui possèdent, à la fois sur un des deux atomes de carbone de la double liaison, un groupe attracteur et un autre donneur d’électron qui sous l’action d’un amorceur conduisent à des radicaux stabilisés par délocalisation électronique par exemple
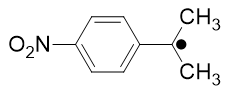
Figure 4
On parle alors d’effet captodatif selon la nomenclature de Viehe qui a isolé de tels radicaux en 1988 à l’Université de Louvain en Belgique.
Un point anecdotique mais révélateur de l’intérêt des radicaux : la réaction du chlorure de méthylmagnésium dans le solvant THF sur de l’éthanal, traditionnellement expliquée par une coupure hétérolytique C-Mg, est plutôt envisagée actuellement par un mécanisme à plusieurs étapes avec en particulier une coupure homolytique de la liaison carbone-métal sur un état intermédiaire parmi les états intermédiaires et de transition, provenant de travaux de simulation théorique. Cette interprétation provient notamment des travaux de O. Eisenstein à Montpellier publiés en 2020 soit plus de cent vingt ans après la découverte de cette réaction par Victor Grignard !
Polymérisation radicalaire [4]
La polymérisation des alcènes est difficile à contrôler à cause des réactions de transfert d’un radical au polymère et/ou au monomère qui créent des ramifications lors de l’allongement de la chaîne. Cependant depuis vingt ans, des travaux ont permis de réaliser une polymérisation radicalaire contrôlée par transfert de chaîne réversible par addition-fragmentation appelée Reversible Addition- Fragmentation Chain Transfer (RAFT) en anglais. Les principaux agents de transfert sont des dérivés soufrés du type
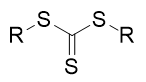
Figure 5
Ainsi S. Zard (École Polytechnique) en France a développé en collaboration avec Rhodia, devenu depuis Solvay, la technologie MADIX (en anglais Macromolecular Design by Interchange of Xanthates) qui met en jeu des xanthates S (C=S) OR. Ces derniers permettent alors la formation du radical R▪ qui a une durée de vie suffisante lui permettant de réagir même avec un alcène non activé par une fonction. Les résultats excellents obtenus au laboratoire ont entraîné le dépôt de plusieurs centaines de brevets depuis 1997 ! Les applications sont multiples dans le domaine des adhésifs, des traitements de surface, tensioactifs et cosmétiques. Par exemple l’équipe de S. Zard a mis au point et la société Rhodia a commercialisé des copolymères diblocs employés principalement dans le domaine du traitement de l’eau.
Formation des molécules dans le milieu interstellaire (MIS) [5], [6]
Le MIS englobe tout l’espace qui se trouve entre les étoiles ou à leur voisinage.
Une partie des molécules interstellaires observées dans le MIS résultent de chaînes de réactions impliquant des radicaux en phase gazeuse. Mais certaines molécules nécessitent la présence de grains de poussière interstellaires pour activer des réactions chimiques entre les atomes à leur surface (catalyse hétérogène). L’omniprésence de la molécule de dihydrogène, avec une densité allant de 100 à 108 atomes d’hydrogène par cm3, s’explique par la dissociation du dihydrogène en atomes sous l’excitation du fort rayonnement solaire suivie par une recombinaison en molécules sur les grains de poussière dans des zones non illuminées par le rayonnement solaire.
Le MIS contient de nombreuses molécules possédant l’élément carbone. Pour des photons d’énergie suffisante, l’étape photochimique de départ engendre des radicaux qui peuvent entrer dans des chaînes de réaction conduisant à des molécules de plus en plus complexes jusqu’à des systèmes dits prébiotiques tels que les acides nucléiques comme la cytosine et l’uracyle.
Signalons que le di-radical éthynyle de formule 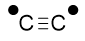 noté C2▪▪ a été observé dès la fin du XIXe siècle dans les comètes ; en particulier Jackson en 1976 a montré dans la comète de Halley l’existence de l’acétylène (éthyne) qui provient du radical C2▪▪, observé en spectroscopie en lumière visible lors de phénomènes de relaxation.
noté C2▪▪ a été observé dès la fin du XIXe siècle dans les comètes ; en particulier Jackson en 1976 a montré dans la comète de Halley l’existence de l’acétylène (éthyne) qui provient du radical C2▪▪, observé en spectroscopie en lumière visible lors de phénomènes de relaxation.
Radicaux non carbonés
Rappelons que le dioxygène moléculaire est un diradical moléculaire dans son état stable ! Le remplissage des orbitales moléculaires selon les règles de Pauli et de Hund conduit en effet à l’occupation de chacune des deux orbitales antiliantes de type pi. Ainsi l’oxydation de l’isopropylbenzène par l’oxygène de l’air donne le radical cumyle (Me)2 C▪-Ph qui conduit au phénol et à l’acétone, procédé réalisé industriellement.
L’exemple le plus important est la molécule NO. C’est une espèce radicalaire stable possédant une double liaison entre N et O et un électron non apparié. Il a été mis en évidence dès 1986 dans plusieurs systèmes biologiques par des mesures de spectrométrie de masse et de chimiluminescence. Dans la nature il peut réagir avec le dioxygène moléculaire (diradical !) ou des métaux de transition engagés dans des molécules complexes telles que l’hémoglobine. La durée de vie de quelques secondes des radicaux intermédiaires conduit à des réactions très rapides rendant difficile la détection dans les milieux biologiques. Le monoxyde d’azote NO a une action antibactérienne (également sur des cellules tumorales) et antiparasitaire. Cependant, il ne faut pas oublier que NO est un polluant présent dans la fumée de cigarette ou dans certains milieux urbains et industriels. En effet, à des concentrations de 100 ppm dans l’air il altère les tissus pulmonaires ; sa toxicité provient de son oxydation par la molécule de dioxygène qui conduit au dioxyde d’azote NO2 réputé très toxique !
Note : Je tiens ici à remercier vivement Julien Lalande pour ses nombreuses corrections de syntaxe ainsi que les formules des molécules et aussi pour les belles discussions sur le sujet !
Bibliographie :
[1] Cours de J.Y. Lallemand de l’École polytechnique : communication personnelle (1998)
[2] Livre de J. Fossey et coll. : les réactions radicalaires en chimie organique (1995) chez Masson
[3] L. Fensterbank – Nouvelles catalyses pour accéder à la complexité moléculaire article téléchargeable de l’Actualité Chimique, N° 435 décembre 2018, pages 13 et suivantes
[4] S. Zard et coll., Une quête de nouvelles réactions pour la synthèse organique article téléchargeable de l’Actualité Chimique, N° double 393-394 février-mars 2015 page 48 et suivantes
[5] Coordinateurs S.Leach et E. Amouyal, Molécules et interstellaires et photochimie dans l’espace, dossier téléchargeable de 4 articles de l’Actualité Chimique N° 315 janvier 2008 pages I à XXIII
[6] Michel Guelin, Molécules dans l’Univers : Où ? Quand ? Comment ? Pourquoi ? conférence et article, site Mediachimie.org, Colloque Chimie, aéronautique et espace du 8 novembre 2017, Chimie, aéronautique et espace (2018) EDP Sciences, ISBN9782759822836 p. 183
Crédit illustration : image par PublicDomainPictures de Pixabay
À la suite du colloque " Chimie, Recyclage et Économie Circulaire " du 8 novembre 2023 à la Fondation de la Maison de la Chimie, l’équipe de Mediachimie.org vous propose de tester vos connaissances au travers d'un quiz ludique et instructif.
Avez-vous tout retenu ? À vous de jouer !
À travers l’utilisation de documents de natures diverses, pour une grande partie issus du site Mediachimie, le lecteur prendra conscience, si ce n’est pas déjà le cas, de la diversité de ressources et de la richesse de ce site et pourra poursuivre sa quête d’informations d’actualités validées.
Programmes spécifiques de physique-chimie pour les classes de première et de terminale professionnelles propres au Groupement de spécialité 5.
Le Groupement 5 rassemble les spécialités de baccalauréats professionnels mobilisant des compétences professionnelles qui nécessitent de solides connaissances dans le domaine de la chimie. Il réunit les spécialités de secteurs professionnels variés : l’industrie chimique, la bio-industrie, la cosmétologie, la teinturerie, les textiles, la plasturgie, l’esthétique, la gestion des pollutions et la protection de l’environnement, la verrerie, les plastique et composite…
Source : Dossier réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
À travers l’utilisation de documents de natures diverses, issus en grande majorité du site Mediachimie, le lecteur prendra conscience, si ce n’est pas déjà le cas, de la richesse de ce site et pourra poursuivre sa quête d’informations sur ce sujet non seulement à fort potentiel médiatique en cette année olympique mais aussi très intéressant eu égard aux nombreuses évolutions/innovations dont il fait l’objet.
Programme de physique-chimie :
- Première STI2D : Matière et matériaux / Propriétés des matériaux et organisation de la matière
- Première STD2A : Connaître et transformer les matériaux / Connaître et transformer les matériaux organiques et utiliser des matériaux innovants
- Terminale STL : Ondes / Ondes acoustiques (ondes stationnaires)
- Terminale générale : Constitution et transformation de la matière / Élaborer des stratégies en synthèse organique
Source : Dossier réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
Vidéo de la conférence (durée :20:27)
Retrouvez ici
toutes les vidéos de ce colloque. Possibilité de les télécharger.
Source : Colloque Chimie, Recyclage et Economie circulaire, 8 novembre 2023
En 2022, les installations mondiales de capacité photovoltaïques ont atteint un chiffre record de 268 GW [1] pour une capacité cumulée de 1,2 TW [2]. Si l’énergie photovoltaïque est essentielle pour réussir la transition énergétique, en permettant de remplacer rapidement et à un coût compétitif les énergies fossiles, elle doit encore satisfaire à d’importantes exigences quant à sa circularité.
Aujourd’hui, les technologies basées sur le Si représentent plus de 95% du marché mondial [3]. Outre le procédé de purification du Si, consommateur en énergie et matières premières, l’étape de découpe des
wafers est critique, puisque près de 40% de la matière est perdue sous forme de kerf, un mélange de copeaux de Si et de liquide de découpe. Fortement contaminé par des éléments tels que le carbone,
l’oxygène ou l’aluminium, le Si contenu dans cette boue n’est actuellement pas revalorisé mais considéré comme un déchet. Il y a un ainsi un vrai besoin de développer un procédé dédié à la purification du kerf,
afin de permettre sa réutilisation dans la chaine de valeur du Si.
D’autre part, les quantités de modules arrivant en fin de vie sont en pleine explosion, et on estime que d’ici 2030, il faudra traiter près de 400 000 tonnes de modules en Europe [4]. Bien que les recycleurs traditionnels aient adopté des techniques de broyage, celles‐ci sont largement inefficaces, puisqu’elles ne permettent ni de récupérer l’entièreté des matériaux, ni de le faire avec un haut niveau de pureté. Ainsi, ces dernières années ont vu l’émergence de procédés de recyclage à haute valeur ajoutée, permettant de mettre en place des solutions plus durables pour le traitement des déchets photovoltaïques.
Dans cette présentation, nous démontrerons que l’innovation et le développement de procédés dédiés permettent de relever ces défis, afin de soutenir le développement de la filière photovoltaïque répondant aux enjeux de circularité.
Vidéo de la conférence (durée : 20:06)
Retrouvez ici toutes les vidéos de ce colloque. Possibilité de les télécharger.
Références :
[1] Sandra Enkhardt 2022, ‘Global solar capacity additions hit 268 GW in 2022, says BNEF’, pv magazine, 2022
[2] IEA (2020), ‘World Energy Outlook 2020, IEA’, Paris https://www.iea.org/reports/world‐energyoutlook‐2020, License: CC BY 4.0, 2020
[3] IEA PVPS, ‘Trends in photovoltaic applications 2022’, IEA PVPS trends Reports – Task 1, 2022
[4] SolarPower Europe (2022), ‘European Market Outlook For Solar Power 2022‐2026’, 2022
Texte : d’après la conférence de Yohan PARSA
Source : Colloque Chimie, Recyclage et Economie circulaire, 8 novembre 2023
Les engagements en faveur de la décarbonation de la mobilité poussent les acteurs du secteur à accroître leurs efforts en faveur d’une transition vers les véhicules électriques. En 2025, les capacités de recyclage devront être capables d’absorber 50 000 tonnes d’équivalent Batteries (200 000 unités)... 150 000 tonnes en 2030.
Cette stratégie entraîne un accroissement exponentiel de la demande en métaux stratégiques (nickel, cobalt, lithium, cuivre…) présents dans les batteries des véhicules électriques.
De multiples questions se posent concernant le développement de ce nouveau marché :
- La question de l’accès à la ressource en métaux stratégiques au sein de l'Union Européenne et de la France compte tenu des zones de production (Congo, chine, Chili...).
- Le risque inflationniste de la valeur de ces métaux, ou tout le moins une variation erratique des cours qui pèserait sur la rentabilité économique de la filière.
- La raréfaction programmée de certaines ressources minières (cobalt) compte tenu d’une surexploitation des sous‐sols en vue d'approvisionner la production des cathodes.
- La question environnementale liée à l’exploitation minière, à la transformation des minerais et au transport des matières prétraitées.
- L’enjeu de la fin de vie des batteries en terme environnemental et le sujet de la gestion des scraps issus des Giga‐Factories qui produisent les batteries.
Pour répondre en partie à ces questions, une Réglementation Européenne incitative en phase avec la Stratégie d’indépendance sur les matières stratégiques est en cours de validation. Elle vise à recycler une
grande part des batteries sur le territoire européen en fixant des taux d’extraction des matières extrêmement ambitieux permettant une approche vertueuse de la vie de la batterie.
Depuis plus de 10 ans, le Groupe VEOLIA explore des voies de recyclage des batteries VE en fin de vie et des sous‐produits de leurs productions. Des méthodes prenant en compte la gestion des risques intrinsèques à la manipulation de batteries usagées, leur mise en sécurité, leur démantèlement, le broyage des fractions unitaires et l’extraction sélective des métaux stratégiques par voie chimique. Ces travaux ont abouti à un premier concept pilote qui a confirmé la pertinence de la technologie étudiée.
L’enjeu est maintenant de passer à un démonstrateur « pré‐industriel » permettant de recycler chimiquement l’équivalent de 4 000 à 7 000 tonnes de “Black Mass” (10 000 à 20 000 tonnes batteries VE) issues du broyage & pré‐traitement de batteries de véhicules électriques afin d’en extraire les métaux stratégiques et les réintroduire dans les boucles industrielles de production. Ce projet engagé début 2022, démarrera industriellement au dernier trimestre 2023.
Vidéo de la conférence (durée : 29:35)
Retrouvez ici toutes les vidéos de ce colloque. Possibilité de les télécharger.
Source : Colloque Chimie, Recyclage et Economie circulaire, 8 novembre 2023
Ce sont près de 391Mt de polymères qui sont produits dans le monde (57Mt en Europe), polymères que l’on retrouve dans de très nombreux secteurs applicatifs : l’emballage (44%), la construction (18%), l’automobile (8%), l’électronique et électrotechnique (7%), l’habitat et les loisirs (7%), etc. [1]. Aussi, les polymères les plus largement utilisés sont les polyoléfines (PE, PP 53%), le polystyrène (PS 5,3%), les polyuréthanes (PUR 5,5%) et le polyéthylène téréphtalate (PET 6,2%).
Placer les polymères dans un contexte d’économie circulaire impose bien évidemment de reconsidérer certaines de leurs utilisations,notamment en recherchant une réduction de leur usage quand cela est possible, mais plus généralement d’assurer une plus grande circularité (notamment en s’intéressant à leur ré‐utilisation ‘matière’ et/ou par un retour à des briques élémentaires comme des monomères), leur conception (par exemple en leur conférant de multiples fonctions pour éviter des multimatériaux ou en considérant des composants différents comme ceux issus de ressources renouvelables) ainsi que leur durabilité (incluant leur réparabilité). Comme on peut le voir, toutes ces voies impliquent la chimie. Le recyclage est ainsi une des voies contribuant à la circularité des matières [2] et l’intégration des matériaux dans une démarche d’économie circulaire.
Même si les différents types de matériaux présents dans les gisements de déchets à recycler ont des spécificités quant aux méthodes d’extraction, de purification, de ré‐introduction, le même ensemble d’approches peuvent être déployées. C’est le cadre du Programme d’Equipements & de Projets de Recherche (PEPR) attaché à la Stratégie d’Accélération ‘Recyclage, Recyclabilité & Ré‐Utilisation des Matières’ opérée par France 2030 actuellement. Les axes de recherche de ce programme lancé pour les six années à venir pour cinq classes de matériaux (plastiques, métaux stratégiques, composites, textiles et papiers/cartons) mais aussi de manière systémique sur des filières (batteries, H2, éolien, photovoltaïque, DEEE, etc.) en impliquant l’ensemble des sciences (chimie bien entendu) seront exposés dans cette présentation.
Vidéo de la conférence (durée : 40:37)
Retrouvez ici toutes les vidéos de ce colloque. Possibilité de les télécharger.
Référence :
[1] Plastics‐ the Facts 2022. Plastics Europe. Oct. 2022, 81p.
Source : Colloque Chimie, Recyclage et Economie circulaire, 8 novembre 2023
La gestion des déchets est une priorité et une préoccupation majeure à l’échelle mondiale. Elle comporte de nombreux défis environnementaux, sociétaux et économiques. La santé publique et la préservation des ressources naturelles deviennent un enjeu de tous les instants.
En tant qu’industriel, spécialisé dans la gestion des déchets ménagers et assimilés et des activités économiques, il est de notre devoir d’apporter des solutions innovantes pour transformer ces déchets en ressources. Aussi, notre métier est de concevoir à la fois des systèmes de gestion des déchets adaptés aux besoins des zones urbaines et des campagnes, en utilisant des technologies intelligentes pour améliorer la collecte, le tri et le recyclage.
La réutilisation des résidus urbains issus des déchets ménagers incinérés, appelés mâchefers, après transformation et valorisation permet de préserver et réduire notre dépendance face aux ressources naturelles, par la récupération de métaux et la création d’un matériau alternatif comparables aux caractéristiques des matières premières naturelles.
C’est tout l’objectif que s’est fixé le groupe PIZZORNO Environnement, en développant une technologie de réutilisation du produit alternatif issus des mâchefers en l’intégrant dans le béton pour la fabrication de pavés biorecyclés. Ainsi, les déchets d’hier deviennent de véritables ressources de demain.
Vidéo de la conférence (durée : 21:34)
Retrouvez ici toutes les vidéos de ce colloque. Possibilité de les télécharger.
Texte : d’après la conférence de Hervé ANTONSANTI
Source : Colloque Chimie, Recyclage et Economie circulaire, 8 novembre 2023


