Jeudi 27 juin, se tenait à la Fondation de la maison de Chimie la finale du grand prix « les jeunes journalistes de la chimie ».
Les 3 binômes sélectionnés ont présenté au jury leurs vidéos et leurs articles traitant les thèmes suivants :
1. Comment les PHAs peuvent permettre à la France d’atteindre l’objectif zéro pollution plastique ?
Sarah Costes et Roméo Marmin – École publique de journalisme de Tours (EPJT)
2. L’utilisation des nouvelles techniques d’imagerie chimiques pour étudier les peintures archéologiques
Caroline Barathon et Cléa Dubray – École de journalisme de Grenoble (EJDG)
3. Décarbonation du ciment, se passer du clinker pour diminuer les émissions de CO2
Morgane Anneix et Juliette Laffont – École de journalisme Sciences Po Paris
Après délibération, le jury composé de journalistes de la presse écrite et télévisée, de scientifiques universitaires et industriels a décerné ce grand prix à Caroline Barathon et Cléa Dubray, qui ont concouru avec le sujet : « L’utilisation des nouvelles techniques d’imagerie chimiques pour étudier les peintures archéologiques ». Le grand prix a été remis par Philippe Goebel, Président de la Fondation de la Chimie.
Chaque étudiant finaliste fait partie désormais de l’AJSPI et tous se sont vu proposer un mentorat jusqu’à la fin de leur étude, leur permettant de bénéficier du réseau des experts scientifiques de la Fondation de la Maison de la Chimie.
L’article du binôme lauréat sera publié dans la page Science du Figaro. Les deux autres binômes seront coachés par les journalistes du jury pour améliorer leur article en vue d’une publication éventuelle.
Retrouver l’ensemble des productions du GPJJC2024 dont la vidéo et l’article lauréats 2024 sur Mediachimie :
https://www.mediachimie.org/content/grand-prix-des-jeunes-journalistes-de-la-chimie
Le concours sera reconduit en 2025. Quelques évolutions seront apportées dont notamment le dédoublement du grand prix « les jeunes journalistes de la chimie » en un grand prix qui récompensera le meilleur article produit et un grand prix destiné à la meilleure vidéo proposée par les binômes sectionnées.

Binôme lauréat du GPJJC 2024 : Caroline Barathon et Cléa Dubray

Jury et finalistes du GPJJC 2024
Parasport : les origines
La compétition sportive pour les personnes souffrant de handicaps physiques trouve son origine en 1948, lorsque le Dr. Guttmann, neurochirurgien britannique d’origine allemande, décide d'organiser les premiers « Jeux mondiaux des chaises-roulantes et des amputés », pour réinsérer psychologiquement ses patients paraplégiques, vétérans de la Seconde Guerre mondiale.
En 1952, cet événement prend une dimension internationale et, depuis les premiers Jeux paralympiques de 1960 qui se tiennent à Rome, une semaine après les J.O., les suivants se déroulent tous les 4 ans dans la ville choisie pour les Jeux olympiques.
Le handisport nécessite du matériel adapté, aussi bien pour les déplacements (prothèses de membres ou fauteuils roulants), que pour les accessoires spécifiques (sangles, ballons pour non-voyants, protections, etc.).
Les prothèses sont les dispositifs artificiels destinés à remplacer une partie amputée du corps, membre, portion de membre, articulation. Elles existent depuis l’Antiquité ! Jusque dans les années 1980, les athlètes handicapés ne portaient pas de prothèses spécifiques lors des compétitions sportives.
Par la suite, des prothèses spécialement conçues pour les parasports ont été développées. Elles doivent remplir plusieurs fonctions : légèreté, résistance mécanique, biocompatibilité, confort. Les matériaux et les conceptions utilisés dans les prothèses diffèrent selon le type de sport pratiqué.
Elles sont souvent faites sur mesure et privilégient l’efficacité plutôt que l’esthétique.
De quoi sont faites les prothèses des sportifs handicapés ?
Les prothèses des blessés de la Première Guerre mondiale étaient en bois et cuir ! Désormais elles se caractérisent par des matériaux aux propriétés différentes. Les métaux comme le titane, l’aluminium ou l’acier, sont utilisés pour leur résistance et leur légèreté (en réalité ce sont des alliages acier inox, nickel-titane, etc.). Mais de nouveaux matériaux ont fait leur apparition comme la fibre de carbone, le kevlar, la fibre de verre, les matériaux composites, les silicones, etc. et ils ont largement modifié les performances des athlètes handicapés.
Oscar Pistorius, champion paralympique et olympique sur 400 m, utilise des lames en fibre de carbone, jouant le rôle de pied et de mollet. Sa « flex foot » est inspirée de la jambe arrière du guépard, le plus rapide des animaux.
Herr Hugh, grimpeur de très haut niveau dans les années 80, a créé des jambes prothétiques lui permettant d'escalader à nouveau après son accident. Dans son cas, le pied est en titane.
Ces prothèses sont aujourd’hui largement utilisées et résument bien l’apport des matériaux nouveaux.
Exemple d’une prothèse de membre inférieur
Elle comporte 3 éléments : l’emboîture, le manchon, la prothèse (fig. 1).

Figure 1. Flex foot. Source Brevet national des collèges 2020
https://lewebpedagogique.com/technopp/archives/640
1 - L’emboîture relie la prothèse au moignon (membre amputé), elle est la base sur laquelle se fixent les éléments de la prothèse, elle permet l’appui au moignon et transmet l’énergie du corps vers le « membre artificiel ».
Elle peut être réalisée avec un matériau composite (i) appelé « carbone tubulaire ». Ce sont des fibres de carbone (ii) imprégnées de résine acrylique (iii).
D’autres composites sont formés avec du Kevlar (iv), des fibres de verres ou de carbone, tous biocompatibles, qui permettent l’allègement de la prothèse et un meilleur aérodynamisme.
L'emboîture est conçue sur mesure pour éviter tout mouvement du moignon dans l'emboîture.
2 - Le manchon est l’interface entre la peau et l’emboîture, il est destiné à protéger le membre.
Partie souple de la prothèse, il est le plus souvent en silicone (v), matériau choisi pour son élasticité, sa biocompatibilité, sa durabilité et sa capacité à réduire les frottements et les irritations. Des copolymères ou du polyuréthane sont aussi employés.
3 - La prothèse elle-même, pied, genou, jambe, main… ne supporte pas les mêmes efforts selon le sport pratiqué.
Les « lames de course » constituant les prothèses des coureurs à pied sont désormais majoritairement en fibre de carbone.
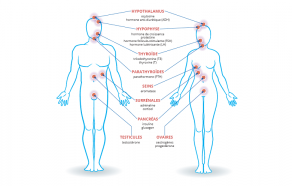
En fait, les fibres de carbone tissées sont imprégnées de résine époxy et c’est ce matériau composite qui possède un ensemble de propriétés remarquables (cf. tableau comparaison) :
- légèreté due à la très faible densité de 1,8
- résistance 10 fois supérieure à celles de l’acier, ce qui donne une résistance spécifique 50 fois supérieure à celle de l’acier (quotient résistance /densité) (résistance à la compression et la traction, flexibilité)
- tenue en température
- longévité, due à l’inertie chimique (sauf à l’oxydation).
La fibre de carbone contribue au renforcement de nombreux composites. Mais sa production est complexe (vi) et la rend très coûteuse. La réparation et le recyclage des pièces sont problématiques.
Les avancées et les perspectives
Aujourd’hui de nouveaux composants électroniques révolutionnent l’efficacité des prothèses pour compenser le handicap.
Les progrès les plus innovants résident dans les prothèses bioniques (fig. 2) dans lesquelles un (ou plusieurs) composant(s) est géré électroniquement pour reproduire au mieux le fonctionnement humain. (bionique est la contraction de biologique et électronique).

Figure 2. Main bionique https://fr.motorica.org/blog
Des capteurs et des composants, conducteurs ou semi-conducteurs électroniques, captent l’activité (contraction-énergie) des muscles du membre résiduel et la transmettent à la prothèse.
Dans ce domaine, le graphène et les nanotubes de carbone, nouvelles formes (allotropes) du carbone de découverte récente, sont très prometteurs. Le graphène (vii) est constitué d’un feuillet d’atomes de carbone disposés sur un réseau de type nid d’abeille. Sa résistance à la rupture est deux cents fois supérieure à celle de l'acier (tout en étant six fois plus léger).
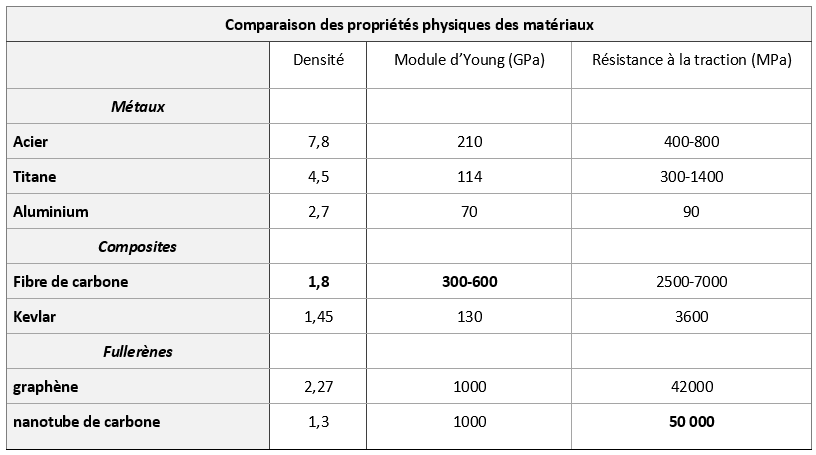
Un ou plusieurs feuillets peuvent s’enrouler pour former un nanotube de carbone (viii) (fig. 3).
Figure 3. Nanotube de carbone.
Source : Mstroeck. Licence CC BY-SA 3.0, Wikimedia Commons
Flexibles et ultra-résistants, les nanotubes de carbone peuvent, entre autres propriétés, transmettre les courants électriques du corps humain, grâce à leur comportement métallique ou semi-conducteur. Ainsi la présence de nanotubes de graphène a-t-elle permis (1) de fabriquer des mains prothétiques fonctionnelles capables d'interagir avec des écrans tactiles (utile pour les sports électroniques !).
En conclusion, le temps de la jambe de bois du pirate est bien révolu ! L'évolution scientifique et technologique des prothèses permet maintenant aux sportifs handisports de pratiquer leur discipline à haut niveau.
Dans certains cas, les avancées technologiques donnent des capacités accrues aux athlètes handicapés, au point que leurs performances peuvent égaler voire devancer celles des sportifs valides. Par exemple la prothèse permet à l'athlète une restitution d'énergie plutôt constante (et donc moins de fatigue pour l’athlète). La lame de carbone d’un sprinter, selon sa conception ou sa longueur, donne à l’athlète une foulée plus longue et transmet une énergie supérieure à celle des athlètes non amputés. Peut-on alors parler d’« athlètes augmentés par la technologie » ?
Des questions éthiques sur la participation de ces athlètes au côté d’athlètes valides dans les compétitions internationales (2) existent déjà. Toutefois, au cours de l’histoire de l’athlétisme paralympique, seuls quelques athlètes ont atteint les performances des athlètes valides…
Andrée Harari et l’équipe question du mois
(i) Les matériaux composites sont constitués de deux ou plusieurs composants dont les propriétés, différentes mais complémentaires, confèrent au composite des caractéristiques spécifiques.
Dans le cas présent ils présentent, pour l’application recherchée, les avantages suivants :
- résistance : le matériau supporte de nombreux chocs et pressions externes grâce au renfort des fibres de carbone,
- volume et masse plus faibles : allègement parfois considérable du produit final,
- durée de vie : du fait de sa résistance et sa relative inertie chimique, le matériau est durable.
(ii) La fibre de carbone est constituée de fibres extrêmement fines (5 à 10 microns de diamètre) d’atomes de carbone agglomérés en microcristaux. L’alignement des cristaux le long de l’axe de la fibre la rend très résistante. Plusieurs milliers de fibres de carbone sont enroulées ensemble pour faire un fil. Les fibres de carbone étant formées de domaines graphitiques, elles présentent les propriétés électriques du graphite.
Cependant les propriétés sont unidirectionnelles, (anisotropie). Ce n’est pas le cas des métaux qui sont capables de supporter des charges dans n’importe quelle direction (propriété isotrope).
(iii) Une résine acrylique est un polymère thermoplastique ou thermodurcissable obtenu à partir d'acide acrylique (H2C=CHCOOH), ou autres composés apparentés. Ses propriétés utiles sont la résistance mécanique, la biocompatibilité, la transparence.
(iv) Le Kevlar (nom commercial du poly(p-phénylènetéréphtalamide) (PPD-T) est un polymère thermoplastique constitué de noyaux aromatiques séparés par des groupes amide. Les liaisons hydrogène lui confèrent son exceptionnelle résistance spécifique (rapportée à la densité), supérieure à celle de l'acier, mais inférieure à celle des fibres de carbone.
Comme les autres fibres textiles, il ne fait pas partie des matières plastiques (fig. 5).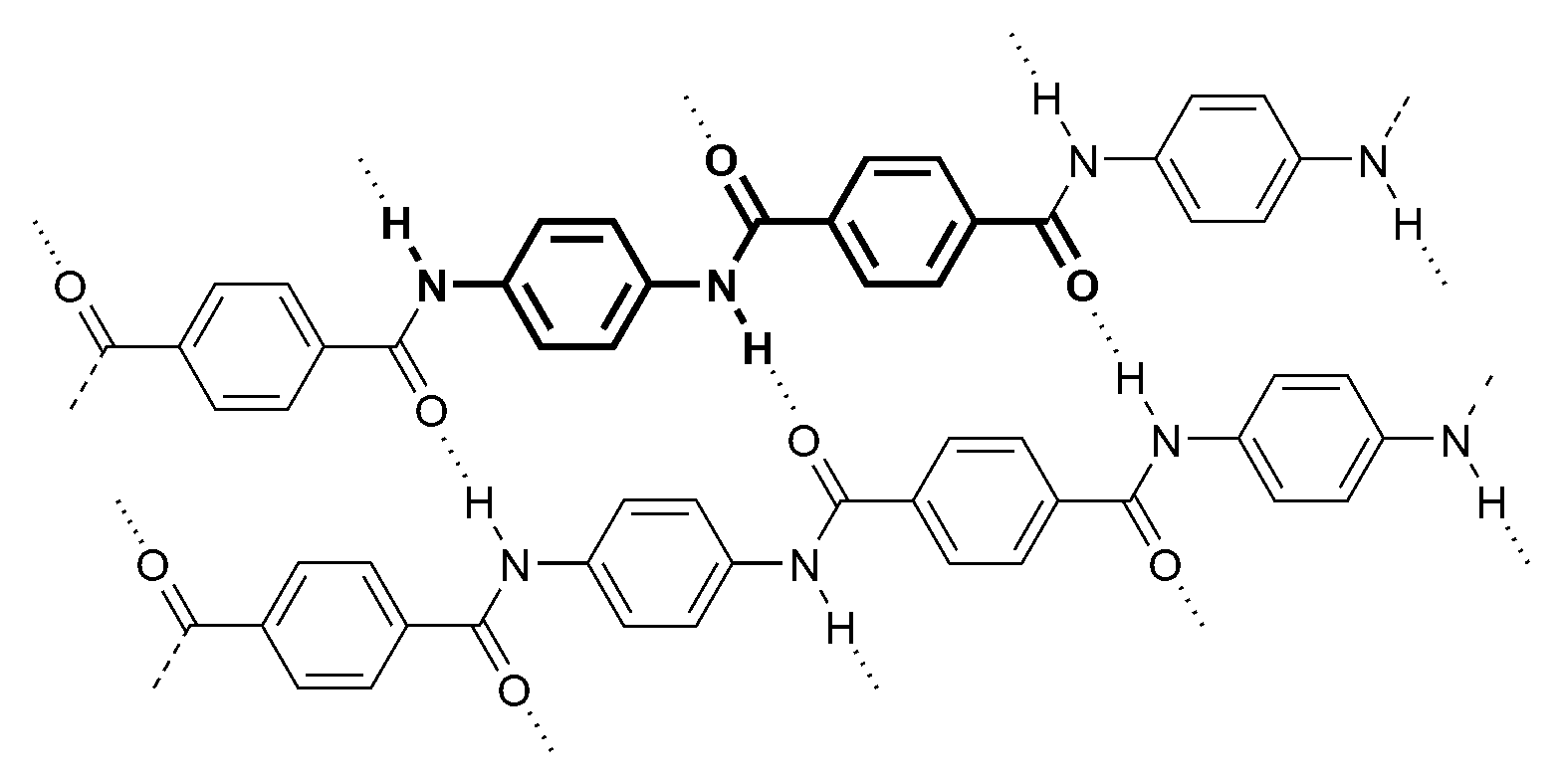
Structure du kevlar. Licence CC BY-SA 3.0, Wikimedia Commons
(v) Les silicones, ou polysiloxanes, sont des composés inorganiques (il n’y a pas d’atomes de carbone dans la chaîne principale) formés d'une chaîne silicium-oxygène dans laquelle des groupes se fixent sur les atomes de silicium. Le type le plus courant est le polydiméthylsiloxane linéaire (PDMS).
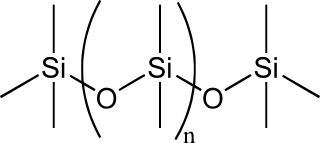
PDMS. licence CC BY-SA 3.0, Wikimedia Commons
Si l'on fait varier les chaînes, les groupes fixés et les liaisons entre chaînes, les silicones fournissent une grande variété de matériaux dont la consistance varie du liquide au plastique dur, en passant par le gel.
(vi) La fibre de carbone est fabriquée à partir des précurseurs comme :
- Les fibres de polyacrylonitrile (fibres de PAN de formule H2C=CH–C≡N). Ces dernières sont oxydées vers 200-300°C pendant une durée allant de 30 minutes à 3 heures et deviennent infusibles. Ces fibres sont ensuite carbonisées sous atmosphère inerte entre 1 000 °C et 1 500 °C pour éliminer les éléments H, N, et O. La graphitisation par un second traitement thermique à haute température (plus de 2 000 °C) améliore la structure des fibres.
- Le brai, goudron issu de distillation de résidus de pétrole ou de houille.
- La cellulose.
(vii) Le graphène est un composé bidimensionnel cristallin, identifié en 2004.
Cette forme de carbone, correspond à un feuillet unique de graphite, de réseau hexagonal, type nid d’abeille. Ses propriétés sont donc bidimensionnelles :
- résistance à la rupture deux cents fois supérieure à celle de l'acier (tout en étant six fois plus léger)
- exceptionnelles conductivités électrique et thermique
- durabilité

Structure du graphène. Domaine public, Wikimedia Commons
(viii) Un nanotube de carbone, observé pour la première fois en 1991 (4) (5), est une structure cristalline composée d'atomes de carbone qui peut être décrite comme un feuillet de graphène enroulé sur lui-même. C’est un tube creux, de diamètre interne d’environ un nanomètre (10-9 m) et d’une longueur de l'ordre de quelques microns.
Les nanotubes peuvent être mono-feuillet ou multi-feuillets. La structure d'un nanotube de carbone multi-feuillets correspond soit à plusieurs feuillets de graphène concentriques, soit à un seul feuillet de graphène enroulé sur lui-même de façon hélicoïdale.
Du point de vue électrique, les nanotubes mono-feuillets ont la particularité remarquable d’être soit métalliques (conducteurs) soit semi-conducteurs. En outre ils ont une excellente rigidité (mesurée par le module de Young), comparable à celle de l'acier et une extrême légèreté.
Références
(1) Nanotubes de graphène, sur le site Motorica (2021)
(2) Le sport augmenté, une révolution en marche à autoriser ?, Journée Transhumansime : de nouveaux droits, Mai 2021, Aix-en-Provence, France, M. Lahaye, V. Perkins, Ch. Charleux, G. Nicolas, V. Andrieu et A. Mahalatchimy, halshs-03406451v2
(3) Electric Field Effect in Atomically Thin Carbon Films K. S. Novoselov, A. K. Geim, S. V. Morozov et al., Science, vol. 306, n° 5696 (2004) p. 666–669
(4) Helical microtubules of graphitic carbon, S. Iijima, Nature, 354 (1991) p. 56-58.
(5) Who should be given the credit for the discovery of carbon nanotubes? M. Monthioux et V. L. Kuznetsov, Carbon, vol. 44, n°9 (2006) p. 1621-1623
Pour aller plus loin
* Les nouvelles prothèses Serge Lécolier, Revue Chimie Paris, n°338-339 (2012) p. 8-11
* Handicap et évolution scientifique et technologique : la prothèse dans le handisport (PDF) Comité Départemental Olympique et Sportif de l'Aisne, aisne.franceolympique.com
* Société Össur, fabricants de produits orthopédiques non invasifs
* Cours de physique du solide : les nanotubes de carbones (pdf) sur le site de l'Institut Rayonnement-Matière de Saclay (Iramis) - CEA
* Cette main bionique peut fonctionner plusieurs années, R. Fouchard, News de science (2023) sur le site des Techniques de l’Ingénieur
* Prothèses bioniques : retrouver les fonctions perdues, article réalisé avec M. Maier, de l'École des neurosciences (unité FR3636), CNRS - Université Paris Descartes, Site de la Fondation pour la Recherche Médicale
Crédit illustration : Championnats du monde d'athlétisme IPC 2013. 200 mètres féminin T44. De gauche à droite : Sophie Kamlish (GB), Marie-Amelie Le Fur (France), Marlou van Rhijn (Netherlands)
Fanny Schertzer, licence CC BY-SA 3.0, Wikimedia Commons
L’activité endocrinienne c’est la vie, la perturbation endocrinienne pose un problème.
Le système endocrinien est l'ensemble des glandes (dites « endocrines ») qui libèrent des hormones dans le sang : ovaires chez les femmes, testicules chez les hommes et pour tous, thyroïde et parathyroïdes, hypophyse, hypothalamus, pancréas (ilôts), glandes surrénales [...]
Accédez au Zoom sur les perturbations endocriniens
Crédit illustration : plateforme PEPPER
On ne sait pas comment est mort Philippidès après avoir parcouru les 42 km entre Marathon et Athènes pour annoncer la victoire sur les Perses, à bout de souffle ou les pieds meurtris, car il n’y avait dans l’Antiquité ni revêtement des chemins ni chaussures adaptées à la course. Depuis le renouveau des Jeux Olympiques on porte maintenant une grande attention non seulement aux athlètes et aux champions mais aussi à leur environnement stades, pistes de courses, accessoires sportifs (1). La piste d’athlétisme où sont courues la plupart des épreuves de sprint et de fond a une grande importance dans ces jeux.
Un peu d’histoire
En Europe c’est vers 1850 que les stades ont pris leur forme actuelle composée d’une piste oblongue, deux lignes droites et deux courbes les réunissant faisant environ 400 m ou 440 yards. Sur le modèle des jeux de la Grèce Antique qui à Olympie aux alentours de 800 ans av. J.-C. regroupaient les athlètes venant de toutes les régions sous domination grecque.
Au XIXe siècle et début du XXe les pistes étaient cendrées (on brulait pas mal de charbon à cette époque), composées de terre et de cendres et l’anneau de la piste était séparé en couloirs (6 à 9) pour les courses de sprint à l’aide de cordes suite à une contestation lors du 400 m aux jeux de 1908. Ces cordes assez gênantes entre compétiteurs voisins furent vite abandonnées au profit de marquages au sol à l’aide de peinture blanche ou de poudre blanche. Ces pistes grises cendrées favorisaient les chutes, dérapages et les blessures. Les revêtements furent remplacés progressivement par de l’herbe ou par de la brique pilée après 1930, ce qui va leur donner une teinte rouge orangée comme sur les terrains de tennis. La technique s’étant améliorée le terrain de la piste comprend plusieurs couches : des cailloux ou graviers – du mâchefer – du calcaire concassé – de la brique broyée finement le tout damé sur environ 6 cm.
Puis dans les années 1950 on arrive à remplacer le revêtement des routes par de l’asphalte (2) qui comprend du goudron issu de la distillation du charbon avec beaucoup d’hydrocarbures non saturés comme liant et un granulat de gravier. À cause de son caractère cancérigène le goudron sera progressivement remplacé par le bitume issu des fractions lourdes du pétrole comportant elles des hydrocarbures saturés. Les années 1960 montrent des pistes d’athlétisme nouvelles, avec un colorant rouge. Ces pistes bitumées (10% de bitume et 90% de granulat de tailles choisies) vont apporter un entretien facilité une porosité contrôlée pour l’évacuation des pluies et une durée améliorée. Mais elles seront vite détrônées.
Les pistes modernes
En 1959 le directeur de 3M du Minnesota passionné de course de chevaux souhaite une piste pour eux ménageant leurs muscles et évitant les blessures. 3M étant spécialisé dans les films plastiques, il teste alors un revêtement constitué d’élastomère et de caoutchouc dans un élevage de chevaux appelé « Tartan », le nom restera bien qu’il n’ait rien à voir avec un vêtement traditionnel écossais. Ce « ruban » s’avérera trop couteux pour les kilomètres de piste d’un hippodrome, aussi 3M le propose aux stades d’athlétisme. C’est ainsi que dès les Jeux de 1968 à Mexico une piste en Tartan « rouge » est inaugurée. Est-ce la qualité de la piste ou l’altitude à 2200 m qui entraine une exceptionnelle chute des records olympiques précédents ? Les deux sans doute (3).
Après, les pistes évolueront en épaisseur et en quantité de polyuréthane ainsi que leur couleur, bleue à Rio en 2016 pour améliorer la concentration et le calme des athlètes, rouge de nouveau à Tokyo au Japon pour mieux satisfaire les télévisions.
La piste à Tokyo en 2021 fabriquée sur mesure par l’entreprise italienne Mondo ne fait que 14 mm d’épaisseur. Au-dessous du polyuréthane sont disposés des granulés de caoutchouc en design hexagonal qui ménagent de petites poches d’air. La piste absorbe l’énergie des coureurs et la renvoie avec un effet « trampolino » dans le sens de la marche. Plusieurs coureurs ont dit qu’ils avaient l’impression de « courir sur de l’air » ou de « marcher sur des nuages » sur cette piste très rapide. Il faut dire aussi que les grands fabricants de chaussure de sprint ont fait des efforts. Les chaussures « miracles » ont une semelle élastique avec crampons disposés en hexagone doublée d’une semelle rigide en carbone, des couches de mousse en polyester et polyamide recouverts d’un tissu imper respirant de type « Gore-Tex ».
De plus les fabricants ont fait un réel effort de développement durable et par souci de l’environnement : les mousses de polyamides viennent d’un bioprocédé rendu célèbre par Arkema utilisant des graines de ricin (4) et leur expansion est faite par insufflation d’azote qui les garantit exemptes de CFC, HCFC ou COV (composés organiques volatils). Par ailleurs le principal fabricant a mis en place une chaine de recyclage (5).
La conjonction des chaussures et de la piste apporte un progrès sur les temps de course en sprint et en fond de l’ordre de 2 à 4% ce qui fait dire au roi du sprint Usain Bolt « avec ces chaussures je serais passé au 100 m sous les 9"50 ! ». Car entre 1912 et 2021 pour le 100 m on est passé de la cendrée au Tartan et de 10,6 à 9,58 secondes !
La piste de Paris
Pour les Jeux 2024 à Paris qui vous intéressent au plus haut point, c’est encore le stade de France qui sera doté d’une piste « Mondotrack EB » qui a nécessité 1000 rouleaux de polyéthylène et polyuréthane avec leur support caoutchouté d’épaisseur 15 mm déroulés sur la piste il a fallu 2 800 pots de colle et elle est de couleur violette ! Oui vous avez bien lu : Violette. Comme d’habitude la France se singularise, fini le rouge ou le bleu, c’est le violet, choisi pour apaiser les compétiteurs et peut être les politiques et faire plaisir aux caméramans de télévision. La piste sera en violet clair et les zones de service en violet plus sombre. De plus, obéissant aux tendances de « green washing », le fabricant a incorporé dans la charge minérale des coquilles de moules et d’huitres broyées (soit du calcaire ou carbonate de calcium) ce qui permet de dire qu’il y a pour cette piste au moins 50% de matériaux renouvelables bien mieux qu’à Londres (6). En principe la piste devrait être finie début juin et un premier gala est prévu pour essais le 25 juin.
Certains esprits chagrins ou radicaux avaient émis des réserves sur les granulats de caoutchouc utilisés pour les terrains de sports avec la crainte de libérer des HAP (hydrocarbures aromatiques polycycliques). On peut rappeler que les sprinters n’y passent que quelques secondes et sont donc peu exposés, mais plus sérieusement rappeler surtout que deux réglementations suivies par les fabricants sont impératives et protectrices. Le règlement CLP définit que pour que les granulats de caoutchoucs soient considérés sans danger, ils doivent rester en deçà de certains seuils spécifiques quant à la présence de substances classées dangereuses telles que certains HAP.
Le règlement REACH indique que seuls les granulats de caoutchoucs considérés sans danger sont autorisés pour la fabrication de terrains de sports.
Alors bons jeux, vibrez à Paris ou devant la télévision, la chimie (7) ne sera pas seulement présente sur les revêtements de piste mais sur les sautoirs, les courts, les terrains, les maillots, les prothèses partout pour les jeux olympiques et paralympiques.
Jean-Claude Bernier
Juin 2024
Pour en savoir plus :
(1) Chimie et Sports en cette année Olympique et Paralympique, Conférences du Colloque du 7 février 2024
(2) Les infrastructures de transport : les apports de la chimie dans les projets d’avenir, H. Van Damme, Colloque Chimie et Transports, avril 2013, Fondation de la Maison de la chimie
(3) Optimisation des performances, complexité des systèmes et confrontation aux limites J.-F. Toussaint, La chimie et le sport (EDP Sciences, 2011) isbn : 978-2-7598-0596-9, p. 45
(4) Comment faire des polyamides à partir d’huile de ricin ? Du ricin au Rilsan®, une réaction de polymérisation à la française, J.-P. Foulon, Réactions en un clin d’œil, Mediachimie.org
(5) Les matériaux au service de la performance de la chaussure, A. Lahutte, Conférence Chimie et Sports en cette année Olympique et Paralympique, février 2024, Fondation de la Maison de la Chimie
(6) Un stade plus écologique est-il possible ?, A. Harari, Question du mois, Mediachimie.org
(7) 2023-2024 : Sports et chimie, une sélection de ressources pour découvrir et comprendre pourquoi la chimie occupe une place si importante dans le domaine du sport de haut niveau (Mediachimie.org)
Crédit illustration : Visuel du stade de France / Paris2024.org
Les beaux jours approchent et vous voulez profiter de votre piscine. Il faut donc s’assurer que son eau est saine et propre à la baignade. Et vous allez faire de la chimie sans vous en rendre compte !
L’eau dans les piscines doit avoir les caractéristiques suivantes :
- abiotique, donc aucun organisme vivant (autre que les baigneurs !),
- limpide,
- non agressive pour les baigneurs.
Quels sont les organismes vivants concernés ? Il s'agit de microorganismes (bactéries, virus, champignons...) et d'algues. Pour lutter contre ces organismes, il est nécessaire de désinfecter l’eau par l’acide hypochloreux, ClOH.
Le traitement le plus rencontré utilise des « galets de chlore »
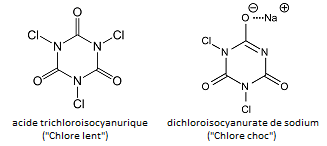
L’acide hypochloreux, ClOH, est généré in situ en introduisant des « galets de chlore » dit « lents » et « chocs » qui sont deux composés voisins, l’acide trichloroisocyanurique (TCU) et le dichloroisocyanurate de sodium (DCU) (i).
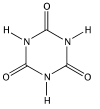
La réaction mise en jeu (par exemple pour le TCU) est : TCU + 3 H2O = 3 ClOH + acide isocyanurique (ii)
Dans les documents commerciaux, ClOH est surnommé « chlore actif ».
Le « chlore lent », peu soluble dans l’eau, permet une dissolution progressive du galet et donc une concentration faible et continue en ClOH. Pour une piscine de 55 m3, il faut deux galets de 250 g pour 7 à 10 jours.
Le « chlore choc » se dissout très rapidement permettant d’augmenter très vite, si nécessaire, la concentration en ClOH (en cas de problème d’algues ou à la sortie de l’hivernage, par exemple).
Il peut arriver qu’on observe une accumulation d’acide isocyanurique au cours du temps. Si sa concentration est trop élevée, les galets n’agissent plus. On dit alors que la piscine est « saturée ». À noter que l’acide isocyanurique est inoffensif pour la baignade (iii). Pour éviter la saturation il faut vidanger une partie de l’eau (environ 1/3) avant chaque hivernage, l’appoint sera apporté par l’eau de pluie avec éventuellement un peu d’eau du robinet.
Pour éliminer les algues, il faut ajouter des sels d’ammonium quaternaire, en combinaison avec du « chlore choc ». Un exemple de sel d’ammonium est donné en note (iv). La prolifération des algues, qui contribuent à une eau trouble et verdâtre ainsi qu’à des dépôts rendant les surfaces glissantes, est favorisée par la lumière, par une augmentation de la température et par une élévation du pH.
La régulation du pH, le plus proche de 7,2, est indispensable pour trois raisons.
- D’une part pour que l’eau ne soit pas agressive pour la peau, il faut que le pH soit compris entre 7,2 et 7,6.
- D’autre part, l’acide hypochloreux est en équilibre dans la solution avec les ions hypochlorite ClO-. Or le pouvoir destructeur des microorganismes de l’acide hypochloreux est environ 100 plus fort que celui des ions hypochlorite [1] et la teneur en acide hypochloreux chute de 66 % à 50 % lorsque le pH augmente de 7,2 à 7,5.
- Enfin il ne faut pas que le pH devienne trop acide car un dégagement de dichlore pourrait se produire (v). Ainsi, si le pH devient inférieur à 7,2, on ajoute du carbonate de sodium Na2CO3, appelé commercialement « pHplus ».
Pour avoir une eau limpide on ajoute du sulfate d’aluminium. Il permet d’agréger (vi) les particules en suspension et de faciliter la filtration ultérieure. Les galets commerciaux (environ 100 g) de ce composé sont enfermés dans un sachet non-tissé ayant l’apparence d’une chaussette. Un résidu gluant se forme dans la « chaussette » évitant d’encrasser les canalisations.
L’acide hypochloreux détruit les microorganismes mais se combine aussi aux composés organiques azotés tels que la sueur, les peaux mortes… que peuvent apporter les baigneurs et baigneuses, pour donner des chloramines ou des composés encore appelés « chlore combiné ». D’où la douche savonnée et le shampoing fortement recommandés en amont. Ces chloramines sont lacrymogènes, d’où la sensation d’avoir les yeux qui piquent, et ont une forte odeur attribuée par erreur « au chlore ». La consommation de ClOH par ces composés diminue la quantité de ClOH disponible pour éliminer les microroganismes. Si c’est le cas, il faut donc augmenter la concentration en acide hypochloreux.
Pour éliminer les chloramines il est nécessaire d’aérer et de renouveler partiellement l’eau de la piscine.
Le traitement par électrolyse
Il existe un autre mode de traitement des eaux de piscine, vendu sous les noms de « piscine au sel » ou « électrolyse au sel » ou « désinfection au sel ». Ce procédé est souvent présenté comme « plus écologique que le chlore » ou « traitement naturel donc plus écologique ». On lit aussi que ce procédé n’utilise pas de « chlore chimique » mais du « chlore naturel » !
Alors tout d’abord soyons clair, ce n’est pas le sel qui désinfecte l’eau de la piscine comme pourraient le faire croire certaines publicités, c’est toujours l’acide hypochloreux ClOH ou « chlore actif ». Et bien sûr c’est la même molécule chimique que celle obtenue avec les « galets de chlore ».
Comment ça marche ?
On introduit 3 à 6 g de chlorure de sodium (vii), NaCl, par litre d’eau de la piscine. Cette concentration est environ 6 à 11 fois moins concentrée que celle de l’eau de mer.
Un électrolyseur est un appareil présentant une cellule d’électrolyse comportant deux plaques en titane (ce sont les électrodes) et un système électrique permettant de créer une différence de potentiel constante (comme un générateur de courant continu). L'eau salée de la piscine est alors pompée à travers le système de filtration et acheminée jusqu'à la cellule d'électrolyse après être passée par les sondes d’analyses, le surpresseur et le réchauffeur. On crée une différence de potentiel (basse tension) entre les 2 électrodes ce qui provoque le passage d’un courant électrique qui va engendrer une réaction chimique à chacune des électrodes.
À l’anode il y a l’oxydation des ions chlorure en acide hypochloreux (viii). On a donc créé in situ le même composé qu’avec les « galets lents et chocs ». Il a bien sûr les mêmes propriétés de désinfection et d’élimination des microorganismes et des algues.
À la cathode, l’eau est réduite en dihydrogène (ix). Ce dihydrogène est entrainé dans le flux (on peut observer des bulles dans l’eau à proximité de la cellule d’électrolyse).
Donc l’électrolyse de l’eau salée a pour réaction globale : 2 H2O + Cl- → ClOH + H2 + OH-.
La réaction globale faisant apparaitre globalement des ions OH-, il est toujours indispensable, de contrôler le pH. Aussi les installations sont souvent proposées équipées d’un régulateur automatique de pH utilisant de l’acide sulfurique.
Lors de la réaction de ClOH sur les microorganismes, il est réduit en chlorure, Cl-, ce qui régénère le sel. C'est ainsi un cycle fermé.
Il faut toutefois surveiller régulièrement la concentration en sel et l’ajuster en cas de dilution par la pluie ou si l’eau de la piscine a été renouvelée ou s’il y a formation de chloramines qui consomment ClOH ce qui casse en partie ce cycle.
Les rayons ultraviolets (UV) provoquant une destruction photochimique de ClOH selon 2 ClOH → O2 + 2 H+ + 2 Cl-, cela rend plus difficile de maintenir le taux de « chlore actif » dans une piscine en plein air. Il faut donc aussi adapter la production par électrolyse au fait que la piscine soit couverte ou non.
L’état des électrodes joue un rôle important sur l’efficacité de la production de ClOH. En particulier leur durée de vie sera affectée si l’eau est très calcaire (ou dite « dure »). Les électrodes sont parfois proposées avec inversion de polarité possible pour alterner leur rôle d’anode ou de cathode et empêcher des dépôts de tartre (calcaire CaCO3).
Enfin le sel favorise la corrosion des installations, ce qui est à prendre en compte dans le coût d’entretien.
Françoise Brénon
(i) Le nom « acide trichloroisocyanurique » est impropre car ce n’est pas un acide. Son nom officiel est le 1,3,5-trichloro-1,3,5-triazinane-2,4,6-trione). Les formules développées sont :
(ii) L’acide iso cyanurique a pour formule développée
(iii) L'acide cyanurique est classé comme « essentiellement non toxique ». Seule donnée sur la toxicité de l’acide isocyanurique : néphrotoxique chez l’animal si ingéré en grande quantité https://reptox.cnesst.gouv.qc.ca/Pages/fiche-complete.aspx?no_produit=11965
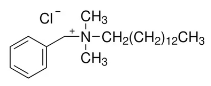
(iv) Exemple : Le chlorure de benzalkonium est un mélange de chlorures d’alkylbenzyldiméthylammonium, de formule générale [C6H5-N+(CH3)2CH2 R] Cl-, R représentant des radicaux « alkyl » de C8 à C18. Il est généralement répertorié dans la
littérature sous le numéro CAS n° 8001-54-5.
Exemple du plus couramment employé :
(v) Selon la réaction ClOH + Cl- + H+ → Cl2 + H2O. le dichlore formé est un gaz très toxique.
(vi) En effet si les particules sont très fines (< 20-40 µm) elles ne sont pas éliminées par le filtre à sable. Le phénomène en présence de sel d’aluminium est appelé floculation. Les ions Al3+ donnent un hydroxyde hydraté colloïdal Al(OH)3, x(H2O) agrégeant les particules en suspension, facilitant une filtration ultérieure.
(vii) Se reporter sur la notice du constructeur de l’appareil. Et on peut regarder des conseils en ligne.
(viii) Selon Cl- + H2O → ClOH + H+ + 2 électrons
(ix) Selon 2 H2O + 2 électrons → H2 + 2 OH-
Pour en savoir plus
[1] L'eau de Javel : sa chimie et son action biochimique, G. Durliat, J.L. Vignes et J.N. Joffin. BUP n° 792 (1997) pp. 451-469 et tout particulièrement pages 462-464 où est expliqué le rôle du pH et le pouvoir bactéricide de l’acide hypochloreux supérieur à celui des ions hypochlorite.
[2] Le traitement des eaux de piscine, collection Techno, Nathan (1987)
[3] Guide-piscine 2015, SIET, guide de bonnes pratiques, issu de travaux menés par l'ensemble des professionnels du traitement et de l'analyse des eaux de piscines. Concerne plus particulièrement les piscines collectives.
[4] Pour les piscines avec électrolyseurs on peut consulter les notices des constructeurs. Par exemple Distripool, ou Sterilor ou Dytech…
Crédit illustration : OceanProd / Adobe Stock
Le 71e congrès national annuel de l'Union des Professeurs de Physique et de Chimie se déroulera à Brest du 28 au 31 octobre 2024. Il se déroulera à la Faculté des sciences et techniques de l’Université de Bretagne occidentale (UBO) et à l’École nationale supérieure des techniques avancées Bretagne (ENSTA Bretagne).
Toutes les informations, les détails et les inscriptions sur https://udppc-brest2024.sciencesconf.org/
Ce congrès fera la part belle aux sciences et technologies de la mer. Des thèmes comme la problématique des nanoplastiques dans l’océan, la surveillance des océans depuis l’espace, le réchauffement climatique seront développés. Vous aurez l’occasion de visiter le premier marégraphe de France, les laboratoires du SHOM (Service hydrographique et océanographique de la marine), le bassin d’essai de l’IFREMER (Institut français de recherche pour l’exploitation de la mer), sans oublier la base navale militaire et les sous-marins nucléaires lanceurs d’engins basés à l’Île Longue.
Venez profiter des conférences plénières, ateliers et conférences à la carte, visites de laboratoires et d'entreprises, des exposants, du repas de gala, des visites touristiques…
Les40e Olympiades Nationales de la Chimie se sont déroulées à Paris les 14 et 15 mai sur le thème « Chimie et Sports ». 47 lycéens parmi plus de 3000 jeunes de toute la France et de lycées français de l’étranger ont participé aux épreuves finales. La Fondation de la Maison de la chimie, partenaire historique des ONC félicite les lauréats récompensés à l’issue des épreuves.
Tous les résultats sont sur le site des ONC.
Elle offre ses courbes et ses méandres à ceux qui veulent bien la voir le long des quais, du haut de certains monuments mais aussi en amont et en aval de la capitale.
Elle sera reine le 26 juillet car sur plus de 6 km elle accueillera plus de 10 500 athlètes, et offrira un spectacle à des milliers de spectateurs qui sans doute « en prendront plein les Jeux ». Au-delà du 26 juillet, elle sera le théâtre de compétitions de nage en eau libre, de l’épreuve de natation des triathlètes des Jeux Olympiques et Paralympiques de Paris 2024.
Mais tout ceci ne sera possible que si son eau est dépolluée, si les bactéries ont disparu pour rendre à ce fleuve l’honorabilité qui lui revient après les récurrentes promesses faites depuis plus de 20 ans par nos politiques.
La Seine sera sans doute sur le devant de la scène grâce à la chimie et à l’expertise de ces acteurs industriels qui s’intéressent à l’eau. Au-delà des Jeux, ce sujet est primordial, vital, parfois préoccupant car soit nous allons en manquer soit nous allons être confrontés à des zones fluviales ou autres étendues aquatiques polluées par des rejets industriels et humains.
Mediachimie.org s’intéresse à ces sujets depuis de nombreuses années et explore les avancées, les problématiques, les solutions apportées. Laissez-vous guider au fil de l’eau pour découvrir toutes ces ressources et comprendre, réfléchir et prendre conscience si ce n’est déjà le cas de ce sujet ESSENTIEL !
Jean Gomez
Quelques ressources à explorer sur le site www.mediachimie.org :
- L'eau, une ressource indispensable pour la ville, fiche Chimie et… en fiches
- La bataille de l'eau propre, chapitre de La chimie et la sécurité des personnes, des biens, de la santé et de l'environnement (collection Chimie et … Junior)
- L'eau : ses propriétés, ses ressources, sa purification, fiche pédagogique jeu Super Kimy
- H2O, la molécule vedette de l'été, actualité Mediachimie.org (09/2022)
Crédit illustration : Cérémonie d'ouverture, l'embarquement des athlètes, © Paris 2024 - Florian Hulleu
Les abeilles sont indispensables par le service qu'elles rendent à la pollinisation : sans leur présence, nous perdrions 70 % des espèces cultivées en Europe. Mais leur disparition est bien évidemment préjudiciable à la production du miel. La France ne produit que le tiers de ses besoins en miel qui sont de 40.000 tonnes/an. Elle est donc obligée d'en importer. Or le miel est un produit onéreux : il est donc tentant pour les fournisseurs de proposer des produits de moindre coût de revient en les présentant comme des miels de qualité et d'origine conformes. C'est ce qu'on appelle l'adultération du produit. Il est important de contrôler la qualité des miels sur notre marché (1) […]
Accédez au Zoom sur l'adultération du miel
Crédit illustration : Bernd Amann (20/06/2015)