Socle :
- Les systèmes naturels et les systèmes techniques (Expliquer l’impact de différentes activités humaines sur l’environnement)
- Les représentations du monde et de l’activité humaine (Analyser quelques enjeux du développement durable dans le contexte des sociétés étudiées)
Programme Cycle 4 :
- Identifier les sources, les transferts et les conversions d’énergie
- Établir un bilan énergétique pour un système simple
Source : D’après l’article Notre futur énergétique se décide aujourd’hui de Patrick Criqui publié dans l’ouvrage « Chimie et enjeux énergétiques », EDP Sciences, 2013, ISBN : 978-2-7598-0973-8
Socle :
- Les systèmes naturels et les systèmes techniques
- Les représentations du monde et de l’activité humaine
Programme Cycle 4 :
- Des signaux pour observer et communiquer (Propagation rectiligne de la lumière ; modèle du rayon lumineux ; sources de lumière)
Source : D’après l’article La fibre optique : Internet dans un grain de sable de Sébastien Février publié dans l’ouvrage « Chimie et technologies de l’information », EDP Sciences, 2014, ISBN : 978-2-7598-1184-7
Socle :
-Les systèmes naturels et les systèmes techniques
Programme Cycle 4 :
- Des signaux pour observer et communiquer (sources de lumière, découverte de différents types de rayonnement)
Source : D’après l’article Le vieillissement cutané : prévention et réparation de Philippe Piccerelle publié dans l’ouvrage « Chimie, dermo-cosmétique et beauté », EDP Sciences, 2017, ISBN : 978-2-7598-2077-1
Socle :
- Les systèmes naturels et les systèmes techniques
- Les représentations du monde et l'activité humaine
Programme cycle 4 :
- Décrire la constitution et les états de la matière
Source : D’après l’article La chimie de la glace : une archive de notre environnement passé de Michel Legrand publié dans l’ouvrage « Chimie et changement climatique », EDP Sciences, 2016, ISBN : 978-2-7598-2035-1
Programme Cycle 4 :
- Organisation et transformations de la matière
- L’énergie et ses conversions
Source : D’après l’article Biogaz : un avenir pour les déchets ménagers ? de Carole Leroux publié dans l’ouvrage « La chimie et l’habitat », EDP Sciences, 2011, ISBN : 978-2-7598-0642-3
 |
Des experts de la chimie analytique pour trancher des énigmes politico-scientifiques
|
Des experts de la chimie analytique pour trancher des énigmes politico-scientifiques
Rubrique(s) : Éditorial

La chimie bien involontairement est venue récemment sur le devant de la scène médiatique lors de deux événements. Le premier, le 4 mars lors de l’empoisonnement de l’ex espion russe Sergueï Skripal et de sa fille Julia sauvés in extremis à l’hôpital de Salisbury mais qui a ravivé les tensions entre Londres et Moscou. Le second, une attaque chimique qui se serait déroulée le 7 avril en Syrie dans la ville de Douma et qui a provoqué une riposte ciblée de la part des États-Unis, de la France et du Royaume-Uni. Dans les deux cas étaient soupçonnées des armes chimiques (1), peut-être un innervant, le Novitchok, en Angleterre et le chlore gazeux en Syrie. La chimie comme le nucléaire a souvent été détournée à des fins peu avouables pour en faire des armes, c’est son aspect le plus critiquable. La poudre noire, les explosifs, les bombes incendiaires existent depuis plus de 1500 ans, l’arme nucléaire et l’arme chimique sont plus récentes.
Il faut rappeler que les débuts de la guerre chimique remontent à la Grande Guerre de 1914-1918 (2). C’est en avril 1915 que les armées allemandes déploient 168 tonnes de chlore (Cl2 gazeux) au nord d’Ypres en Belgique. Le nuage vert dérive vers les tranchées occupées par les armées alliées sur sept kilomètres provoquant la panique mais, le nuage stagnant, la percée ne sera pas exploitée. C’est cet agent Cl2 qui semble être mis en cause lors de l’attaque de Douma par les armées syriennes. Il faut dire qu’après le chlore d’autres gaz ont été trouvés par les belligérants. Ce fut d’abord un autre suffocant le phosgène CCl2O, puis le gaz moutarde ou ypérite C4H8Cl2S (sulfure de 2,2'‑dichlorodiéthyle), non seulement suffocant mais aussi vésicant (3). L’imagination des militaires pour tuer leurs semblables est sans limite. Au cours du XXe siècle furent inventés les innervants neurotoxiques comme le tabun, le sarin et le VX de la famille des organophosphorés qui sont, à des degrés divers, inhibiteurs de la cholinestérase, un relaxant musculaire, et qui provoquent en quelques minutes après l’inhalation le blocage des muscles respiratoires (4).
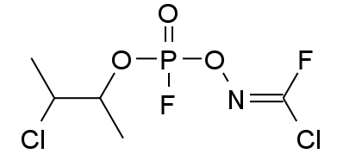
Les spécialistes de la chimie analytique ont montré que c’est un poison de ce type qui a frappé S. Skrispal et sa fille. Il semble bien après analyses qu’il s’agisse du Novitchok, issu d’un programme de développement soviétique appelé Foliant qui travestissait ces types de molécules en insecticides ! C’est encore un organophosphoré mais fluoré qui peut être fabriqué à partir d’acétonitrile et de phosphate organique. C’est un agent binaire qui se présente sous forme de poudre ultrafine pouvant être administré au moyen d’aérosol dispersif ou à l’état gazeux. Huit à dix fois plus toxique que le VX, une concentration de 0,01mg/kg dans le sang conduit à la mort (5). Ses antidotes sont de type anticholinergique, comme l’atropine qui peut être administrée avec des oximes telles que la galantamine qui renforce son action. Mais d’après les experts les séquelles, même si on en réchappe, peuvent conduire à des handicaps sévères et permanents.
En 1993, 192 États ont signé une convention sur l’interdiction de la mise au point, du stockage et de l’utilisation d’armes chimiques (la Syrie ne les a rejoints qu’en 2013 sous la pression). A été créé dans la foulée l’OIAC (Organisation pour l’interdiction des armes chimiques) qui a déjà supervisé en 2014 avec l’ONU la destruction des stocks de ces armes en Syrie (6). Ce sont à nouveau les chimistes de cette organisation qui sont sollicités pour résoudre ces énigmes et qui développent les moyens analytiques pour identifier les traces de ces composés à chaque demande d’expertise. Ces experts de l’identification des molécules sont sur place en Syrie pour vérifier que l’attaque sur Douma a fait l’objet d’utilisation d’armes chimiques. Hélas même s’ils identifient le chlore, sa fabrication et son stockage sont exempts de déclaration car cette molécule est utilisée dans l’industrie et l’agriculture (7).
Jean-Claude Bernier
Mai 2018
Pour en savoir plus
(1) Les gaz de combat
(2) 1914-1918 : la guerre chimique
(3) Il y a cent ans : la guerre chimique
(4) Qu’est-ce qu’une attaque chimique ?
(5) Chimie et poisons
(6) De la difficulté d’éliminer les « armes chimiques » de Syrie
(7) La chimie en agriculture : les tensions et les défis pour l’agronomie
Après un rapide rappel de la formation des planètes et les méthodes d’étude de leurs atmosphères (in situ et à distance grâce aux spectres continus thermiques, d’émission et d’absorption), la chimie réductrice des planètes géantes est exposée, suivie de la chimie des planètes telluriques (Vénus, Mars et Titan). Les équilibres chimiques sont expliqués, mais aussi les processus hors équilibre (photochimie, interactions surface-atmosphère, chimie des chocs par impact cométaire). C’est ce qu’on appelle la planétologie comparée.
Plus d'information sur la conférence sur le site de l'ESPCI Paris
Source : Vidéos des conférences expérimentales de l’espace Pierre-Gilles de Gennes – Canal U-TV - ESPGG - ESPCI Paris - Conférence du 5 décembre 2011
 |
La formulation et les matières premières : généralités
|
La formulation et les matières premières : généralités
Rubrique(s) : Zoom sur...

La formulation est l’art des mélanges et de leur stabilité et ne met pas en jeu de réactions chimiques. L’objectif final est d’obtenir un produit qui aura des propriétés fonctionnelles précises. L’aspect final de ce produit formulé est apparemment homogène à l’échelle macroscopique mais est en réalité hétérogène à l’échelle microscopique.
 |
La bonne chimie est-elle dans le bon dosage ?
|
La bonne chimie est-elle dans le bon dosage ?
Rubrique(s) : Question du mois

Le sucre, le botox et le scatol… les exemples sont nombreux.
« La voie du milieu est celle de l’illumination », disait la philosophie bouddhiste, alors que la civilisation hellénique enseignait que « l’excellence est dans la mesure ».
Le sucre qui fait vivre ou tue
Le taux normal de glycémie (sucre dans le sang, glyco=sucré et hème=sang), est situé entre 0,7 et 1,1 g/L, c'est-à-dire que la juste mesure du glucose circulant acceptable pour l’organisme d’un homme de 70 kilogrammes est l’équivalent d’environ un petit « carré » de sucre. Au-dessus c’est l’hyperglycémie et au-dessous c’est l’hypoglycémie. Dans les deux cas de figure, il s’agit de pathologies à surveiller de très près car leur évolution peut compromettre le pronostic vital d’un individu.
Le glucose (1), molécule simple, principal constituant du sucre alimentaire et de l’amidon chez les plantes ou du glycogène chez les animaux, appartient à la famille des glucides (carbohydrates) et sert de carburant primaire pour nos muscles et organes. C’est par exemple la nourriture quasi-exclusive du cerveau, ce qui dans le cas des hypoglycémies simples conduit à des malaises, des étourdissements voire des évanouissements.
En revanche son excès conduit à des pathologies de diabète qu’il faut savoir gérer au quotidien en fonction des cas. Les artères en commençant par les artérioles sont la cible privilégiée du glucose en excès qui souvent, en cas de non surveillance, conduit à une insuffisance rénale, et puis entre autres et progressivement, à des atteintes du cœur et du cerveau.
Dans le monde développé le diabète est la quatrième cause de décès chez l’homme.
Le Botox, une arme de guerre biologique devenue un outil de beauté et de bien-être
Il s’agit d’une toxine botulique secrétée par une bactérie appelée Clostidrium botulinum. Un millième de gramme (1mg) suffit pour tuer plus de 30 millions de souris, soit 1mg de toxine pour 600 tonnes de souris !
Cette toxine présente une neurotoxicité conduisant à la paralysie des muscles.
Il y a plusieurs types de toxines botuliques avec un effet plus ou moins toxique, mais il s’agit dans tous les cas d’une protéine possédant une action catalytique de type protéolytique (c’est-à-dire qu’elle coupe les protéines en morceaux). Du fait de ce mécanisme moléculaire, elle inhibe l’action d’un neuromédiateur (l’acétylcholine) en charge de tonifier les muscles. C’est grâce à cette propriété que des industriels ont osé (!) décider de l’utiliser par voie locale et à des concentrations infimes pour corriger les rides dites d’expression comme par exemple les fibres externes du muscle orbiculaire (rides dites de la patte d’oie).
Son utilisation pour des pathologies telles que le strabisme ou la transpiration excessive a aussi démontré son intérêt.
Le scatol : une odeur variable selon la concentration…
Le scatol (2) est une molécule d’indole légèrement modifiée par la présence d’un groupement méthyle supplémentaire sur la position 3.
Ses propriétés odorantes changent radicalement avec la concentration. À des concentrations élevées le scatol est responsable de l’odeur des matières fécales (d’où le nom de scatol dérivant du grec «scata », d’où le mot en français de scatologie) alors qu’à de faibles concentrations il est utilisé en parfumerie pour sa fragrance florale proche du jasmin et de la fleur d’oranger mais aussi pour son pouvoir contrastant et fixateur.
Il en est ainsi de nombreuses substances, naturelles ou de synthèse, qui ont des propriétés différentes selon la concentration. Elles peuvent également avoir plusieurs propriétés simultanément. C’est en particulier le cas des médicaments dont la propriété recherchée s’accompagne parfois d’effets secondaires pas toujours souhaitables, ce qui amène à la recherche du meilleur rapport bénéfice/risque lors d’une prescription qui tient compte de la dose et de la durée du traitement.
Alors comme disait Pascal, « la façon de donner la rose vaut autant que la rose… »
Constantin Agouridas et l’équipe Question du mois
(1) le glucose de formule brute C6H12O6 a pour formule semi-développée :
2) Le scatol ou scatole a pour formule :
Participer à FameLab jusqu'au 15/04/2018
Rubrique(s) : Événements

Organisé par le British Council en France, FameLab est un concours international de communication scientifique, gratuit et ouvert à toute personne exerçant une activité en rapport avec la science.
Le principe est simple :
Qui peut participer ?
Tout personne répondant aux critères suivants :
- Être âgé.e de plus de 18 ans ;
- Exercer une activité qui touche aux sciences (chercheur.e, étudiant.e, ingénieur.e, technicien.ne, enseignant.e dans le domaine des sciences, etc.) ;
- Résider ou étudier en France (toutes nationalités confondues).
» Critères d’éligibilité : https://www.britishcouncil.fr/famelab/participer/eligibilite
Comment participer ?
La sélection s’effectue en ligne : les candidat.e.s ont jusqu’au 15 avril 2018 pour soumettre une vidéo de leur présentation (d’une durée de 3 minutes).
» Soumettre sa candidature : https://www.britishcouncil.fr/famelab/participer/inscription