 |
La phytoremédiation des métaux lourds
|
La phytoremédiation des métaux lourds
Rubrique(s) : Zoom sur...

Certaines activités industrielles peuvent créer des pollutions de sols avec des éléments métalliques (ETM - Éléments Traces Métalliques). La phytoremédiation consiste à dépolluer les sols en utilisant des plantes susceptibles de fixer les métaux lourds, de survivre et aussi de se reproduire dans ces conditions a priori hostiles. Elle permet aussi de re-végétaliser des terrains.
 |
Et si le cobalt manquait... quel serait l'avenir des voitures électriques ?
|
Et si le cobalt manquait... quel serait l'avenir des voitures électriques ?
Rubrique(s) : Éditorial

La récente décision du régime de Kinshasa (RDC, république démocratique du Congo) de taxer les volumes d’extraction du cobalt (1) des sociétés minières non à 2 % mais à 10 % considérant que ce métal devient stratégique n’est pas sans incidence sur notre consommation. Le cobalt et ses sels sont utilisés pour les alliages spéciaux, les carbures des outils de coupe, les catalyseurs, les aimants (2) mais surtout en 2017 à plus de 50 % pour les batteries ion–lithium, alors que cette utilisation ne représentait que 10 % en 2010. Les milliards de smartphones, nos outils électroniques nomades et les gigantesques objectifs de véhicules électriques en sont responsables. En effet dans tous ces objets ou automobiles le fonctionnement électrique est assuré par des batteries stockant l’énergie qui sont majoritairement des batteries ion–lithium (3).
Dans ces systèmes électrochimiques (4), lors de la décharge le lithium perd un électron qui produit le courant dans le circuit extérieur, l’ion Li+ migre alors à travers l’électrolyte et s’intercale dans la cathode constituée de feuillets de LiCoO2 .C’est dire qu’à côté du lithium il y a dans chaque batterie une quantité non négligeable de cobalt. On estime que par kWh il faut environ 600 à 800 g de Li2CO3 et de l’ordre de 180 à 230 g de cobalt. Cette quantité peut baisser si on utilise des batteries de type Li(CoNi)O2 ou Li (MnCo)O2 ou encore Li(CoMnAl)O2 (5) et passer par exemple de 60 % à 20 % de la masse en sacrifiant un peu sur la charge maximum.
Même si la capacité massique des batteries a doublé en dix ans et si le prix du Kwh va être divisé par deux en cinq ans d’ici 2023, la demande des constructeurs automobiles devient très pressante (6). Des marques comme Tesla ou Volkswagen annoncent pour les millions de voitures à produire des besoins annuels de 100 GWh et 200 GWh respectivement après 2020, ce qui représenterait au total de l’ordre de 69 000 tonnes de cobalt à cette échéance, soit près de 70 % de la production mondiale 2016 ! La multiplication des « gigafactories » de piles électriques (7) devrait permettre à l'horizon 2020 de produire en un an plus de batteries que la production mondiale totale jusqu'en 2014 !
Pour faire face à cet emballement les grands constructeurs veulent assurer leurs approvisionnements et passent de méga contrats avec (Contemporary Amperex Technology), LG Chem, BYD Auto, Samsung… La Chine rachète à Glencore la mine de Tenke Fungurume en RDC pour plus de 2 milliards US $. Dans la foulée le cours du cobalt flambe, de 40 000$/t en 2017 il atteint 87 000 $/t au printemps 2018, et pourtant la production qui était de 62 000 tonnes en 2013 a presque doublé en 2017. C’est la RDC qui domine le marché avec une production de 64 000 tonnes en 2017 suivie dans l’ordre par la Chine, le Canada, la Russie…
La France, grâce à la Nouvelle-Calédonie, est dans le top 10 avec 3 500 tonnes.Cette position dominante de la République démocratique du Congo est assez critique. En dehors des conditions quasi esclavagistes de l’extraction minière, la situation politique du régime de Kinshasa, aux prises avec des rebelles, fait craindre, avec la mainmise de la Chine sur les approvisionnements, une situation de pénurie. Les prévisionnistes tablent sur une augmentation de la demande de 1930 %. Les électrochimistes (8) peuvent cependant dégonfler cette « bulle » avec de nouveaux systèmes, Li-FePO4, Na-ion, Zn-air, Na-S … qui n’exigent plus de cobalt mais ne sont pas encore sur le marché pour l’immédiat.
Jean-Claude Bernier
Mars 2018
Pour en savoir plus
(1) Le cobalt (produit du jour SCF)
(2) Les matériaux stratégiques pour l’énergie
(3) Meilleurs matériaux pour batteries à ions-Li. L’approche déductive et inductive de la chimie (video-conférence)
(4) Stocker l’énergie pour communiquer (Chimie et… junior)
(5) Lithium–ion : de nouvelles batteries antiaériennes ?
(6) Stockage de l’électricité : élément clé pour le déploiement des énergies renouvelables et du véhicule électrique
(7) Elon Musk au secours des énergies renouvelables
(8) Les accumulateurs électrochimiques pour les transports : Li-ion et nouvelles chimies
Colloque Chimie et Biologie de Synthèse - les vidéos sont en ligne !
Rubrique(s) : Événements

Le colloque " Chimie et Biologie de Synthèse " a eu lieu le 14 février 2018. Il a réuni près de 1000 participants. Retrouvez dès maintenant l'intégralité du colloque en vidéo.
Guyton de Morveau (1737-1816), avocat de Dijon, se passionnait pour la chimie. Il fut l’un des premiers convaincus de la justesse des théories de Lavoisier et l’un des fondateurs de l’École polytechnique. Il est l’auteur d’un Traité des moyens de désinfecter l’air.
En 1773, dit-il, l’hiver avait été si rigoureux que la terre était gelée à une grande profondeur, de sorte qu’on ne pouvait y creuser les tombes. Les cadavres, recouverts de chaux, furent entreposés dans les caves de l’église Saint-Médard. L’odeur devint bientôt si insupportable qu’il fallut fermer l’église. On avait en vain essayé des fumigations de vinaigre et allumé des brasiers sur lesquels on jetait différents parfums et des herbes odorantes. On sait aujourd’hui que l’odeur de cadavre est due à différentes amines volatiles, issues du catabolisme des protéines, prosaïquement dénommées cadavérine, putrescine, etc. Ayant remarqué que les vapeurs de chlorure d’hydrogène (HCl) et d’ammoniac (NH3) se combinent en chlorure d’ammonium, solide ionique inodore, Guyton en fit l’essai en grand le 6 mars. Du sel commun fut ajouté à de l’acide sulfurique concentré dans une grande cloche de verre renversée. La cloche fut placée sur un bain de cendres froides progressivement chauffées par un grand réchaud. Le chlorure d’hydrogène qui s’en dégageait se combinait avec les amines nauséabondes volatiles en composés solides. Le lendemain, après avoir aéré pour renouveler l’air, toute mauvaise odeur avait disparu. Quatre jours après l’église fut rendue au culte, selon lui, « sans danger et même sans inquiétude ».
Le procédé fut appliqué pour désinfecter l’air des hôpitaux militaires sous la Convention, le Directoire et le Premier Empire. Les destructeurs d’odeurs modernes visent toujours à limiter la diffusion des molécules malodorantes par transformation chimique (oxydation ou hydrogénation des huiles), adsorption (charbon actif) et encapsulation, par exemple.
cadaverine
En savoir plus :
- Quelques rencontres historiques entre la chimie et les sciences de la santé, Josette Fournier, L’Actualité chimique (janvier 2004) pp. 9-18
- Traité des moyens de désinfecter l’air, de prévenir la contagion et d’en arrêter les progrès, Guyton de Morveau
Au début du XIXe siècle, les chimistes se voient submergés par le nombre de nouvelles matières organiques qu’ils entreprennent de mieux connaitre. L’analyse progresse en particulier grâce à Gay-Lussac et Thenard, Berzelius et au tube à cinq boules que Liebig ne va pas tarder à mettre au point.
Provenant d’organismes vivants – les autres étaient dites inorganiques – ces matières étaient réputées ne pas pouvoir être préparées en laboratoire car elles requéraient, pour leur formation, le concours d’une force, d’un élan, spécifique du vivant : la force vitale.
En 1828, Friedrich Wöhler réalise la « synthèse » de l’urée, saluée par tous comme marquant un tournant décisif pour la science. Il a préparé ce que seule la nature (animale) avait jusqu’alors pu produire. Les matières issues du vivant sont donc régies par les mêmes lois, connues, de la chimie minérale et l’homme (le chimiste) devient une sorte de démiurge des temps modernes. Tel est du moins le point de vue de Bertelot.
Wöhler est tout à fait ravi d’avoir préparé cette substance, synthèse partielle à partir de composés dont il ne donne pas la provenance (isocyanate d’argent et sel d’ammoniac, ou isocyanate de plomb et ammonique liquide). Il n’en revient pas d’avoir préparé une substance artificielle qui a en tout point les propriétés de l’urée tellement étudiée par Proust et d’autres.
Voici comment Wôhler en parle à son ami Berzelius, dans sa lettre du 22 février 1828 : « Je devrais recevoir bientôt une lettre de toi, mais comment attendre davantage ? Je ne peux, pour ainsi dire pas retenir mes eaux chimiques… il me faut te le dire : je peux faire de l’urée sans avoir besoin de reins, qu’il soient d’animal, d’homme ou de chien. Le cyanate d’ammonium est de l’urée… »
Berzelius lui répond le 7 mars : « A la vérité, Herr Doktor a trouvé l’art d’accéder à l’immortalité. L’aluminium et l’urée artificielle, voilà deux choses tout à fait différentes et qui se suivent de si près ! Ce seront deux pierres précieuses enchâssées dans votre couronne de laurier. Et… si par hasard l’urée artificielle venait à manquer ? On pourra alors recourir au pot de chambre ! »
Le nom de Liebig est connu de tous, et même en France. Un chimiste, allemand, connu de tous ? C’est que la soupe Liebig existe toujours. Tout supermarché la vend. En fait, il s’agissait, à l’époque, d’extrait de viande.
La petite histoire raconte que Justus Liebig (1803-1873) avait un ami dont la petite fille ne mangeait plus et dépérissait à vue d’œil. Liebig, célèbre réformateur de la chimie organique moderne et fondateur de la chimie agricole, lui fit préparer un bouillon de viande très riche que la fillette accepta de prendre à petites doses. Elle recouvra la santé.
Il n’empêche. C’est le désir de lutter contre le gaspillage qui a animé nos premiers écolo-chimistes, qu’ils inventent des fosses à fumier, pour limiter la déperdition du pouvoir fertilisant des fumiers de ferme (Boussingault), ou qu’ils songent aux extraits de viande. En effet, dans les années 1860, les bœufs du Brésil et d’Uruguay étaient abattus pour leur seul cuir ! Une dizaine d’années plus tôt, Liebig, dans ses Lettres sur la Chimie, avait consacré de longues pages à vanter les qualités de l’extrait de viande qui réparerait bien mieux les forces épuisées des malades que ces bouillons d’os que l’on donne dans les hospices, à l’Hôtel-Dieu en particulier. « Des os de quatre bœufs, on pourrait réellement en créer un cinquième », disait d’Arcet, l’industriel qui construisait et installait les appareils extracteurs dans les grands établissements philanthropiques parisiens. Liebig avait combattu les tenants de la gélatine, qui n’a aucune valeur nutritive, et la controverse entre les plus grands chimistes de l’époque, sous la présidence de Magendie, avait occupé l’Académie des Sciences des dizaines d’années durant.
Giebert, qui s’occupait au départ de la construction de voies ferrées dans ces pays d’Amérique du Sud, fonde donc, avec l’accord de Liebig, la société Fray Bentos Giebert et Cie, qui prépare à partir de 1864 le fameux extrait de viande : une tonne de viande de bœuf donne vingt-cinq kilos d’extrait.
Giebert attribua à Liebig la fonction de Directeur de la société avec un revenu de 1000 livres par an, et une rétribution de 5000 Livres à condition que la société prenne le nom de Liebig ; sa gloire et son renom permettant de se placer sur le marché financier de Londres et de devenir la Liebig Extract of Meat Company.
En savoir plus
- La chimie du XVIIe au XIXe siècle à travers la vie de quatre chimistes, au sujet de De Nicolas Lemery à Adolphe Wurtz : Sur quelques ouvrages d’histoire de la chimie, Danièle Fauque, Revue d’histoire des sciences, Vol. 57, n°2 (2004) pp. 493-508
- La science et la technologie de l'alimentation vues par la chimie du bouillon, Hervé This
Conférence : De la terre à la bouteille, la science du vin
Rubrique(s) : Événements

La chimie jalonne la fabrication et le vieillissement du vin. Goût, santé, procédés… Quel est son impact exact ? Jusqu’où peut-on le maîtriser ? Emission en public le mercredi 21 mars, au foyer haut du Lieu Unique, 2 rue de la biscuiterie à Nantes, de 19h précises à 20h30, en direct sur Prun, puis en podcast sur le site labodessavoirs.fr
Le Labo des Savoirs : Site | Facebook
 |
Les marchands de peur ont encore frappé
|
Les marchands de peur ont encore frappé
Rubrique(s) : Éditorial

L’ONG Générations Futures a compilé les données d’échantillons de fruits et légumes analysés par la Direction générale de la concurrence, de la consommation et de la répression des fraudes (DGCCRF) prélevés dans les grandes surfaces et grossistes et en a fait l’annonce le 20 février. Cette annonce a été reprise à foison par les média écrits et audiovisuels avec les gros titres : « 75 % des fruits et 41% des légumes contaminés par des pesticides ». Nous qui essayions cinq légumes et fruits par jour dans une alimentation équilibrée nous en sommes tombés de nos marmites. Comme le dit un célèbre humoriste : « je ne peux plus manger de fruits et légumes à cause des pesticides, plus de viande car il y a des hormones, plus de poissons car ils contiennent des métaux lourds, il me reste de l’eau pour me nourrir encore faut-il qu’elle soit potable ! » (1).
Dans cette annonce pour faire le buzz on ne trouve pas de résultats chiffrés d’analyses ni de détails sur les protocoles, spécialement mal venue pour saper la confiance du consommateur envers les producteurs à l’heure du Salon de l’agriculture à Paris (2).
De quoi parle-t-on enfin ? On cite la limite maximale de résidu (LMR) pour les produits phytosanitaires (3), seuil maximal autorisé pour un aliment transformé ou non, elle est pour la plupart des pesticides fixée réglementairement à 0,1 mg/kg (0,1 partie par million - ppm). Cette valeur très basse, mesurable grâce aux progrès de la chimie analytique (4), notamment à la chromatographie couplée à la spectrométrie de masse (5), est fixée à partir de la DJA - Dose Journalière Admissible. Celle-ci est fixée avec une marge de sécurité d’un facteur 100 à 1000 à partir de la Dose Sans Effet (DSE) quantité maximale de substance pouvant être ingérée par un animal quotidiennement sans troubles physiologiques et exprimée en mg/kg de poids.
On passe donc de la DSE/1000 à la DJA (qui sont des éléments de toxicologie) puis à la DJA divisée encore par un facteur de sécurité pour donner la LMR qui s’exprime le plus souvent en fraction de ppm. Les média pilotés tous par le panurgisme ne devraient-ils pas faire un effort de réflexion et consulter des sources impartiales comme par exemple le dernier rapport de l’EFSA (European Food Safety Authority) (6). Paru en avril 2017 sur les résidus de pesticides des fruits et légumes prélevés chez les producteurs en 2015 il a concerné 84341 échantillons sur lesquels 220 pesticides ont fait l’objet d’analyses. 69 % des échantillons provenaient de l’Espace économique européen (EEE), 26 % de pays tiers et 5% d’origines non définies. 97% des échantillons étaient en dessous du niveau de résidu maximum (LMR) dont 55% étaient exempts de pesticides car en-dessous de la limite de détection qui est de quelques ppb (partie par milliard). Sur les 2,8% au-dessus de la limite seuls 1,6% excédaient nettement cette limite (1,2% se situant dans la marge d’erreur). Pour les analyses concernant les produits issus des pays tiers, 3,4% excédaient la marge réglementaire, l’EFSA note un progrès dans ce domaine puisqu’en 2012 ils étaient 7,5%.
Parmi les produits dénotant un excès de pesticide (les 1,6%) on trouve 3,4% des brocolis, 1,7% des raisins de table, 0,8% du poivre, 0,4% des aubergines, 0,3% des bananes, ce qui reste tout de même de 96,6% à 99,7% de ces légumes et fruits tout à fait sains et mangeables.
On est loin des annonces alarmistes du 20 février. L’organisation de l’EFSA s’appuyant sur un réseau de laboratoires de chimie analytique (7) agréés dans les pays européens permet d’avoir des indicateurs scientifiques fiables, elle est un élément clef de la sécurité des consommateurs européens. Le programme européen de surveillance permet de conclure : que les niveaux quantifiés de résidus de pesticides dans les principaux aliments consommés par les européens n’entrainent pas de risque significatif sur le long terme pour la santé des consommateurs.
Dans la perspective d’une agriculture raisonnée du 21e siècle et de renforcer la confiance, il est raisonnable d’envisager comme le gouvernement le souhaite non pas une disparition des ajouts de phytosanitaires mais une forte diminution et le développement de l’innovation pour la protection des plantes comme le pratique l’INRA et le CNRS en France en suivant plusieurs pistes :
- utiliser des prédateurs des ravageurs des cultures comme les larves de trichogrammes contre la pyrale du maïs et les coccinelles contre les pucerons ;
- mobiliser des bactéries et des champignons comme le bacillus thurigiensis ou des virus comme dans la carpovirusine développé par l’INRA ;
- disperser des médiateurs chimiques comme les phéromones (8) permettant la confusion sexuelle des insectes, très efficace pour la protection des vignobles ;
- le biocontrôle pour renforcer la résistance naturelle des plantes avec de nouvelles méthodes modifiant les gènes soit par croisement soit par des techniques (NPBT - new plant breeding techniques) comme le CrispR-Cas9 (9) ciblant le génome.
Reste l’agriculture biologique qui se développe avec un marché en 2017 de 7 milliards €, et une progression à deux chiffres en France. Elle ne représente encore que 5% des terres cultivables et 4,5% du marché alimentaire. A côté des prix excessifs pratiqués, l’EFSA demande à ce que les produits bio ne soient pas exempts des contrôles, en particulier sur les LMR. En effet, lors d’une récente étude, l’agence canadienne a trouvé plus de 40% des fruits et légumes bio contenant des pesticides, soit par un bruit de fond de sols précédemment traités ou de non-respect du cahier des charges de l’agriculture biologique.
Jean-Claude Bernier
Février 2018
Pour en savoir plus :
(1) L’eau du robinet est-elle polluée ?
(2) La chimie en agriculture : les tensions et les défis pour l’agrochimie
(3) Les produits phytopharmaceutiques pour une alimentation de qualité pour tous
(4) La chimie analytique au service de la toxicologie médico-légale
(5) Spectrométrie de masse (MS : mass spectrometry) (vidéo en anglais, 7:58)
(6) The 2015 European Union report on pesticide residues in food - European Food Safety Authority EFSA Journal (2017) 15(4):4791, 134 pp.
(7) Les chimistes au service de la sécurité des personnes, des biens, de la santé et de l’environnement
(8) Les phéromones et le cerveau des insectes
(9) Chimie et biologie de synthèse (colloque)
C’est la Bérézina ! Cette expression caractérise une situation désespérée ou une déroute complète, mais quel est son rapport avec les boutons ? C’est l’étain, un élément connu comme un métal tendre, ductile et malléable. Il se présente sous plusieurs formes allotropiques tout comme le carbone (graphite/diamant). L’une d’elles, forme β ou étain blanc, est stable au dessus de 13 °C avec une forte densité (7,27), tandis que la forme α ou étain gris moins dense (5,77) se forme en dessous de 13°C. Lorsque de l’étain blanc est brutalement refroidi son réseau cristallin est ébranlé et les objets en étain pur tombent en poussière. Cette transformation est d’autant plus rapide que la température est basse et en dessous de −40 °C il devient très rapidement pulvérulent. C'est la «peste de l'étain» qui a été observée lors d’hivers rudes. L’addition de petites quantités de bismuth ou d’antimoine à l’étain empêche ce phénomène.
L’étain blanc était utilisé pour fabriquer les boutons des tenues de la Grande Armée de Napoléon. Au cours de la retraite de Russie fin novembre 1812, les troupes ont dû traverser la Bérézina, rivière de Biélorussie large d'une centaine de mètres et profonde de deux à trois mètres. La température a atteint -39 °C et les boutons en étain des pantalons des soldats de Napoléon ont explosé. Les soldats ne pouvaient donc plus combattre correctement ou mourraient de froid à cause de la désintégration de leurs vêtements.
Mais l’étain n’était pas la seule cause de cette tragédie, car outre le froid, les combats, la famine et la maladie ont causé aux soldats de terribles souffrances et la mort. Certains ont même posé la question : la Grande Armée avait-elle réellement des boutons en étain ? La réponse documentée est oui pour au moins une partie des soldats français comme russes. Mais dans les fosses communes de soldats à Vilnius on retrouve des boutons en laiton, pas en étain et au mieux des boutons en bois recouvert d'une tôle d'étain. Donc, au pire, une partie des soldats risquaient d'avoir des boutons moches... Pour finir, malgré cette débâcle, la bataille de la Bérézina est considérée comme une victoire de Napoléon grâce aux efforts héroïques du Maréchal Ney.

Le maréchal Ney soutenant l'arrière-garde pendant la Retraite de Russie Adolphe Yvon (1856)
Manchester Art Gallery. Wikipedia
En savoir plus :
- Dictionnaire des corps purs simples de la chimie - Éléments, atomes et molécules. Robert Luft Cultures et Techniques, 1997
- Le dernier chimiste à Paris, et autres excursions historiques dans le tableau périodique des éléments, Lars Öhrström, EDP Sciences (2016)
- 1812 Souvenirs d'un médecin de la Grande Armée, Heinrich von Roos (Trad. Mme Lamotte) Perrin et Cie, Paris (1913)
- Napoleon's Buttons: How 17 Molecules Changed History, Penny Le Couteur et Jay Burreson, Jeremy P. Tarcher Ed. (2004)
- Étain, produit du jour, Société chimique de France
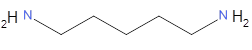
En novembre 1850, en Belgique, au château de Bitremont, meurt d’apoplexie Gustave, Adolphe, Joseph Fougnies, le beau-frère du propriétaire Hippolyte Visart de Bocarmé (1818-1851). L'enquête montre que Bocarmé avait suivi, sous le faux nom de Bérant, des cours de chimie à l'école industrielle de Gand, afin d’apprendre à extraire l'huile essentielle du tabac. Il avait obtenu de la nicotine pure.
De retour chez lui, Bocarmé prépare en grande quantité ce poison. Il étudie les effets sur des animaux. Cette mort ne semble pas naturelle et la justice charge Jean-Servais Stas (1813-1891), chimiste belge, de l’expertise chimique. Il montre que la mort est due à un empoisonnement et il termine son rapport en disant : « je conclus qu'il y a eu chez le défunt ingestion de matières vénéneuses. Ces matières sont de la NICOTINE, alcali organique existant dans le tabac, et un des poisons les plus violents connus. » Sa méthode d’identification des alcaloïdes est restée pratiquement la même de nos jours. La méthode mise au point par Stas pour la recherche de la nicotine est valable pour tous les alcaloïdes. Une partie des viscères divisés en morceaux est traitée par l'alcool additionné d'acide tartrique ; les alcaloïdes entrent en dissolution. Puis la solution alcoolique est évaporée, le résidu est épuisé par l'éther, en présence d’hydrogénocarbonate de sodium. Les résidus laissés par l'évaporation de l'éther sont purifiés et soumis à l'action de divers réactifs propres à déceler les alcaloïdes toxiques. Cette méthode est complétée par une expérimentation physiologique sur des animaux. Bocarmé est reconnu coupable et est guillotiné en place publique à Mons (Belgique) en juillet 1851.
En savoir plus :
- Le chimiste belge Jean Servais Stas (1813-1891), Pol Martefani
- Références de documents écrits par Jean-Servais Stas (1813-1891)
- Le premier empoisonnement criminel par la nicotine, L. Kauffeisen, Revue d'histoire de la pharmacie, 20ᵉ année, n°80 (1932) pp. 161-169
