L’ion permanganate MnO4- est un très bon oxydant participant à de nombreuses réactions d’oxydoréduction. En solution aqueuse, ce composé donne une teinte allant du rose au violet en fonction de sa concentration. Cette coloration en fait un réactif apprécié lors des titrages colorimétriques.
Première générale - Enseignement de spécialité
Objectifs : Apprendre les notions essentielles dans l’écriture d’une équation de réaction d’oxydoréduction.
Se familiariser avec les notions de titrage, d’espèce titrante et titrée, d’équivalence.
Constitution et transformations de la matière
Thème 1 - Suivi de l’évolution d’un système, siège d’une transformation
Partie B : Suivi et modélisation de l’évolution d’un système chimiques.
Partie C : Détermination d’une quantité de matière grâce à une transformation chimique.
Notions et contenus : Couple oxydant/réducteur. Équation de réaction d’oxydoréduction. Titrage avec suivi colorimétrique. Relation entre quantité de matière des réactifs à l’équivalence. Relation entre concentration massique et molaire.
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
L’eau est indispensable à la vie. Sans elle, il n’y aurait aucune vie possible sur Terre. Le constat est simple, tous les êtres vivants ont besoin d’eau pour exister.
Notre corps est constitué d’environ 65 % d’eau, c’est dire toute son importance : une perte de 10 % entraîne des troubles graves, voire la mort, si ce pourcentage atteint 20 %.
La croissance démographique et l’agriculture sont les pressions les plus importantes sur la ressource en eau. La pollution, liée à une démographie galopante, constitue une menace pour la santé publique, les espèces sauvages ainsi que pour les sources de revenu comme la pêche et le tourisme.
Comment définir une eau potable ? Quels sont les moyens pour rendre une eau potable ou pour éviter sa pollution ?
Première ST2S
Objectifs : Savoir définir une eau potable et connaitre les différents polluants des eaux.
Connaître les différentes sources de pollution, et les moyens mis en jeu pour la limiter.
Thème 3 - Faire des choix autonomes et responsables
Partie - La gestion responsable des ressources naturelles pour l’alimentation humaine
Notions et contenus : Critères chimiques de potabilité d’une eau. Origines de la pollution de l’eau.
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
La contribution de la chimie aux technologies de l’information, bien que cachée, leur est pourtant essentielle et participe activement à leur essor. La chimie est intimement liée à l’industrie de l’électronique et aux nouvelles technologies. Toute l’industrie chimique s’attache à élaborer des produits toujours plus purs, toujours plus robustes, toujours plus performants et toujours plus innovants pour des applications qui sont toujours plus exigeantes.
Première générale - Enseignement de spécialité
Objectifs : Comprendre le phénomène de la perception des couleurs.
Étudier comment produire et modifier une couleur.
Ondes et signaux
Thème - La lumière : images et couleurs, modèles ondulatoire et particulaire
Partie - Images et couleurs
Notions et contenus : Interpréter la couleur perçue d’un objet à partir de celle de la lumière incidente ainsi que des phénomènes d’absorption, de diffusion et de transmission. Prévoir le résultat de la superposition de lumières colorées et l’effet d’un ou plusieurs filtres colorés sur une lumière incidente.
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
Au cours de sa carrière Joseph Gay-Lussac (1778-1850), chimiste et physicien, s’est intéressé à une multitude de sujets, toujours avec un grand succès : loi sur les combinaisons des gaz en volumes, loi sur leur dilatation avec la température, co-découverte d’éléments (bore, iode), études sur le salpêtre et la fabrication de la poudre à canon pour en superviser la fabrication et en contrôler la qualité... avec un intérêt croissant pour la recherche appliquée.
Il est ainsi le créateur du degré Gay-Lussac. Mais qu’est-ce qu’un degré Gay-Lussac (°GL) ? Au début du XIXe siècle la classification de la teneur en alcool des vins et spiritueux, était peu claire, voire arbitraire, bien que cela était important pour appliquer les taxes. On utilisait des méthodes très imprécises, telles que tremper un chiffon dans la solution alcoolique et voir s’il prenait feu ! Or l’intérêt commercial demandait un moyen simple et précis d’estimer la teneur en alcool. C’est aussi important de connaître le degré de pureté de l’alcool, car son mélange avec l’eau modifie la sélectivité de son action dissolvante.
En 1821, à la demande de l’administration et sous l’égide de l’Académie des sciences, Gay-Lussac entreprend une longue et méticuleuse étude sur la relation entre la densité et la concentration en alcool dans l’eau. D’abord, il déshydrate l’alcool en le faisant passer sur de la chaux vive. Il trouve comme densité de l’alcool pur à 15°C : 0,7947. Puis il réalise avec soin 21 mélanges d’eau et d’alcool dans des proportions précises en déterminant le poids de chaque volume. Les mesures sont faites à différentes températures, tous les six degrés entre 0 et 30°C. Arago rapporte que ce travail a pris à Gay-Lussac plus de 6 mois. Il se fait aider par un élève de l’École polytechnique, Charles-Félix Collardeau-Duheaume (1796-1869) devenu par la suite fabricant d’instruments.
Gay-Lussac imagina ainsi l’alcoomètre centésimal : c’est une sorte d’aréomètre* à poids constant qui porte une échelle graduée en cent degrés d’alcool, dont chaque graduation représente un centième d’alcool (fig. 1 & 2). Autrement dit 1 degré GL (°GL) correspond à 1% d’alcool dans de l’eau. Il communique à l’Académie des sciences le 3 juin 1822 un rapport qui conduit la docte assemblée à la conclusion suivante : « On voit que M. Gay-Lussac a traité la question de l’aérométrie sous toutes ses faces et avec son habileté accoutumée. Les tables qu’il a déduites d’un travail pénible de plus de six mois seront pour l’Industrie et pour la science une précieuse acquisition. L’autorité trouvera aussi suivant son vœu les moyens d’améliorer et de simplifier la perception de l’impôt ». Son rapport est adopté et il en résulte une nouvelle législation fondée sur le système Gay-Lussac : la nouvelle loi sur les vins et spiritueux est signée par Louis XVIII le 24 juin 1824.
Ces aréomètres sont fabriqués avec Collardeau et en 1824 commercialisés 3 rue de la Cerisaie à Paris où l’appareil coûte 5 francs.
Aujourd’hui, l’échelle de Gay-Lussac est plus utilisée que son appareil !

Fig. 1 : Manuel d’instruction pour l’utilisation de l’alcoomètre de Gay-Lussac.

Fig. 2: Alcoomètres fabriqués par Gay-Lussac et donnés au chimiste E. Chevreul comme indiqué sur la boîte
(Photos de l’auteur, MNHN)
* Un aréomètre est un appareil, muni d’un cylindre creux, lesté et gradué, qui s’enfonce plus ou moins dans le liquide, dont on veut déterminer la masse volumique, en fonction de la poussée d’Archimède que le liquide exerce.
Pour en savoir plus
- La vie émouvante de Gay-Lussac, Edmond Blanc et Léon Delhoume (Imprimerie nouvelle, Limoges 1950) disponible sur Gallica
- Gay-Lussac, savant et bourgeois, Maurice Crosland (Editions Belin, Paris 1992) p. 271-274
- Séance du 3 juin 1822, Gay-Lussac, Comptes-rendus de l'Académie des sciences
- Gay-Lussac : Sur la combinaison des substances gazeuses, les unes avec les autres, Pierre Radvanyi, Bibnum, Chimie
- La contribution de Gay-Lussac dans l’émergence de la chimie organique, Sacha Tomic, Bulletin de la Sabix 20 (2012) p. 61-78
À la fois ludique et pédagogique, cette vidéo permet d’observer les phénomènes lors de mélanges de liquides. Sont-ils miscibles ou non ? Comment se répartissent-ils dans le récipient et pourquoi ? Quels sont les interactions à l’échelle moléculaire ?
Fort(e)s de ces découvertes, à vous de réaliser un cocktail multicolore ou de reproduire l’expérience de Marie Curie. Toutes les expériences sont reproductibles dans une cuisine.
Organisation de la vidéo :
- 0:50 : Miscibilité, non miscibilité et densité
- 4:45 : Cocktail 3 étages consommable
- 6:00 : Cocktail 5 étages non consommable
- 7:15 : Manip de Marie Curie pour ses filles
- 9:30 : Interactions intermoléculaires
- 11:30 : Conclusion et remerciements
En 1856, le jeune William Perkin âgé de 18 ans étudie la chimie au Royal College of Chemistry de Londres sous la direction d’August Wilhelm von Hofmann (1818-1892), chimiste organicien expert en goudron de houille. Von Hofmann, élève de Justus Liebig (1803-1873) à Giessen, avait été recruté en 1845 comme directeur d’une nouvelle école de chimie pratique à Londres sous l’égide du Royal College of Chemistry. Ses recherches sur le goudron de houille, puis sur le gaz de ville (ou naphta) l’avaient conduit à découvrir l’aniline.
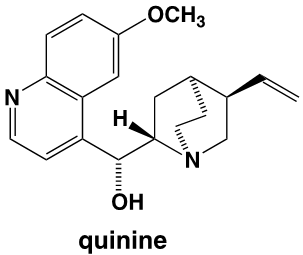
Dans ses mémoires, William Perkin explique que, en réponse à un concours lancé par Hofmann, il a effectué des recherches pendant les vacances de Pâques, dans son petit laboratoire personnel. Son projet était de réaliser la synthèse de la quinine dont la structure moléculaire n’était pas alors connue, avec pour objectif de « combattre le paludisme qui touchait les troupes qui défendaient aux Indes l’honneur britannique ». Perkin précise : « Après plusieurs essais j’en arrivais à oxyder un dérivé de l’aniline, la N-allyl-toluidine ». Car pour obtenir la quinine, il pensait qu’on pouvait y arriver par l’oxydation de deux molécules de N-allyl-toluidine. C’est ce qui pouvait être imaginé, sur la base des formules brutes, en comptant le nombre des atomes des molécules avant et après l’oxydation prévue. Les formules développées n’étaient pas alors connues, mais les formules brutes l’étaient. Pour le jeune Perkin, l’oxydation de la N-allyl-toluidine (C10H13N) était supposée former la quinine (C20H24N2O2) selon l’équation :
2 C10H13N + 3O -> C20H24N2O2 +H2O
Mais les structures développées du produit obtenu et de la quinine n’ont aucun rapport.
Cependant, lorsque Perkin a fait cette réaction avec du dichromate de potassium, il n’a obtenu qu’une boue brunâtre irrécupérable qu’il dut mettre à l’évier. C’est alors qu’il refait la réaction en oxydant par du bichromate de potassium de l’aniline contenant comme impuretés des α- et β-toluidines. Il décrit ainsi sa découverte : « J’obtins vite un splendide précipité rouge brun. Bien sûr, ce composé n’avait rien à voir avec la quinine artificielle que je recherchais, mais il éveilla ma curiosité de chimiste, car ayant renversé une petite éprouvette, je vis qu’il produisait sur le parquet et sur ma blouse des tâches certes de belle couleur, mais surtout indélébiles. Sans le savoir je venais d’inventer ce colorant de bonne tenue dont l’industrie textile avait tant besoin ».
De la pâte goudronneuse obtenue, il extrait par de l’éthanol une solution violette colorée par une substance qu’il nomme mauvéine.
De nos jours nous connaissons les formules développées de tous ces composés.
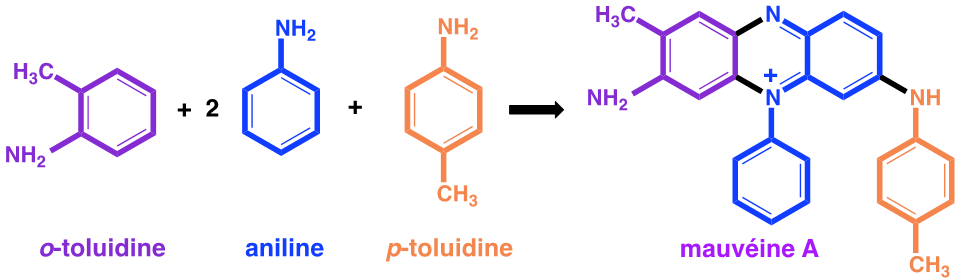
Figure 1 : Synthèse de la mauvéine A
On constate que la structure de la mauvéine ne ressemble pas du tout à celle de la quinine dont la formule est :
Les colorants naturels étaient très coûteux et difficiles à obtenir. C’est sur le conseil de sa femme qu’il donnera le nom de mauvéine à cette couleur en référence à la fleur « mauve (Malva sylvestris) ». Perkin dépose un brevet le 26 août 1856, démissionne de la Royal Society of Chemistry contre l’avis d’Hofmann et mobilise sa famille pour fonder avec son père et son frère une entreprise à Greenford dans la banlieue de Londres pour développer son invention. Elle a marqué la naissance de l’industrie chimique organique. Il lui faudra perfectionner sa fabrication, stabiliser la fixation du colorant sur les tissus et rendre le prix attractif. La concurrence des teinturiers étrangers dont les lyonnais qui apprennent en 1857 l’arrivée de ce nouveau produit sera rude, et surtout va susciter de nombreuses contrefaçons en Europe où le brevet anglais ne s’appliquait pas. Pour Perkin, qui a une longueur d’avance sur les autres chimistes, le succès sera éclatant. Par ailleurs, à partir des années 1860-1870, les chimistes allemands créeront une puissante industrie de matières colorantes, en particulier la Badische Anilin und Soda Fabrik (BASF).
Très rapidement la couleur mauve devient à la mode dans toute l’Europe et une véritable fureur va en effet s’en emparer. En 1862, la reine Victoria apparut à l’Exposition internationale de Londres dans une robe en soie teinte en mauve par le colorant de Perkin et porte cette couleur dans toutes les grandes occasions. À Paris l’impératrice Eugénie s’en entiche et porte aussi des robes mauves. Ce sera la couleur du timbre anglais de 2 pence en 1882.
Perkin se retire des affaires en 1874 à 36 ans. Il continue ensuite des recherches en chimie organique, découvre la « réaction de Perkin » qui lui permet de réaliser la synthèse de coumarines, à la base de l’industrie des parfums synthétiques. Il publie environ 60 articles, principalement dans le Journal of the Chemical Society, devenu « JCS Perkin ». Il meurt en 1907 d’une pneumonie à Arrow dans la banlieue de Londres. Cette découverte est un exemple type de sérendipité* en chimie.

L'usine de Greenford en 1858. Credit: Wellcome Collection. Licence CC BY 4.0
* La sérendipité est la science des découvertes imprévues. Les Trois Princes de Serendip est un conte oriental décrivant les nombreuses aventures de ces princes au cours desquelles ils utilisent de ténus indices pour remonter logiquement à des faits dont ils ne pouvaient avoir connaissance. (Sérendip est le nom en persan de Ceylan, aujourd’hui Sri Lanka). L’exemple type de cette démarche est Christophe Colomb qui cherche la route des Indes et trouve l'Amérique. C’est aussi ce que Pasteur nommera « le hasard dans un esprit préparé ».
Pour en savoir plus
- What did W. H. Perkin actually make when he oxidised aniline to obtain mauveine?, Otto Meth-Cohn and Mandy Smith, J. Chem. Soc. Perkin Trans. 1 (1994) 5-7
- La Royal Society of Chemistry commémore la découverte de la mauvéine, Dr Anne Prost (2008)
- William Henry Perkin (1838-1907) et la mauvéine, Camille Nerestan, Colorants et textiles de 1850 à nos jours, Carnet de recherche de l'Institut national d'histoire de l'art (INHA) 18 avril 2018
- Mauve Mania, Sophie Waring, site du Science Museum
- Reconstructing the historical synthesis of mauveine from Perkin and Caro: procedure and details, Tânia F. G. G. Cova, Alberto A. C. C. Pais & J. Sérgio Seixas de Melo, Scientific reports 7 (2017) 6806
Vidéo : Réalisation : François Demerliac ; Auteur scientifique : Bernard Bodo ; Production : Fondation de la Maison de la Chimie / Virtuel
On se souvient d’Humphry Davy (1778-1829), chimiste londonien concurrent de Gay-Lussac (1778-1850) et Thenard (1777-1856), pour sa découverte du potassium et du sodium par électrolyse, celle des propriétés physiologiques du protoxyde d’azote (N2O) et son invention de la lampe de sureté des mineurs. Il fut un grand théoricien et reconnut l’hydrogène comme principe d’acidité. Nicolas Vauquelin (1763-1829), chimiste français, analyste de génie, découvert par Antoine de Fourcroy (1755-1809), entre autres travaux et découvertes a isolé la glucine (oxyde de béryllium) et le chrome.
Davy et Vauquelin avaient commencé leur vie professionnelle par un emploi de garçon chez un apothicaire (pharmacien). Avec eux la chimie devint un métier. Au talent oratoire de Davy s’opposait la timidité de Vauquelin.
Davy désirait visiter le continent européen depuis longtemps. C’est ainsi qu’à l’automne 1813 s’étant embarqué avec son préparateur, Faraday, il rendit visite aux chimistes parisiens dont il a laissé de pittoresques portraits biographiques.
Davy était fils de fermiers, les parents de Vauquelin étaient ouvriers agricoles. Davy venait d’épouser une riche veuve, mais Vauquelin, lui, ne vivait que pour son art. En 1783 il était pensionnaire chez Fourcroy dont la sœur aînée tenait la maison.
En 1786, les deux sœurs veuves de Fourcroy, qui ont ouvert « une boutique de parfumerie et de jouets », le recueillent chez elles et le soignent : « Acceptez ; si quelque jour vous réussissez, vous nous rendrez ces légères avances ». Après la mort de Fourcroy (1809), Vauquelin, qui n’était pas un ingrat, prit à son tour chez lui les vieilles dames.
En 1813 il a réussi, il est professeur au Muséum d’histoire naturelle, à la Faculté de médecine, à l’École des mines, premier directeur de l’École de pharmacie, membre de l’Institut.
Voici ce que Davy écrit de la visite qu’il fit à Vauquelin. Il « était, dit-il, au déclin de sa vie (il avait 50 ans, Davy trente-cinq) […]. Il vivait au Jardin du Roi. On ne saurait imaginer rien de plus singulier que sa vie et son intérieur. Deux vieilles filles, mesdemoiselles Fourcroy, sœurs du professeur de ce nom, tenaient sa maison. Je me rappelle qu’en y entrant pour la première fois, je fus introduit dans une sorte de chambre à coucher, qui servait en même temps de salon. L’une de ces demoiselles était au lit et occupée à nettoyer des truffes (pommes de terre) pour le déjeuner. Vauquelin tenait absolument à me régaler, malgré mes efforts pour décliner son invitation. Rien de plus extraordinaire que la simplicité de sa conversation. Il n’avait pas le moindre sentiment des convenances : il parlait de choses qui, depuis le temps du paradis terrestre, n’avaient jamais fait, entre hommes, l’objet d’une conversation devant des personnes de l’autre sexe ». Après Davy, plusieurs de ses biographes ont souligné « la simplicité et la naïveté de son langage ».
 |  |
| Portrait de Sir Humphry Davy (source Wikimedia) | Portrait de Vauquelin situé dans la Salle des actes de la Faculté de pharmacie, 4 avenue de l'Observatoire à Paris (Source : www.acadpharm.org) |
Pour en savoir plus
- VAUQUELIN Nicolas Louis (1763-1829), sur le site EUROMIN Project
- Les « souvenirs d'un oisif » par Emmanuel Grison, Bulletin de la SABIX n°20 (1999)
Le principe actif du remède, la quinine, a été extraite des écorces du quinquina jaune en juin 1820 par deux pharmaciens-chimistes français, Pelletier et Caventou. Cette découverte, très importante à l’époque, est toujours d’actualité en 2020, où nous célèbrerons son bicentenaire. La quinine reste un médicament majeur pour le traitement du paludisme, qui est toujours, avec 219 millions de personnes malades et 435 000 décès en 2017, la parasitose la plus importante. De plus elle concerne majoritairement les enfants de moins de cinq ans.
Le remède a été introduit en Europe dès le début du XVIIe siècle, mais il a fait l’objet de multiples discussions et controverses sur la façon de le préparer et de l’utiliser. C’est une éternelle histoire qui n’est pas sans rappeler l’actualité de 2020.
Il y a maintenant plus de cinq siècles que Christophe Colomb et les conquistadors ont introduit le paludisme dans le Nouveau Monde, les Amériques. Mais le Pérou avait le remède, une substance issue de l’écorce de quinquina utilisée par les amérindiens comme tonique et pour lutter contre des fièvres. Les débuts de cette histoire ont fait l’objet de nombreux récits ou légendes contradictoires.



