Comment fabrique-t-on du savon ?

On a trouvé des textes décrivant l’obtention de savon datant de – 3000 av. J.-C., mais son usage existe probablement depuis la préhistoire. Le mot sapo en gaulois a donné en français le mot savon.
Le savon à travers les siècles
À travers les siècles le mode de fabrication a toujours utilisé deux substances :
- un corps gras, une graisse animale (de bœuf, de mouton, de cochon ou de sanglier…) ou une huile végétale (d’olive, d’arachide, de coprah, de palme...)
- une base alcaline, présente dans les cendres issues de combustion de plantes ou de bois. Le produit basique présent dans les cendres est un carbonate de sodium ou de potassium (Na2CO3 ou K2CO3).
Pendant des siècles la fabrication est restée artisanale, avec les matières premières régionales aussi bien pour le corps gras que pour les cendres.
En 1823, le chimiste français Eugène Chevreul comprend la réaction qui se passe quand on chauffe ensemble la graisse et la base pour former le savon. Cette réaction est appelée saponification. Il identifie aussi la nature ionique des entités constituant les savons.
Quels sont les constituants des corps gras ?
Les corps gras sont des triesters naturels du glycérol appelés aussi triglycérides.
Ils sont formés à partir de glycérol de formule HOH2C-CHOH-CH2OH ( ) et d’acides dits « gras », RCOOH, où R est une très longue chaîne carbonée H3C-(CH2)n-, (n pouvant aller de 3 à 35 ) (1).
Par exemple le triester de l’acide palmitique a pour formule
La réaction de saponification
La réaction de saponification est réalisée de nos jours à l’échelle industrielle en chauffant des corps gras en présence de soude NaOH ou de potasse KOH. On obtient des ions carboxylates à longues chaînes carbonées (2).
Avec la soude on obtient des carboxylates de sodium donnant des savons durs et avec la potasse des carboxylates de potassium donnant des savons mous ou liquides.
On trouve dans le commerce un très grand choix de savons, du fait d’une très grande variété de matières premières parmi les corps gras naturels. Ainsi, il peut y avoir autant de savons « à l’huile d’olive » qu’il y a de variétés d’huiles d’olive !
Historiquement, une teneur de 72 % en masse d’acides gras était garantie dans le savon de Marseille traditionnel, uniquement préparé à partir d'huile d'olive.
Le rôle du savon
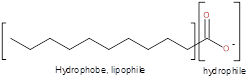
Dans l’ion carboxylate l’extrémité de la chaîne COO- est hydrophile (qui aime l’eau) et la longue chaîne R est lipophile (qui aime la graisse). Ces deux propriétés simultanées permettent d’ôter la graisse d’un vêtement, de la peau ou de tout objet et de l’entrainer avec l’eau(3).
En cette période propice aux virus, respectez les consignes de lavage des mains préconisées par « Santé publique France ». Le lavage des mains au savon permet par la friction et la formation de mousse de déloger la saleté et les virus, puis de les évacuer avec le rinçage. Mais le savon ne tue pas les virus ni les bactéries.
Françoise Brénon et l'équipe Question du mois de Mediachimie
(1) Les triglycérides ont pour formule générale
CH2-O-CO-R1 où R1, R2 et R3 sont des longues chaînes carbonées qui peuvent différer.
|
CH-O-CO-R2
|
CH2-O-CO-R3
(2) Par exemple, pour un corps gras avec la même chaîne R, la réaction de saponification a pour bilan
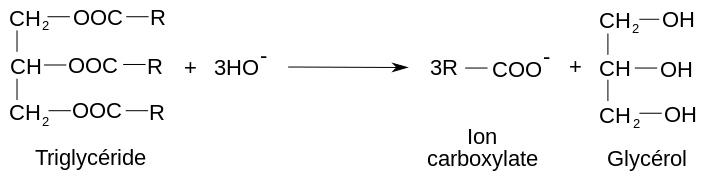
Le carboxylate de sodium a pour formule RCOO –, Na+
Le carboxylate de potassium a pour formule RCOO –, K+
(3) Schématiquement la molécule ionique de savon est représentée ainsi :
La tache de graisse va être emprisonnée par les queues lipophiles des molécules qui s’organisent autour d’elle en sphère, les parties hydrophiles étant en contact avec l’eau. L’ensemble est appelé une micelle.
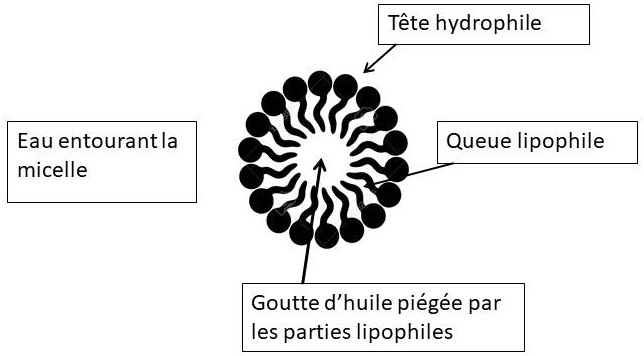
Exemple d’une goutte d’huile piégée
