Le Plomb 212 pour une nouvelle radiothérapie ciblée
Lorsqu’une tumeur cancéreuse est détectée dans l’organisme il y a plusieurs stratégies pour l’éliminer : la chirurgie d’abord mais souvent associée à deux autres traitements, la chimiothérapie et la radiothérapie. Car même si l’essentiel de la tumeur a été retiré, l’amas de cellules cancéreuses peut être éliminé par la prise de médicaments qui réduisent ou stoppent la division cellulaire, c’est la chimiothérapie (1), ou bien localement par irradiation des cellules à l’aide de rayonnements énergétiques fournis par des isotopes radioactifs, c’est la radiothérapie (2).
Les inconvénients de ces méthodes sont connus. Les molécules toxiques utilisées en chimiothérapie atteignent non seulement les cellules cancéreuses mais également toutes les cellules du corps d’où des effets secondaires. Les rayonnements issus des sources radioactives sont soit des électrons (rayons β) ou des rayons X ou des rayons γ (3) qui provoquent des lésions sur les brins d’ADN dans les noyaux des cellules cancéreuses plus ou moins bien ciblées.
Les traitements peuvent être externes mais pour ne pas irradier la peau du patient on peut injecter un produit radioactif qui va attaquer les cellules cancéreuses, par exemple l’iode 131 pour la thyroïde, ou le phosphore 32 en cas de leucémie.
La particularité du traitement qui fait appel au plomb 212 vient du fait que le rayonnement énergétique est apporté par des particules α constituées de 2 protons et de 2 neutrons, bien plus grosses que les électrons et bien plus énergétiques mais que leur propagation se limite à quelques centaines de microns dans le corps.
| Particules β | Particules α | |
| composition | électrons | 2 neutrons + 2 protons |
| énergie | 0,1 KeV.µm-1 | 100 KeV.µm-1 |
| parcours dans le corps | Quelquesmm | quelques microns |
Tableau comparatif des rayonnements
On voit alors vite les avantages des particules α très ionisantes. Elles peuvent plus facilement dégrader l’ADN d’une cellule cancéreuse, et comme leur distance de propagation est mille fois plus petite que celle des électrons, la zone irradiée est comparable à la taille de la cellule que l’on veut ioniser sans que les cellules saines à côté ne soient touchées.
Les émetteurs de particules α semblent donc idéales pour le traitement de certains cancers à condition d’en trouver suffisamment de sources et de pouvoir les guider jusqu’aux cellules cancéreuses.
C’est ici qu’intervient la découverte d’un chercheur d’Areva (maintenant Orano) qui cherchait à valoriser des tonnes de minerai de thorium (4) qui leur restaient après extraction de l’uranium. L’idée de l’alphathérapie a ainsi germé dans les années 2006 et elle s’est précisée en 2012 et 2014 par des partenariats en oncologie avec des laboratoires pharmaceutiques européen et américain de la filiale Orano Med (5) en charge du développement industriel.
La chaine de désintégration du thorium (6) est un peu complexe et conduit à de nombreux intermédiaires.
232Th→ 228Ra + α 228Ra → 228Ac + β 228Ac →228Th + β 228Th → 224Ra + α
224Ra → 220Rn + α 220Rn →216Po + α Pour aboutir ensuite au Plomb 212 216Po → 212Pb + α --
Cet isotope est assez bien placé pour une utilisation radiopharmaceutique puisqu’il a une demi-vie de 11 h et se désintègre au bout d’une semaine donnant d’abord le bismuth 212 et enfin le plomb 208 en libérant des particules α.
Les séparations et extractions sont complexes et un fût de 350 kg de thorium 232 ne donne in fine que quelques dizaines de milligrammes de plomb 212.
Il faut ensuite guider ce « radio-émetteur » vers les cellules cancéreuses. Or celles-ci génèrent à leur surface des antigènes contre lesquels il faut apporter des anticorps capables de les reconnaitre.
La stratégie est d’abord de trouver un ligand du 212Pb qui puisse le chélater (*) pour éviter tout relargage du plomb dans le corps. C’est le TCMC (**) qui a été choisi car il a, de plus, la propriété de se coupler assez facilement avec des anticorps monoclonaux (***) qui vont reconnaître les antigènes produits uniquement à la surface des cellules cancéreuses (7) (8). Une fois les anticorps synthétisés on greffe à leur surface le complexe (TCMC-212Pb) et le vecteur ainsi formé va voyager dans le corps jusqu’à reconnaitre les cellules cancéreuses, et celles-là seulement, et les éliminer par le rayonnement α en préservant les cellules saines (9).
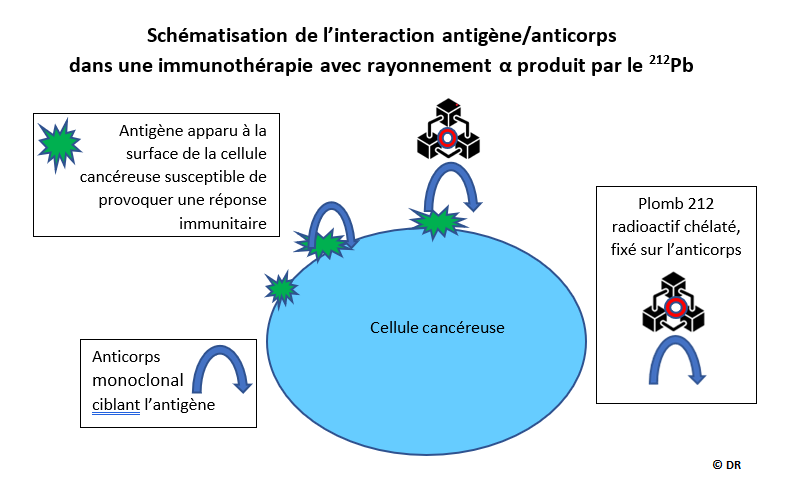
Schématisation de l'interaction antigène/anticorps dans une immunothérapie avec rayonnement α produit par le 212Pb
Les essais cliniques sont en cours aux États-Unis et bientôt en Europe. La filiale Orano Med investit en France plus de 100 M€ en Haute Vienne pour une plateforme industrielle dénommée ATEF (Advanced Thorium Extraction Facility) avec salle blanche répondant aux règlements de l’ANSM pour obtenir la qualification d’Établissement Pharmaceutique. L’ambition est de mettre sur le marché des traitements dès 2025. Les capacités de production pour plusieurs milliers de radiomédicaments sont prévues et même s’il n’y a que quelques dizaines de milligrammes de 212Pb par fût traité, Orano dispose de plusieurs milliers de fûts de thorium à valoriser où d’ailleurs la chaine des isotopes se reconstitue par radioactivité et désintégration naturelle.
Jean-Claude Bernier et Françoise Brénon
Septembre 2021
(*) Le cation central, ici Pb++, entre en interaction avec une molécule appelée ligand en formant une molécule stable. Le processus est appelé chélation et le composé formé un chélate ou complexe.
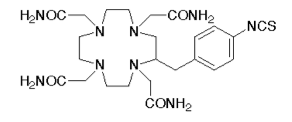
TCMC pour 2-(4-isothiocyanatobenzyl)-1,4,7,10-tetraaza-1,4,7,10-tetra-(2-carbamoylmethyl)cyclododecane
(***) Un anticorps monoclonal est anticorps synthétisé par des cellules (bactérie, levure…) sélectionnées et cultivées pour leur capacité à produire un anticorps particulier capable de traiter une maladie (Source : site Vidal).
Pour en savoir plus
(1) Petites et grosses molécules innovantes pour le traitement du cancer, conférence et article de Jean-Pierre Armand, Colloque Chimie et nouvelles thérapies, 13 novembre 2019
(2) La radioactivité, document du CEA
(3) Quelle dose moyenne de radioactivité reçoit-on en France, Jean-Claude Bernier (question du mois, Mediachimie.org)
(4) La découverte du thorium, J.-J. Berzelius
(5) Site de la société Orano Med
(6) La chimie pour la séparation et la gestion des déchets nucléaires, conférence et article de Bernard Boullis, Colloque Chimie et enjeux énergétiques, 14 novembre 2012
(7) Le plomb radioactif : arme de destruction ciblée des cellules cancéreuses, de Pauline Junquet et Solène Batut (site Culture Sciences Chimie)
(8) Développement d’un immunoconjugué cytotoxique ciblant le récepteur de l’IGF-1, conférence et article de Jean-François Haeuw, Colloque Chimie et nouvelles thérapies, 13 novembre 2019
(9) Les nanomédicaments : une approche intelligente pour le traitement des maladies sévères, conférence et article de Patrick Couvreur, La chimie et la santé, EDP Sciences ( 2010)
Crédits : Image d'illustration : Cellules cancéreuses par Sam Levin, licence CC BY 2.0 ; molécule TCMC site CultureSciencesChimie
