Expériences de fluorescence et de chimiluminescence

Modes opératoires, liste produits et matériels ; conseils et notions à développer, explications.
Les modes opératoires proposés permettent de mettre en évidence l’interaction lumière matière et tout particulièrement l’excitation de molécules par l’absorption du rayonnement UV puis l’émission de lumière colorée par ces mêmes molécules lors de la désactivation.
Objets de ces 3 expériences
- Expérience 1 - Émission de lumière colorée par une molécule fluorescente soumise aux UV
La luminescence est un phénomène d’émission de lumière, ici visible donc colorée, par réarrangement électronique dans une molécule, par suite d’excitation de celle-ci par les UV. Quand ce phénomène n’a lieu que durant l’exposition à une source énergétique et cesse avec l’arrêt de l’exposition, le phénomène est appelé fluorescence (étudié ici). Si le phénomène perdure après l’arrêt à l’exposition aux UV il s’agit de phosphorescence (ce 2ème phénomène n’est pas étudié dans ces 3 expériences). - Expérience 2 - Chimiluminescence : émission de lumière provoquée par une réaction chimique réalisée avec le luminol
La chimiluminescence consiste en une émission de lumière visible provoquée par une réaction chimique. - Expérience 3 - Expérience combinée de chimiluminescence et de fluorescence réalisée avec du luminol et de la fluorescéine
Il est possible de combiner le phénomène de chimiluminescence et de fluorescence. Il y a alors émission de lumière visible par une molécule fluorescente préalablement excitée par l’énergie libérée par une réaction chimique.
Acquis préalables et notions générales à faire comprendre au cours des expériences
Rappeler que la lumière blanche est composée de lumières colorées et présenter un spectre obtenu par décomposition de la lumière blanche.
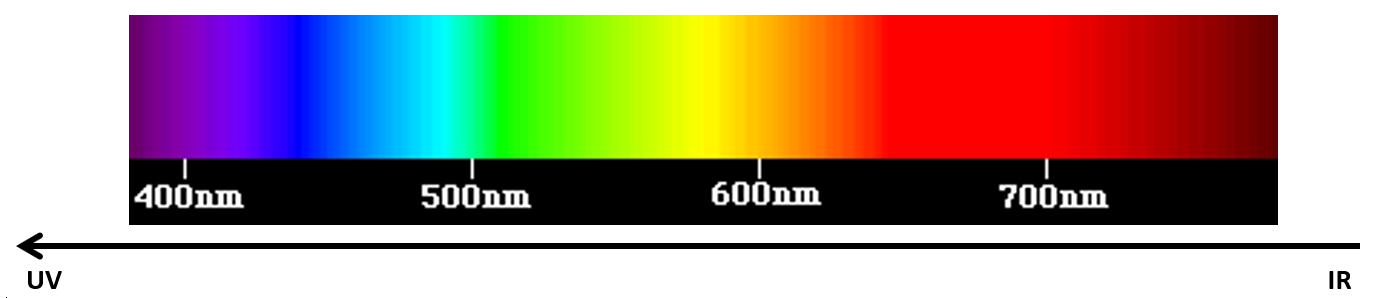
Spectre de la lumière visible
Rappeler que la lumière blanche est la superposition intégrale de toutes ces lumières (synthèse additive).
Observer que lorsqu’on va du rouge vers le bleu on va vers des rayonnements de plus en plus énergétiques.
Les UV sont des rayonnements de forte énergie (juste à gauche du violet sur le graphe) mais invisibles à nos yeux (ils nous paraissent incolores).
Faire comprendre la notion de niveau d’énergie et d’excitation des molécules puis de retour à un état plus stable.
Accompagner éventuellement le discours d’une représentation graphique des niveaux d'énergie.
Faire comprendre que s’il y a émission de lumière colorée par une molécule cela diffère de la couleur des objets qui nous entourent, qui elle résulte de l’absorption d’une partie de la lumière blanche provenant du soleil (absorption sélective ou synthèse soustractive).
Faire observer que le phénomène de fluorescence n'est observable que durant l'exposition à une source d’énergie (UV ou libération d’énergie provoquée par une réaction chimique) et que cela cesse dès qu'on arrête l'excitation.
Expérience 1 - Émission de lumière colorée par une molécule fluorescente soumise aux UV
Matériel
- 2 récipients au choix (éprouvette, bécher de 150 ou 200 mL, fiole jaugée ….) le plus photogénique !
- 1 lampe UV 365 nm
Produits
- Fluorescéine : en faire une solution bien jaune
- Schweppes® tonic (seul le tonic contient de la quinine)
- Papier blanc
- Surligneurs « fluos » de diverses couleurs
Mode opératoire
- Introduire dans le récipient choisi la solution de fluorescéine. Observer la couleur jaune à la lumière du jour (cette couleur jaune résulte de l’absorption sélective du bleu par la fluorescéine).
- Éclairer par la lampe UV et observer la lumière verte « flashie » (ou vert brillant) qui apparait sous UV et disparait sans UV.
- Insister ici sur le fait qu'il y a émission de lumière par la molécule (c’est ce qui donne l’aspect brillant).
- Puis arrêter les UV et retrouver la couleur jaune mat (sans émission de lumière).
- Faire de même avec du Schweppes® tonic. On observe une lumière bleue.
- Faire de même avec papier blanc. On observe une lumière bleue.
- Faire de même avec des encres de surligneurs préalablement étalées sur un papier.
Explications à adapter selon le public, élèves de lycée ou grand public
La fluorescéine est une molécule qui présente en son sein des électrons qui peuvent acquérir de l’énergie, cad monter à un niveau supérieur instable. Les électrons sont dits dans un état excité et tendent à revenir à un état stable. Lors de ce retour à l’état stable, ils émettent de l’énergie sous forme lumineuse. Ici il s’agit de la lumière verte.
Ce phénomène s’arrête si on éteint la lampe UV. Ce phénomène est appelé fluorescence. Et la fluorescéine est dite une molécule fluorescente.
On peut proposer un résumé du type :
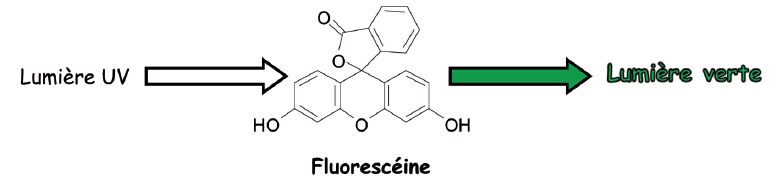
Source : Le laboratoire des couleurs – Anne Guillerand - BUP vol. 104 ( Déc. 2010)
Avec du Schweppes® on observe une lumière brillante bleue sous UV. Elle est dû à la molécule fluorescente de quinine présente dans le Schweppes®.
.png)
formule de la quinine
Avec du papier blanc
Pourquoi observe-t-on que le papier blanc émet du bleu quand on l’éclaire par la lampe UV ?
Dans la composition du papier il a été ajouté des produits fluorescents dits azurants (comme l’azur : bleu).
Pour faire un lien avec la vie de tous les jours, on trouve aussi ces additifs dans les lessives pour améliorer la sensation de blanc des tissus (« plus blanc que blanc » comme disent certaines publicités ou comme le caricaturait Coluche). Cette impression est due au fait que la lumière du soleil contient aussi des UV qui excitent les électrons des azurants.
C’est le même effet que l’on observe avec les chemises blanches dans les boites de nuits où l’on danse en lumière dite noire (qui sont en réalité des UV proches du visible).
Le phénomène est le même avec les traces de surligneurs qui ont été étalées sur du papier. Leur encre visible et résistante à la lumière sans pour autant masquer le texte lui-même,contient des agents fluorescents.
On peut citer d’autres composés fluorescents connus :
- Nombreux minéraux : fluorites (à l’origine du nom de la propriété), quartz, topaze…
- Monde végétal et vivant : chlorophylle, certains champignons, scorpions…
- Produit pharmaceutique : éosine
- Tubes d’éclairage fluorescents
- Utilisation de cette propriété dans l'art, aussi bien dans des peintures utilisant des pigments fluorescents que pour analyser les constituants des couches supérieures de peintures
- Utilisation pour certains diagnostics médicaux
Expérience 2 - Chimiluminescence : émission de lumière provoquée par une réaction chimique réalisée avec le luminol
Matériel
- 1 balance au 1/100e avec capsules plastiques pour pesées + spatules
- 2 grandes éprouvettes de 500 mL
- 1 très grande éprouvette de 1000 mL
- 2 éprouvettes de 5 mL ou pipettes graduées de 5 mL
- 1 pipette graduée de 3 mL ou 5 mL
- 1 propipette
- 1 cristallisoir
Produits
- luminol 0,1 g (le nom du luminol en nomenclature est la 5-amino-1,2,3,4-tétrahydrophtalazine-1,4-dione)
- solution d’hydroxyde de sodium NaOH (soude) à 10% 5 mL
- eau distillée (1 L)
- ferricyanure de potassium (ou (hexacyanoferrate(III) de potassium) solide 1,5 g
- eau oxygénée (ou solution aqueuse de peroxyde d’hydrogène) à 30% (3 mL)
Mode opératoire
- Préparer sous hotte devant le public ou avoir préparé à l’avance (sauf l’ajout de l’eau oxygénée qui doit se faire au dernier moment)
- Éprouvette A (ou fiole jaugée A facile à boucher si réalisée à l’avance) : dissoudre 0,1 g de luminol dans 400 mL d’eau et ajouter 5 mL de soude à 10%.
- Éprouvette ou fiole jaugée B : dissoudre 1,5 g de ferricyanure de potassium dans 400 mL d’eau. Ajouter à la dernière minute 3 mL d’eau oxygénée à 30%
- Rendre sombre la pièce, verser simultanément le contenu des 2 éprouvettes A et B dans un grand entonnoir déposé sur la grande éprouvette à pied : il se produit une magnifique lumière bleue !
On peut aussi dans l’éprouvette B ne mettre que l’eau et l’eau oxygénée et le mode opératoire est alors le suivant.
Introduire quelques cristaux de ferricyanure de potassium solide dans la grande éprouvette où aura lieu l’expérience. Rendre sombre la pièce, verser simultanément le contenu des 2 éprouvettes A et B via un grand entonnoir dans la grande éprouvette à pied : il se produit une magnifique lumière bleue !
Notions à développer sous forme de commentaires et à adapter selon le public pendant la démonstration
Présentation préalable des produits présents dans les éprouvettes :
Éprouvette B :
L’eau oxygénée : que tout le monde connait et a dans sa pharmacie ; mais ici elle est beaucoup plus concentrée. C’est un produit très réactif et oxydant, surtout si elle est concentrée.
Le ferricyanure est un composé contenant du fer à l’état oxydé [Fe (III)] C’est ici un catalyseur c’est à dire un produit qui va accélérer la réaction que l’on veut observer.
Éprouvette A :
La soude : elle créé un milieu basique propice à la réaction (on peut dire que tout le monde connait la soude soit sous ce nom soit sous forme de Destop par exemple et en a dans sa cuisine sous les lavabos !! ce qu’il ne faut pas faire pour protéger les enfants !!!).
Le luminol est une molécule complexe fragile en présence d’oxydant telle que l’eau oxygénée.
Si le public est un peu plus averti on peut ajouter que la fragilité concerne une partie seulement de la molécule, là où il y a 2 atomes d’azote liés entre eux. On peut aussi montrer le dessin de la molécule ou un modèle moléculaire et montrer les 2 atomes d’azote concernés.
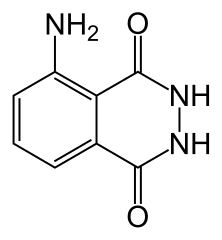
formule du luminol
Explications
Quand les 4 produits sont mis en contact, le luminol et l’eau oxygénée en milieu basique, en présence de ferricynanure de potassium (comme catalyseur) réagissent vivement (ce qui libère une forte énergie) et il se forme du diazote, de l’eau et un di-anion aminophtalate dérivé du luminol, dans un état excité. Cet état résulte de l’énergie libérée par la réaction. Puis ce di-anion se désactive et émet une lumière bleue. La réaction chimique a ainsi créé de l’énergie que l’on observe sous forme lumineuse.
On peut proposer un résumé du type :
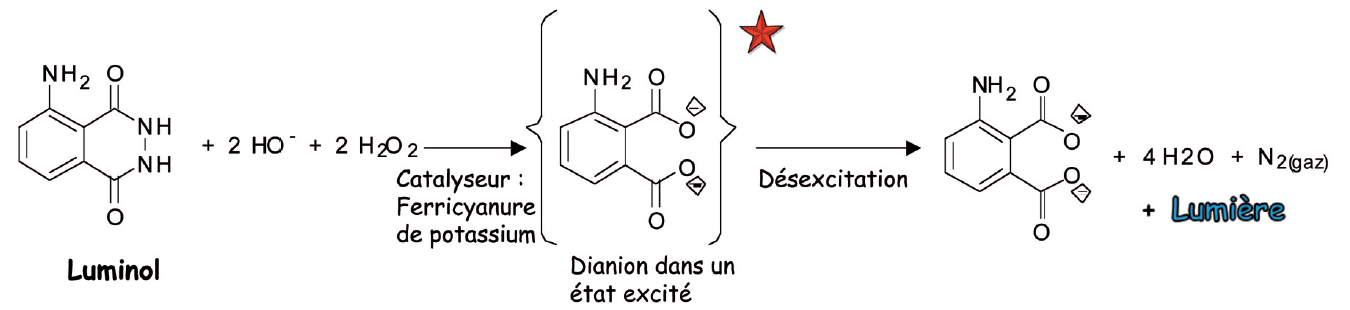
Source : Le laboratoire des couleurs – Anne Guillerand - BUP vol. 104 ( Déc. 2010)
Exemples dans la vie courante
- Cette expérience est réalisée par la police scientifique pour rechercher des traces de sang. En effet l’hémoglobine du sang contient du fer à l’état oxydé Fe(II) qui en présence de l’eau oxygénée passe à l’état de Fer(III) qui joue alors le rôle de catalyseur (à la place du ferricyanure que nous avons utilisé). Ce procédé a été repris dans un certain nombre de séries TV policières !
- Dans le monde animal, tout le monde a eu l’occasion de voir, lors de promenades nocturnes, des vers luisants ou des lucioles émettre des petites lumières jaunes à verdâtre. Cette lumière résulte d’une réaction chimique, propre à l’animal, dans le corps de la luciole. On parle aussi de bioluminescence. Ces émissions de lumière permettent aux couples de se trouver pour assurer la reproduction.
- Certains planctons et phytoplanctons sont aussi bioluminescents. Ce processus pouvant à la fois servir selon l’espèce pour le camouflage, l’attraction sexuelle, mais aussi la répulsion ou la communication.
Si on est en présence d’un public un peu plus averti, on peut préciser que dans les réactions de bioluminescence observées dans divers organismes vivants, le composé chimique à l'origine de la luminescence est presque toujours la luciférine. Celle-ci émet de la lumière en subissant une oxydation par le dioxygène grâce à l'intervention d’une enzyme, la luciférase qui joue le rôle de catalyseur.
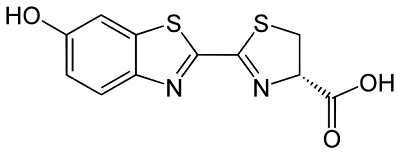
formule de la luciférine
Expérience 3 - Expérience combinée de chimiluminescence et de fluorescence réalisée avec du luminol et de la fluorescéine
- Même matériel et mêmes produits qu’en 2 + solution de fluorescéine ou fluorescéine en poudre.
- Même mode opératoire qu’en 2, mais ajouter dans la solution A initiale de la fluorescéine en poudre ou en solution, de manière à obtenir une solution bien jaune.
- On peut sans doute utiliser pour cette derrière expérience les produits en quantités divisées par 2.
- Observer alors une lumière verte
Explications
La même réaction chimique du luminol et de l’eau oxygénée conduit au di-anion qui en se désactivant excite la molécule de fluorescéine. Celle-ci en se désactivant à son tour donne la couleur verte qu’elle émettait sous UV (rappel de la 1ère expérience).
Cela peut avoir lieu avec tout autre molécule fluorescente ajoutée. On obtiendra l’émission de la couleur caractéristique de la molécule ajoutée.
Exemples dans la vie courante
Les bâtons lumineux festifs que l’on peut acheter lors de concerts ou fêtes et que l’on doit casser délicatement. Lors de la fracture du petit tube de verre intérieur, qui séparait les produits, les réactifs sont mis en contact et il se produit une réaction comparable à celle que nous venons d’observer, avec l’eau oxygénée, le luminol et la fluorescéine.
Il y a différentes couleurs selon les réactifs fluorescents introduits dans chacun des bâtons.
Le phénomène s’arrête quand tous les produits chimiques contenus dans le bâton ont été consommés.
Illustration : Capture d'écran vidéo Fluorescence © Mediachimie/Blablareau au labo
