La chimie thérapeutique a pour mission la découverte de nouveaux médicaments. Mais de la molécule au médicament la route est longue - de 10 à 15 ans -, périlleuse - 95 à 99% d’échecs - et coûteuse - de l’ordre du milliard d’euros -. Le dialogue doit être constant entre les chimistes, les biologistes, les physiciens, les cliniciens et les industriels de la santé.La chimie est une discipline précieuse pour comprendre les mécanismes biologiques. Le couplage de la compréhension des mécanismes cellulaires avec une véritable ingénierie moléculaire a permis des progrès spectaculaires pour améliorer le traitement des maladies sévères. L’innovation est difficile dans ce domaine et fait appel à de nouvelles voies telles que la génomique, l’extension du recours aux biomolécules naturelles, notamment celles présentes dans les systèmes vivants, et l’approfondissement de nouvelles méthodes de recherche (méthodes de calcul prédictives, chimie combinatoire…).
Les plantes peuvent soigner mais peuvent aussi être des poisons mortels, d'où l'intérêt de la célèbre romancière pour ces substances, qu'elle a connues comme pharmacienne pendant la guerre de 14-18 dans un hôpital militaire. La coca a vu de nombreuses applications, dont un fameux soda.
Source : cocaïne, poison végétal, stupéfiant, alcaloïde, overdose, Agatha Christie, coca, coca-cola
Pour aller plus loin avec la question 1
En France, la prévalence globale du diabète est estimée à environ 5% de la population, mais c’est une maladie qui est sous-estimée compte tenu de son caractère largement silencieux. Le diabète constitue un des principaux facteurs de risques cardiovasculaires. Les autres complications dues au diabète sont, entre autres, le risque d’accident vasculaire cérébral (AVC), de cécité, d’insuffisance rénale et de neuropathie périphérique.
Pour aller plus loin avec la question 2
Le glucose est un sucre de formule brute C6H12O6. La régulation de la glycémie (concentration du glucose dans le sang, le taux normal de glycémie se situant entre 0,7 g et 1,1 g par litre de sang) dépend essentiellement de la capacité des cellules à absorber le glucose. C’est l’insuline (en savoir plus sur l'insuline), une hormone secrétée par le pancréas, qui contrôle l’entrée du glucose dans les cellules. Le diabète se caractérise par un taux de glycémie à jeun supérieur à 1,10 g/L. Il s’agit d’hyperglycémie.
Pour aller plus loin avec la question 4
Différents types de médicaments sont sur le marché :
- Les biguanidines (formule de la guanidine: H2N-C(=NH)-NH2), tels que la metformine de formule (CH3)2N-C(=NH)NH-C(=NH)-NH2, ont une action qui limite l’hyperglycémie.
- Les sulfamides de formule générale C6H6-SO2-NH-CO-NH-R augmentent la libération d’insuline par les cellules du pancréas.
- Les gliflozines augmentent l’élimination urinaire du glucose.
Pour aller plus loin avec la question 5
Du fait de cette utilisation, il arrive que des malades diabétiques ne puissent pas avoir leur traitement du fait de l’indisponibilité du médicament en pharmacie. La Haute Autorité pour la santé vient de donner son feu vert pour l’utilisation de ce médicament vendu sous le nom de Wegovy.
Comment le chimiste Pierre Potier parvient à extraire des feuilles de l'if européen des molécules pour conduire à l'un des médicaments anticancéreux les plus utilisés dans le monde. Une vraie success story !
Agatha Christie, née à Torquay en Angleterre le 15 septembre 1890, a obtenu un diplôme en pharmacie le 30 avril 1917 après avoir servi comme assistante chimiste dans un hôpital militaire pendant la Première Guerre mondiale. C’est pourquoi dans de nombreux romans policiers, elle utilise des poisons végétaux qui entraînent la mort. Les produits pris à faible dose servent souvent à soulager le malade et sont considérés comme des médicaments mais si la dose est supérieure, le produit peut devenir mortel. Ces produits proviennent de plantes qui, elles aussi, sont dangereuses dans les jardins.
Dans le roman La maison du péril, certains protagonistes consomment de la cocaïne. La cocaïne est obtenue à partir de l’Erythroxylum coca. C’est un arbrisseau qui pousse dans diverses régions d’Amérique du Sud, en Indonésie et dans l’Est africain. La formule chimique de la cocaïne est C17H21NO4 et sa formule développée est la suivante :

Elle est classifiée comme stupéfiant par la Convention unique sur les stupéfiants de 1961 de l'ONU. Elle est illégale dans presque tous les pays, dépénalisée en République tchèque et au Portugal. La feuille de coca est utilisée depuis très longtemps par les indigènes des plateaux andins. La feuille de coca est mâchée ou prise en infusion pour les aider à résister à la fatigue et à l'altitude. Sous cette forme, la coca a un léger effet stimulant, comparable à celui de la caféine. Une feuille de coca contient 0,5% de cocaïne. Dès 1870, on voit apparaître la consommation populaire de vin dans lequel sont infusées préalablement des feuilles de coca. En 1871, le marché est dominé par une marque restée célèbre : le « vin Mariani », boisson tonique française du nom de Ange François Mariani dit Angelo Mariani (1838-1914), préparateur en pharmacie qui a fait macérer des feuilles de coca dans du vin de Bordeaux et a eu l'idée de commercialiser ce vin.
Quant au Coca-Cola, il est créé en 1886 par un pharmacien John Pemberton (1831-1888) pour une boisson à base de coca. De nos jours il n’y a plus de cocaïne dans le Coca-Cola.
Les décès dus à la cocaïne dépendent de facteurs liés à la santé (hypertension, insuffisance respiratoire, asthme, diabète), à une overdose (dose létale 1,2g) ou à une consommation associée à un mélange d’autres substances (tabac, alcool…).


Agatha Christie / Erythroxylum coca
Pour en savoir plus
- Dame Agatha Christie pharmacien : Eunice Bonow Bardell, Dame Agatha's Dispensary, L. Coignerai-Devillers, Revue d’Histoire de la Pharmacie (1984) pp. 199-200
- La coca, la cocaïne et la cocaïnomanie : Symposium Geschiedenis van de Cocaïne, Histoire de la Cocaïne, Brussel, 20 april 1991, P. Julien, Revue d'Histoire de la Pharmacie (1992) pp. 345-346
- W. Golden Mortimer, De la coca à la cocaïne, Z. Domic, Annales. Histoire, Sciences Sociales (1995) pp. 701-711
- À la poursuite du Vin Mariani…, W.H. Helsan, Revue d'Histoire de la Pharmacie (1988) pp. 167-170
- Mariani et le vin de coca, W.H. Helsan, Revue d'Histoire de la Pharmacie (1980) 247 pp. 227-234
- Information et prévention sur les risques liés à la cocaïne, MILDECA (Mission interministérielle de lutte contre les drogues et les conduites addictives ) drogues.gouv.fr
Crédits illustrations :
- Erythroxylum coca, Plantes médicinales de Köhler, Wikimedia Commons, domain public
- By Agatha Christie plaque -Torre Abbey.jpg: Violetrigaderivative work: F l a n k e r - Agatha Christie plaque -Torre Abbey.jpg, Wikimedia Commons, licence CC BY-SA 3.0
Modes opératoires, liste produits et matériels ; conseils et notions à développer, explications.
Les modes opératoires proposés permettent de mettre en évidence l’interaction lumière matière et tout particulièrement l’excitation de molécules par l’absorption du rayonnement UV puis l’émission de lumière colorée par ces mêmes molécules lors de la désactivation.
Objets de ces 3 expériences
- Expérience 1 - Émission de lumière colorée par une molécule fluorescente soumise aux UV
La luminescence est un phénomène d’émission de lumière, ici visible donc colorée, par réarrangement électronique dans une molécule, par suite d’excitation de celle-ci par les UV. Quand ce phénomène n’a lieu que durant l’exposition à une source énergétique et cesse avec l’arrêt de l’exposition, le phénomène est appelé fluorescence (étudié ici). Si le phénomène perdure après l’arrêt à l’exposition aux UV il s’agit de phosphorescence (ce 2ème phénomène n’est pas étudié dans ces 3 expériences). - Expérience 2 - Chimiluminescence : émission de lumière provoquée par une réaction chimique réalisée avec le luminol
La chimiluminescence consiste en une émission de lumière visible provoquée par une réaction chimique. - Expérience 3 - Expérience combinée de chimiluminescence et de fluorescence réalisée avec du luminol et de la fluorescéine
Il est possible de combiner le phénomène de chimiluminescence et de fluorescence. Il y a alors émission de lumière visible par une molécule fluorescente préalablement excitée par l’énergie libérée par une réaction chimique.
Acquis préalables et notions générales à faire comprendre au cours des expériences
Rappeler que la lumière blanche est composée de lumières colorées et présenter un spectre obtenu par décomposition de la lumière blanche.
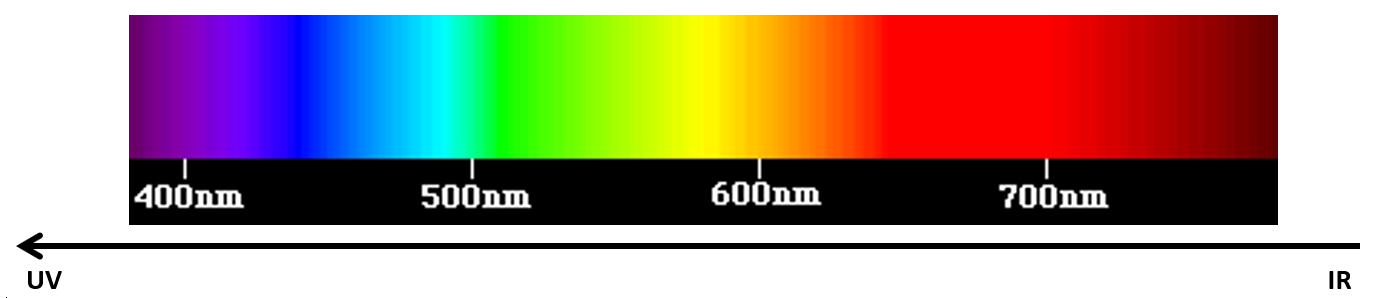
Spectre de la lumière visible
Rappeler que la lumière blanche est la superposition intégrale de toutes ces lumières (synthèse additive).
Observer que lorsqu’on va du rouge vers le bleu on va vers des rayonnements de plus en plus énergétiques.
Les UV sont des rayonnements de forte énergie (juste à gauche du violet sur le graphe) mais invisibles à nos yeux (ils nous paraissent incolores).
Faire comprendre la notion de niveau d’énergie et d’excitation des molécules puis de retour à un état plus stable.
Accompagner éventuellement le discours d’une représentation graphique des niveaux d'énergie.
Faire comprendre que s’il y a émission de lumière colorée par une molécule cela diffère de la couleur des objets qui nous entourent, qui elle résulte de l’absorption d’une partie de la lumière blanche provenant du soleil (absorption sélective ou synthèse soustractive).
Faire observer que le phénomène de fluorescence n'est observable que durant l'exposition à une source d’énergie (UV ou libération d’énergie provoquée par une réaction chimique) et que cela cesse dès qu'on arrête l'excitation.
Expérience 1 - Émission de lumière colorée par une molécule fluorescente soumise aux UV
Matériel
- 2 récipients au choix (éprouvette, bécher de 150 ou 200 mL, fiole jaugée ….) le plus photogénique !
- 1 lampe UV 365 nm
Produits
- Fluorescéine : en faire une solution bien jaune
- Schweppes® tonic (seul le tonic contient de la quinine)
- Papier blanc
- Surligneurs « fluos » de diverses couleurs
Mode opératoire
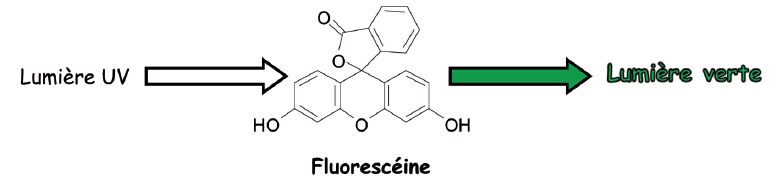
- Introduire dans le récipient choisi la solution de fluorescéine. Observer la couleur jaune à la lumière du jour (cette couleur jaune résulte de l’absorption sélective du bleu par la fluorescéine).
- Éclairer par la lampe UV et observer la lumière verte « flashie » (ou vert brillant) qui apparait sous UV et disparait sans UV.
- Insister ici sur le fait qu'il y a émission de lumière par la molécule (c’est ce qui donne l’aspect brillant).
- Puis arrêter les UV et retrouver la couleur jaune mat (sans émission de lumière).
- Faire de même avec du Schweppes® tonic. On observe une lumière bleue.
- Faire de même avec papier blanc. On observe une lumière bleue.
- Faire de même avec des encres de surligneurs préalablement étalées sur un papier.
Explications à adapter selon le public, élèves de lycée ou grand public
La fluorescéine est une molécule qui présente en son sein des électrons qui peuvent acquérir de l’énergie, cad monter à un niveau supérieur instable. Les électrons sont dits dans un état excité et tendent à revenir à un état stable. Lors de ce retour à l’état stable, ils émettent de l’énergie sous forme lumineuse. Ici il s’agit de la lumière verte.
Ce phénomène s’arrête si on éteint la lampe UV. Ce phénomène est appelé fluorescence. Et la fluorescéine est dite une molécule fluorescente.
On peut proposer un résumé du type :
Source : Le laboratoire des couleurs – Anne Guillerand - BUP vol. 104 ( Déc. 2010)
Avec du Schweppes® on observe une lumière brillante bleue sous UV. Elle est dû à la molécule fluorescente de quinine présente dans le Schweppes®.
.png)
formule de la quinine
Avec du papier blanc
Pourquoi observe-t-on que le papier blanc émet du bleu quand on l’éclaire par la lampe UV ?
Dans la composition du papier il a été ajouté des produits fluorescents dits azurants (comme l’azur : bleu).
Pour faire un lien avec la vie de tous les jours, on trouve aussi ces additifs dans les lessives pour améliorer la sensation de blanc des tissus (« plus blanc que blanc » comme disent certaines publicités ou comme le caricaturait Coluche). Cette impression est due au fait que la lumière du soleil contient aussi des UV qui excitent les électrons des azurants.
C’est le même effet que l’on observe avec les chemises blanches dans les boites de nuits où l’on danse en lumière dite noire (qui sont en réalité des UV proches du visible).
Le phénomène est le même avec les traces de surligneurs qui ont été étalées sur du papier. Leur encre visible et résistante à la lumière sans pour autant masquer le texte lui-même,contient des agents fluorescents.
On peut citer d’autres composés fluorescents connus :
- Nombreux minéraux : fluorites (à l’origine du nom de la propriété), quartz, topaze…
- Monde végétal et vivant : chlorophylle, certains champignons, scorpions…
- Produit pharmaceutique : éosine
- Tubes d’éclairage fluorescents
- Utilisation de cette propriété dans l'art, aussi bien dans des peintures utilisant des pigments fluorescents que pour analyser les constituants des couches supérieures de peintures
- Utilisation pour certains diagnostics médicaux
Expérience 2 - Chimiluminescence : émission de lumière provoquée par une réaction chimique réalisée avec le luminol
Matériel
- 1 balance au 1/100e avec capsules plastiques pour pesées + spatules
- 2 grandes éprouvettes de 500 mL
- 1 très grande éprouvette de 1000 mL
- 2 éprouvettes de 5 mL ou pipettes graduées de 5 mL
- 1 pipette graduée de 3 mL ou 5 mL
- 1 propipette
- 1 cristallisoir
Produits
- luminol 0,1 g (le nom du luminol en nomenclature est la 5-amino-1,2,3,4-tétrahydrophtalazine-1,4-dione)
- solution d’hydroxyde de sodium NaOH (soude) à 10% 5 mL
- eau distillée (1 L)
- ferricyanure de potassium (ou (hexacyanoferrate(III) de potassium) solide 1,5 g
- eau oxygénée (ou solution aqueuse de peroxyde d’hydrogène) à 30% (3 mL)
Mode opératoire
- Préparer sous hotte devant le public ou avoir préparé à l’avance (sauf l’ajout de l’eau oxygénée qui doit se faire au dernier moment)
- Éprouvette A (ou fiole jaugée A facile à boucher si réalisée à l’avance) : dissoudre 0,1 g de luminol dans 400 mL d’eau et ajouter 5 mL de soude à 10%.
- Éprouvette ou fiole jaugée B : dissoudre 1,5 g de ferricyanure de potassium dans 400 mL d’eau. Ajouter à la dernière minute 3 mL d’eau oxygénée à 30%
- Rendre sombre la pièce, verser simultanément le contenu des 2 éprouvettes A et B dans un grand entonnoir déposé sur la grande éprouvette à pied : il se produit une magnifique lumière bleue !
On peut aussi dans l’éprouvette B ne mettre que l’eau et l’eau oxygénée et le mode opératoire est alors le suivant.
Introduire quelques cristaux de ferricyanure de potassium solide dans la grande éprouvette où aura lieu l’expérience. Rendre sombre la pièce, verser simultanément le contenu des 2 éprouvettes A et B via un grand entonnoir dans la grande éprouvette à pied : il se produit une magnifique lumière bleue !
Notions à développer sous forme de commentaires et à adapter selon le public pendant la démonstration
Présentation préalable des produits présents dans les éprouvettes :
Éprouvette B :
L’eau oxygénée : que tout le monde connait et a dans sa pharmacie ; mais ici elle est beaucoup plus concentrée. C’est un produit très réactif et oxydant, surtout si elle est concentrée.
Le ferricyanure est un composé contenant du fer à l’état oxydé [Fe (III)] C’est ici un catalyseur c’est à dire un produit qui va accélérer la réaction que l’on veut observer.
Éprouvette A :
La soude : elle créé un milieu basique propice à la réaction (on peut dire que tout le monde connait la soude soit sous ce nom soit sous forme de Destop par exemple et en a dans sa cuisine sous les lavabos !! ce qu’il ne faut pas faire pour protéger les enfants !!!).
Le luminol est une molécule complexe fragile en présence d’oxydant telle que l’eau oxygénée.
Si le public est un peu plus averti on peut ajouter que la fragilité concerne une partie seulement de la molécule, là où il y a 2 atomes d’azote liés entre eux. On peut aussi montrer le dessin de la molécule ou un modèle moléculaire et montrer les 2 atomes d’azote concernés.
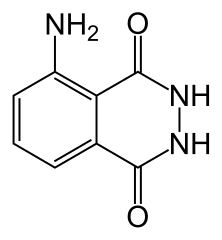
formule du luminol
Explications
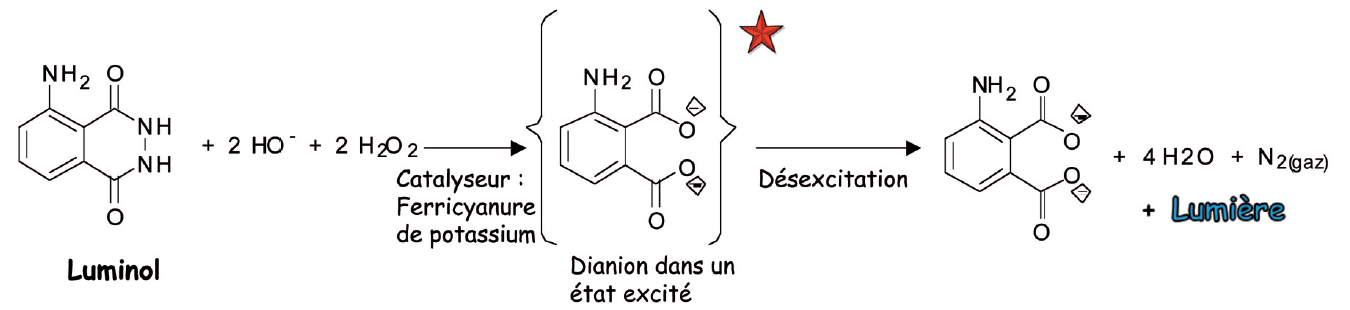
Quand les 4 produits sont mis en contact, le luminol et l’eau oxygénée en milieu basique, en présence de ferricynanure de potassium (comme catalyseur) réagissent vivement (ce qui libère une forte énergie) et il se forme du diazote, de l’eau et un di-anion aminophtalate dérivé du luminol, dans un état excité. Cet état résulte de l’énergie libérée par la réaction. Puis ce di-anion se désactive et émet une lumière bleue. La réaction chimique a ainsi créé de l’énergie que l’on observe sous forme lumineuse.
On peut proposer un résumé du type :
Source : Le laboratoire des couleurs – Anne Guillerand - BUP vol. 104 ( Déc. 2010)
Exemples dans la vie courante
- Cette expérience est réalisée par la police scientifique pour rechercher des traces de sang. En effet l’hémoglobine du sang contient du fer à l’état oxydé Fe(II) qui en présence de l’eau oxygénée passe à l’état de Fer(III) qui joue alors le rôle de catalyseur (à la place du ferricyanure que nous avons utilisé). Ce procédé a été repris dans un certain nombre de séries TV policières !
- Dans le monde animal, tout le monde a eu l’occasion de voir, lors de promenades nocturnes, des vers luisants ou des lucioles émettre des petites lumières jaunes à verdâtre. Cette lumière résulte d’une réaction chimique, propre à l’animal, dans le corps de la luciole. On parle aussi de bioluminescence. Ces émissions de lumière permettent aux couples de se trouver pour assurer la reproduction.
- Certains planctons et phytoplanctons sont aussi bioluminescents. Ce processus pouvant à la fois servir selon l’espèce pour le camouflage, l’attraction sexuelle, mais aussi la répulsion ou la communication.
Si on est en présence d’un public un peu plus averti, on peut préciser que dans les réactions de bioluminescence observées dans divers organismes vivants, le composé chimique à l'origine de la luminescence est presque toujours la luciférine. Celle-ci émet de la lumière en subissant une oxydation par le dioxygène grâce à l'intervention d’une enzyme, la luciférase qui joue le rôle de catalyseur.
formule de la luciférine
Expérience 3 - Expérience combinée de chimiluminescence et de fluorescence réalisée avec du luminol et de la fluorescéine
- Même matériel et mêmes produits qu’en 2 + solution de fluorescéine ou fluorescéine en poudre.
- Même mode opératoire qu’en 2, mais ajouter dans la solution A initiale de la fluorescéine en poudre ou en solution, de manière à obtenir une solution bien jaune.
- On peut sans doute utiliser pour cette derrière expérience les produits en quantités divisées par 2.
- Observer alors une lumière verte
Explications
La même réaction chimique du luminol et de l’eau oxygénée conduit au di-anion qui en se désactivant excite la molécule de fluorescéine. Celle-ci en se désactivant à son tour donne la couleur verte qu’elle émettait sous UV (rappel de la 1ère expérience).
Cela peut avoir lieu avec tout autre molécule fluorescente ajoutée. On obtiendra l’émission de la couleur caractéristique de la molécule ajoutée.
Exemples dans la vie courante
Les bâtons lumineux festifs que l’on peut acheter lors de concerts ou fêtes et que l’on doit casser délicatement. Lors de la fracture du petit tube de verre intérieur, qui séparait les produits, les réactifs sont mis en contact et il se produit une réaction comparable à celle que nous venons d’observer, avec l’eau oxygénée, le luminol et la fluorescéine.
Il y a différentes couleurs selon les réactifs fluorescents introduits dans chacun des bâtons.
Le phénomène s’arrête quand tous les produits chimiques contenus dans le bâton ont été consommés.
Illustration : Capture d'écran vidéo Fluorescence © Mediachimie/Blablareau au labo
Source : luminol, fluorescéine, UV, émission de lumière, bioluminescence, investigation policière, sang
L'objectif de la bactérie [1], qui est un procaryote donc dépourvue de noyau (fig. 1), est de se multiplier et « d'occuper le terrain ». C'est d'ailleurs pourquoi de nombreux antibactériens sont produits par des microorganismes, qui éliminent ainsi les concurrents pour être les seuls à disposer des ressources nutritives [2].
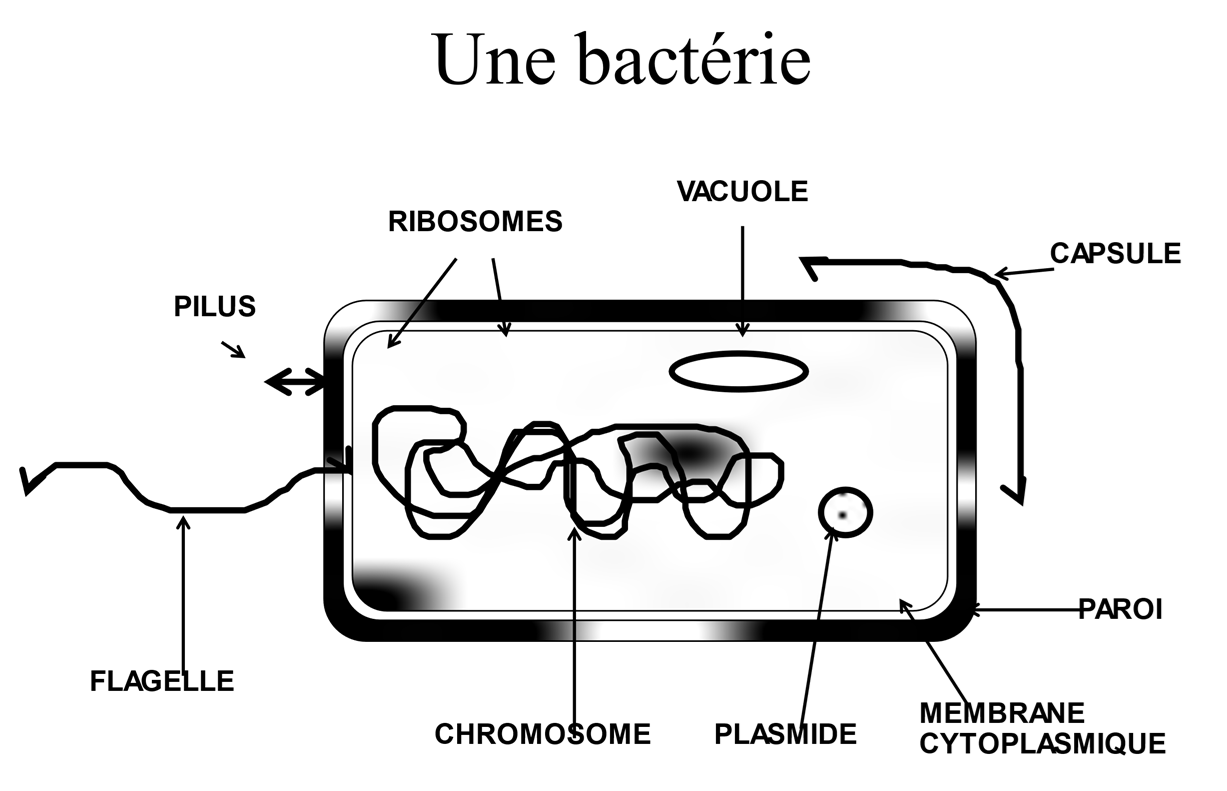
Figure 1
Comme on va le voir, les bactéries savent, depuis toujours, trouver des parades à tout ce qui peut perturber leur développement [3], et en particulier la présence d'agents antimicrobiens.
Elles peuvent devenir Résistantes (R) : la résistance aux antibactériens étant définie comme la capacité d'une bactérie à se multiplier en présence d'une concentration d'antibiotique supérieure à celle que l'on peut obtenir in vivo(i). Cela peut conduire à un échec thérapeutique.
Comment déterminer si une bactérie est sensible ou résistante ?
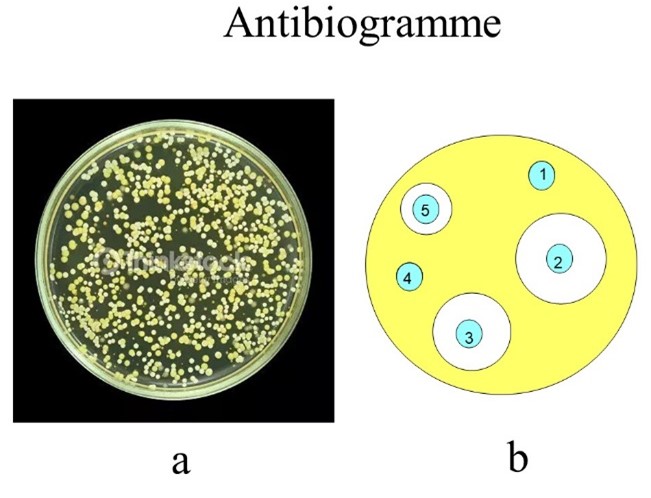
En cas d'infection persistante malgré un traitement approprié, ou dans les cas graves, le médecin fait un prélèvement(ii) et demande au laboratoire de réaliser un antibiogramme. Le principe est de cultiver la bactérie en présence de divers antibactériens et de voir si elle « pousse » ou si sa croissance est inhibée.
Il existe diverses méthodes plus ou moins automatisées, mais la plus simple à comprendre est d'opérer en boite de Pétri(iii). Sur un milieu nutritif et solide placé à 37°C pendant 15 à 24h les bactéries se développent (fig. 2a). Si avant de mettre à l'étuve on pose sur la boîte des disques de papier imprégnés de quantités standardisées de chaque antibactérien à tester, le diamètre d'inhibition de pousse autour de chaque disque indique le niveau de sensibilité de la souche à l'antibactérien : un contact indique que la résistance est élevée (fig. 2b). Ainsi, la bactérie représentée en jaune est très résistante (R) aux produits 1 et 4, résistante à 5 et sensible (S) à 2 et 3. On appelle Concentration Minimale Inhibitrice ou CMI la concentration d'antibactérien la plus faible pour laquelle il n'y a pas de croissance visible. Cette expérience est une expérience in vitro (fig. 3).
Figures 2a et 2b
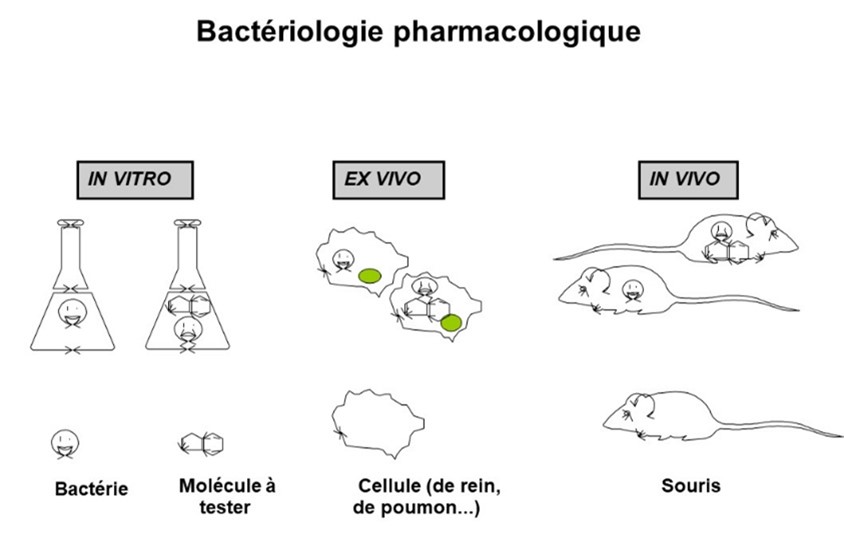
Figure 3
Résistance naturelle
C'est une propriété commune à toutes les bactéries d'une même espèce, due le plus souvent à la nature des enveloppes de la bactérie (fig. 4). Chez les bactéries Gram -, le peptidoglycane est entouré d'une membrane externe asymétrique, dont la partie extérieure, le lipopolysaccharide(iv), empêche la pénétration des molécules hydrophobes à cause de la chaîne de sucres, et celle des hydrophiles à cause de la partie lipidique. Ce n'est que par des canaux emplis d'eau, les porines, que les antibactériens hydrophiles peuvent entrer. Certaines bactéries ont des porines très étroites – c'est le cas des mycobactéries – qui restreignent encore le passage, d’où une résistance importante.
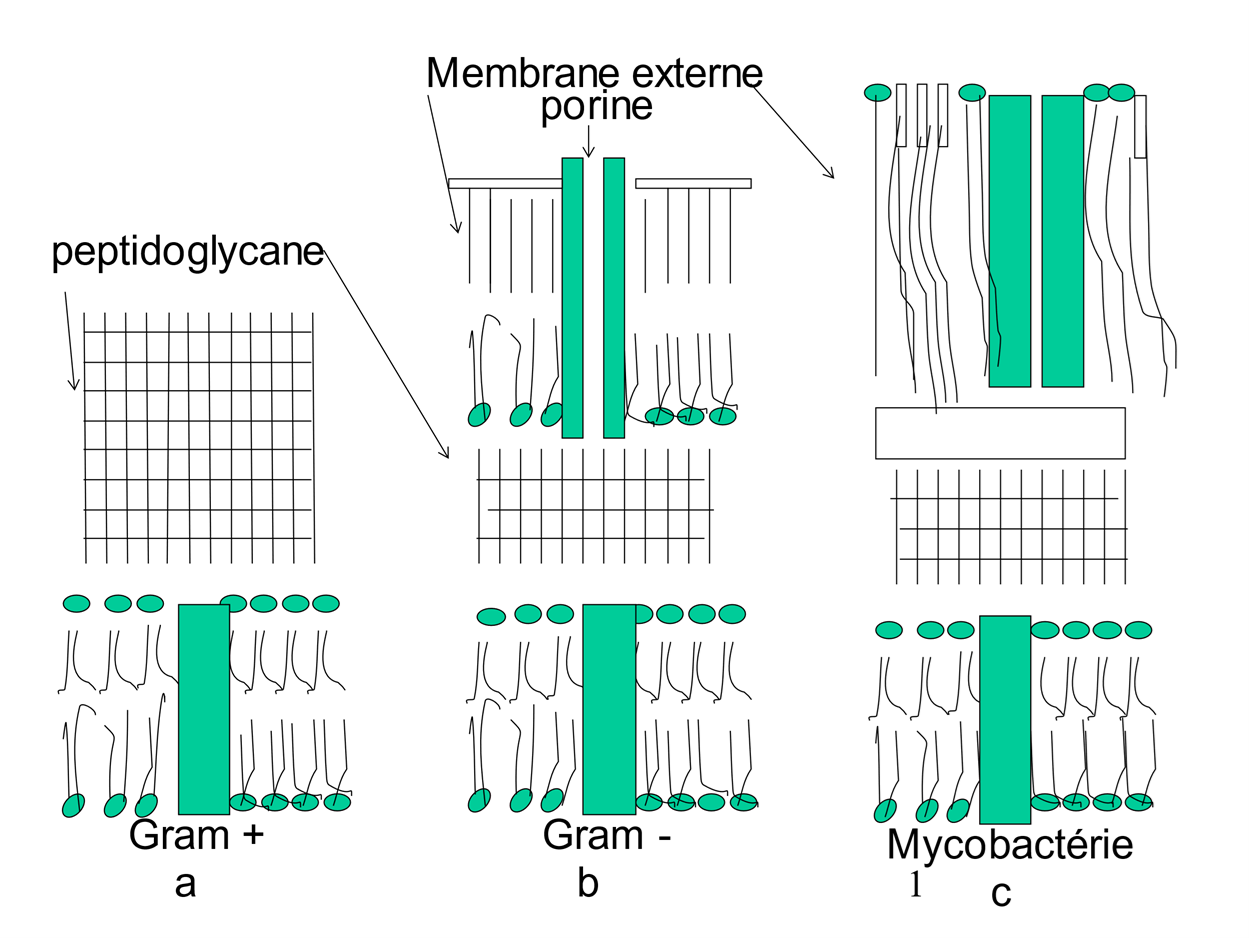
Figure 4
Résistance aux antibactériens
La chimie des médicaments [4] et l’usage des antibactériens a révolutionné la mortalité par infection et à la fin des années 1960, le problème des infections bactériennes semblait résolu. Mais l’évolution naturelle des bactéries dans un environnement contenant des antibactériens les a conduites à développer des mécanismes de résistance, processus accru par l’usage inconsidéré des agents antibactériens. C’est un problème général auquel la France est bien loin d'échapper [5]. Chaque année en Europe, l'antibiorésistance provoque 30.000 morts, et la morbidité est aussi importante que celle de la grippe, de la tuberculose et du VIH/SIDA combinés. À côté du problème de la résistance proprement dite, les conséquences de l'usage accru des antibiotiques sont la multirésistance (une bactérie devient résistante à plusieurs antibactériens de familles différentes), la contamination de l'environnement par les antibactériens et leurs métabolites(v), qui finiront par être ingérés par les humains et les animaux, contaminant encore plus l'environnement. Concernant les antibiotiques donnés aux animaux soit pour raison prophylactique, soit comme stimulant de la croissance, cet usage est interdit en Europe, mais toujours existant aux États-Unis.
Les voyages plus fréquents, les rassemblements, facilitent la dispersion des germes résistants, par simple contact, hors infection. Enfin, les progrès de la médecine ont accru le nombre de personnes fragiles : personnes âgées, immunodéprimées (greffées), pathologies chroniques, porteurs de prothèses... Même la tuberculose, qui semblait éradiquée en France, s'y rencontre à nouveau.
N'oublions pas que la plupart des antibactériens sont d'origine microbienne, ce qui facilite la mise en œuvre de mécanismes de résistance préexistant(vi).
Mécanismes moléculaires de la résistance
Les principaux mécanismes sont schématisés figure 5 :
- empêcher la pénétration de l’antibactérien : modification des porines (Gram -) de la membrane externe
- éjecter l’antibactérien : pompes d’efflux (fig. 6) dans la membrane interne
- modification de l’antibactérien, qui ne sera plus actif : enzymes d’inactivation (fig. 7 pour la pénicilline)
- modification de la cible :
- plus grande quantité de cible, rendant la quantité d'antibactérien insuffisante,
- mutation de la cible, qui ne sera plus reconnue et fonctionnera à nouveau normalement.
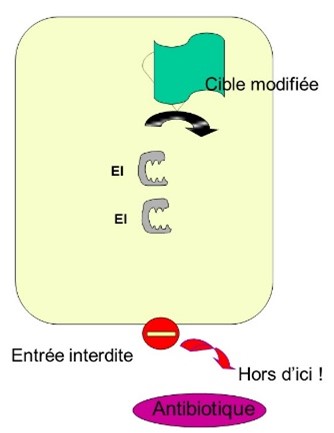 | 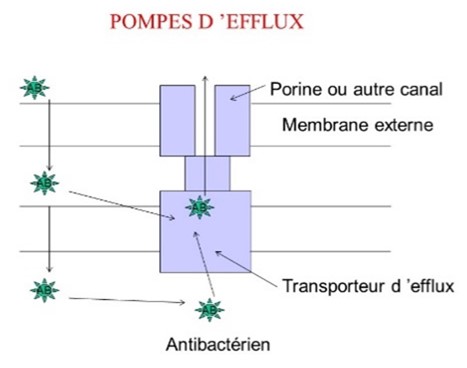 |
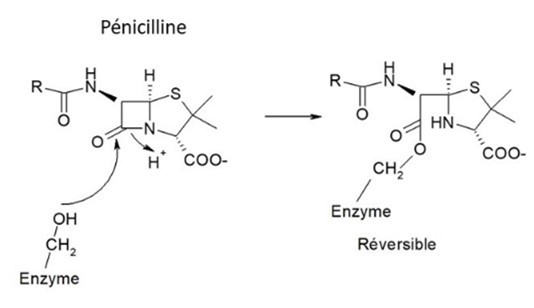
Figure 7
Bases génétiques de la résistance
Toute propriété est codée au niveau de l'ADN. Si le phénomène conduisant à la résistance est porté par le chromosome seuls les bactéries filles sont résistantes(vii).
Mais il existe des éléments mobiles, c'est à dire des fragments d'ADN autres que le chromosome, les plasmides par exemple (fig. 8), qui, s'ils codent pour la résistance, peuvent permettre sa dissémination rapide entre diverses bactéries. La figure10 montre que le plasmide d'une bactérie résistante « bleue » peut se dupliquer, puis une copie est transférée par contact avec une bactérie sensible « jaune », qui deviendra alors résistante.
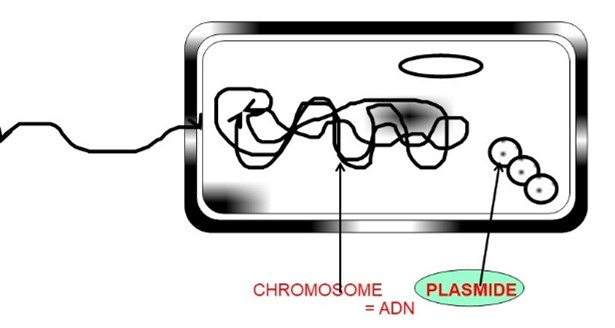
Figure 8
.png)
Figure 9
En conclusion, on voit que le problème de la lutte contre les infections est loin d'être résolu, qu'il faut que patients et prescripteurs sachent être raisonnables en respectant la consigne de la campagne d’information « les antibiotiques, c’est pas automatique », [6] et que l'industrie pharmaceutique ne néglige plus la recherche en antibiothérapie [4] [5].

(i) In vivo : sur un animal vivant ; in vitro : dans un tube à essais; ex vivo : sur un organe ou une cellule isolée.
(ii) Gorge, prélèvement d'urine, de crachat ou intervention plus invasive.
(iii) Du nom du bactériologiste allemand Julius Richard Petri (1852–1921), qui était l'assistant du docteur Robert Koch (découvreur du bacille de la tuberculose) et grand rival de Louis Pasteur : voir le livre « Peste et Choléra » de Patrick Deville.
(iv) Le mot lipopolysaccharide est composé de « lipo » : lipide et "saccharide": sucre.
(v) Quand on donne un médicament à un être vivant, son organisme le transforme (on dit « le métabolise ») en une molécule capable d'être éliminée, appelée métabolite.
(vi) Le producteur d'antibiotique ne doit pas être détruit par les molécules qu'il fabrique !
(vii) Ces bactéries filles coexistent au sein d’une population où il y a d'autres bactéries de même espèce, mais qui n'ont pas développé de résistance.
Pour en savoir plus
[1] Parasite, champignon, bactérie et virus : quelles différences ?, N. J. Moreau, Question du mois, Mediachimie.org (2020)
[2] Zoom sur les bactéries et antibactériens, N. J. Moreau, Zoom sur..., Mediachimie.org (2023)
[3] On regardera avec intérêt Bactéries, nos amies ? CERIMES (1 janvier 1990) Canal-u.tv
[4]Chimie et médicaments : un bel avenir !, B. Meunier, Colloque chimie et nouvelles thérapies (novembre 2019)
[5] Comment vaincre la résistance aux maladies infectieuses ?,B. Meunier, V. Jarlier et Ph. Guérin - article en partenariat Académie des sciences et le Figaro (mai 2013)
[6] Les antibiotiques : des médicaments essentiels à préserver, sur le site de la MGEN (novembre 2022)
Crédits :
- illustration : Image par OpenClipart-Vectors de Pixabay
- figures : © NJ Moreau
La bactérie
Une bactérie [1] est une cellule très simple, « un sac » qui renferme tout ce qui est nécessaire à sa survie (fig. 1).

Figure 1
Il n’y a aucun compartiment et en particulier pas de noyau. C’est ce que l’on appelle un procaryote. Toutes les autres cellules, de la levure de boulanger à nos propres cellules sont des eucaryotes, elles possèdent un noyau [1]. C’est très important, car cela peut permettre de trouver des molécules spécifiques contre les bactéries sans trop de dommages pour les cellules de l’hôte, dont l'ADN est à l'abri dans le noyau.
Ce « sac » est une enveloppe constituée d'une membrane interne, composée essentiellement de lipides, mais dans laquelle peuvent s'insérer des protéines ou d'autres éléments. Elle est protégée par une paroi dont le principal élément est le peptidoglycane. C'est un polymère formé de longues chaînes de sucres pontées par de courtes chaînes peptidiques. On admet qu'il contribue à la forme et la rigidité de la bactérie et protège la membrane interne des effets de la pression osmotique(i). On peut le schématiser comme un gros grillage relativement facile à franchir (fig. 2). La taille d'une bactérie est de l'ordre de 1µm.

Figure 2
Les bactéries sont apparues sur terre il y a 3 milliards d'années(ii). On connaît environ 5000 espèces bactériennes, dont quelques dizaines sont pathogènes. On distingue deux types de bactéries, dites à Gram positif (Gram +) ou à Gram négatif(iii) (Gram -). Les Gram + (fig. 2a) ont une épaisse couche de peptidoglycane. Chez les Gram - (fig. 2b) le peptidoglycane est plus mince, mais est entouré d'une membrane externe complexe et difficile à franchir, sauf par des canaux hydrophiles, les porines, servant à l'entrée des nutriments.
On a aussi les mycobactéries, responsables de la tuberculose, de la lèpre, particulièrement bien protégées par leur enveloppe complexe et riche en lipides (25% environ, contre 1 à 2% pour les autres bactéries) (fig. 2c). En outre, leurs porines sont particulièrement étroites.
L'infection
Les bactéries sont responsables d'infections quand elles pénètrent et se multiplient dans un endroit de l'organisme où elles ne devraient pas être. Cela correspond à une rupture de l’équilibre entre bactérie et moyens de défense de l’hôte. Une infection peut être localisée(iv), locorégionale(v), septicémique(vi). On peut aussi les classer en infections communautaires(vii), et nosocomiales(viii).
L'infection peut être plus ou moins grave selon l'hôte infecté : une banale coupure nettoyée par lavage à l'eau et au savon sera sans conséquence pour un adulte en bonne santé, mais il existe de plus en plus de personnes à risque par suite des progrès de la médecine : personnes de plus en plus âgées, immunodéprimées (ayant subi une greffe par exemple), porteuses de prothèses, souffrant de maladies chroniques... La gravité dépendra aussi de la nature et des propriétés du germe infectieux : faculté d'adhérer aux cellules de l'hôte(ix), excrétion de toxines, capacité de survie dans la cellule infectée...
La lutte contre ces bactéries sera une véritable guerre sans merci, puisque, malgré les nombreuses armes dont nous disposons (les antibactériens), l'ennemi (la bactérie) possède une faculté de dissémination considérable, certaines pouvant se diviser toutes les 20 minutes ! En outre, elle possède plusieurs stratagèmes pour résister à nos armes [2]. Les bactéries communiquent entre elles, et communiquent aussi avec les cellules eucaryotes. Elles sont ainsi capables de maîtriser leur environnement pour y survivre ou s'y multiplier.
Les antibactériens
Quand on parle de la lutte contre les bactéries, il vaut mieux utiliser le terme d'antibactériens, bien spécifique, plutôt que celui plus couramment utilisé d'antibiotiques qui désigne les substances capables de combattre les microbes en général (bactéries, virus, parasites, champignons...). Par définition, les agents antibactériens inhibent la croissance bactérienne (on dit qu'ils sont bactériostatiques), ou tuent les bactéries (bactéricides).
Les figures 3 et 4 montrent quelques antibactériens importants. On pense souvent que la pénicilline est le premier antibactérien connu. En fait, très tôt, certains composés étaient utilisés contre les infections : eau de Javel(x) comme désinfectant [3], mercure contre la syphilis ; dès 1897, le médecin militaire Ernest Duchesne a traité avec succès des porcs atteints de typhoïde porcine par la moisissure Penicillium glaucum(xi). En 1911, avec le chimiste Alfred Bertheim et le bactériologiste Sahachiro Hata, Paul Ehrlich met au point le Salvarsan, actif contre la syphilis. En 1936, à l'Institut Pasteur de Paris, Thérèse et Jacques Tréfouël [4] synthétisent les sulfamides (fig 2), actifs contre de nombreux germes. Quant à la pénicilline, découverte par sérendipité [5] en 1928 par Fleming, son intérêt thérapeutique n'apparut que vers 1939(xii).
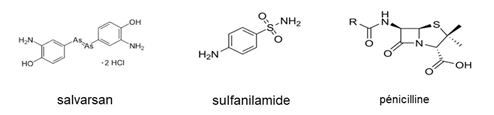
Figure 3. Antibactériens découverts par sérendipité
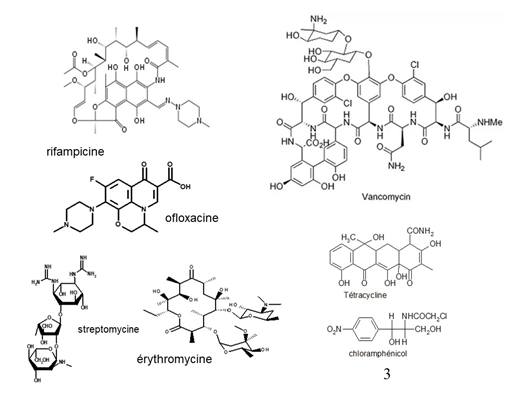
Figure 4. Exemples d’antibactériens
Le tableau 1 montre les dates d'apparition des principaux antibactériens, et leur origine. La plupart sont d'origine naturelle, mais des dérivés sont ensuite préparés par synthèse totale ou par hémisynthèse(xiii).
Pour combattre une infection, un antibactérien doit :
- entrer dans la bactérie et ne pas en être expulsé ;
- échapper à des mécanismes d'inactivation (enzymes) ;
- atteindre sa cible et la perturber en causant un dommage à la bactérie.
Cibles des antibactériens
Selon l'antibactérien, ce sont différents processus indispensables à la vie d'une bactérie que les antibactériens peuvent inhiber :
- Inhibition de la synthèse du peptidoglycane : la bactérie ne pourra plus fabriquer son enveloppe
- β lactames (pénicilline) et glycopeptides (vancomycine) ;
- Inhibition de la synthèse des acides nucléiques : la bactérie ne peut plus se multiplier
- ARN : rifampicine,
- ADN : quinolones (ofloxacine).
- Inhibition de la synthèse des protéines : la bactérie ne fabrique plus de protéines ou en produit de défectueuses. Elle n'aura plus les enzymes nécessaires à son métabolisme, par exemple :
- aminoglycosides (streptomycine),
- macrolides (érythromycine),
- tétracyclines,
- chloramphénicol.
En conclusion, même si nous disposons comme on le voit, d'un important arsenal chimique [6] pour lutter contre les maladies et en particulier les infections, la bataille est cependant difficile, des maladies comme la tuberculose, que l'on pensait quasiment éradiquée, continuent à exister, même dans les pays développés. Et il faut en plus compter avec la résistance que les bactéries peuvent développer. Sur ce sujet, consultez le Zoom sur la résistance des bactéries aux antibactériens.
Tableau 1 : Apparition de quelques antibactériens
| Classe | Date de la découverte → date d'élucidation de la structure | Origine |
| β-lactames: pénicillines | 1929 → 1945 | F |
| Sulfonamides | 1936 | S |
| Aminoglycosides | 1944 → 1947 | F |
| Phénicolés (chloramphénicol | 1948 → 1949 | F S |
| Peptides | 1948 → 1964 | F |
| β-lactames: céphalosporines | 1948 → 1961 | F |
| Macrolides | 1952 → 1965 | F |
| Tétracyclines | 1953 → 1962 | F |
| Streptogramines | 1955 → 1966 | F |
| Nitro imidazoles | 1960 | S |
| Rifampicine | 1960 → 1973 | F |
| Lincosamides | 1962 → 1964 | F |
| Acide fusidique | 1962 → 1965 | F |
| Quinolones | 1962 | S |
| Triméthoprime | 1962 | S |
| Glycopeptides | 1962 → 1983 | F |
| Fosfomycine | 1969 → 1969 | F S |
| Inhibiteurs de β-lactamases | 1975 → 1976 | F S |
| β-lactames: carbapénèmes | 1976 → 1978 | F S |
| Monobactames | 1979 → 1981 | F S |
F: obtenu par fermentation (produit naturel)
S: obtenu par synthèse
.jpg)
E. coli
(i) Pression qui détermine le phénomène d'osmose et qui correspond à la différence de pressions exercées de part et d'autre d'une membrane semi-perméable par deux liquides de concentration différente.
(ii) Les premiers hommes il y a seulement 10 millions d'années.
(iii) Hans Gram est un bactériologiste danois de la seconde moitié du XIXe siècle, qui a mis au point une coloration permettant de distinguer grâce à leur membrane deux types de bactéries : celles à Gram positif (Gram +) se colorent en rose, celles à Gram négatif (Gram -) ne se colorent pas.
(iv) Par exemple sur un doigt.
(v) Tout le membre.
(vi) Diffusée à tout l'organisme à partir du foyer initial : très grave.
(vii) Survenant à l'extérieur d'un établissement de santé.
(viii) Qui n'existaient pas chez le malade à son entrée à l'hôpital.
(ix) Lors d'une infection urinaire, on recommande de boire beaucoup : ainsi, si les germes infectieux sont peu adhérents, ils seront facilement éliminés.
(x) Hypochlorite de sodium, dont la découverte est attribuée à Claude Louis Berthollet en 1775, dans son usine du quartier de Javel à Paris.
(xi) Il a publié ce résultat sans savoir quelle substance était produite par son Penicillium.
(xii) On reverra avec intérêt le film « Le troisième homme ».
(xii) En partant de la molécule naturelle ou d'un précurseur.
Pour en savoir plus
[1] Parasite, champignon, bactérie et virus : quelles différences ?, N. J. Moreau, Question du mois, Mediachimie.org (2020)
[2] On regardera avec profit et plaisir la vidéo Bactéries, nos amies ? CERIMES (1 janvier 1990) Canal-u.tv
[3] Pourquoi ne pas mélanger de l’eau de Javel et du détartrant ?, F. Brénon,Question du mois, Mediachimie.org (2022)
[4] Thérèse et Jacques Tréfouël, le binôme indissociable, Institut Pasteur - Notre histoire
[5a] Il était une fois la sérendipité, S. Allemand et S. Catellin, Le Media Paris-Saclay (2014)
[5b] La sérendipité, un chemin de traverse à suivre, C. Monneret L'Actualité Chimique n°385 (mai 2014)
[6] Chimie et médicaments : un bel avenir !, B. Meunier, Colloque chimie et nouvelles thérapies (novembre 2019)
Crédits :
- illustration E. coli : Image par Gerd Altmann / Pixabay
- figures : © NJ Moreau
Actuellement en France, un homme sur deux et une femme sur trois seront atteints d’un cancer dans leur vie… on dénombre environ 380.000 nouveaux cas de cancer par an et on enregistre 140.000 décès ! [1].
Le cancer est une maladie complexe qui résulte d’une prolifération anormale des cellules. Comme chacun sait, il n’y a pas un cancer mais des cancers et ceci impose donc de posséder des stratégies curatives adaptées à chaque type de cancer. Les principales stratégies utilisées dans le traitement des cancers sont la chirurgie, la radiothérapie, la chimiothérapie, les thérapies ciblées, et l’immunothérapie.
La chimiothérapie est la méthode la plus ancienne utilisée pour essayer de détruire les cellules tumorales par administration de médicaments dits « cytotoxiques ». Ces médicaments peuvent agir sur différents processus impliqués dans la multiplication des cellules.
D’abord certains médicaments empêchent la réplication de l’ADN et sa transcription en ARN et peuvent être par exemple : 1) des agents alkylants (chlorméthine) 2) des intermédiaires électrophiles (dérivés du platine) 3) des intercalants entre les bases nucléiques dans la double hélice de l’ADN (daunorubicine). On utilise aussi des antimétabolites (5-fluoro-uracile) qui s’incorporent dans l’ADN à la place des bases nucléiques de l’ADN. On emploie parfois des inhibiteurs enzymatiques empêchant des réactions conduisant au développement des cellules (méthotréxate).
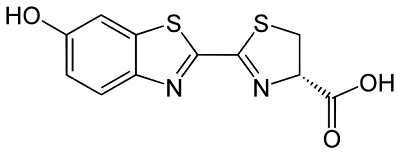
Enfin d’autres molécules altèrent la mitose (division cellulaire) ; ce sont des alcaloïdes comme la vinblastine, la navelbine ou des hétérocycles comme le taxotère. Ces dernières molécules se sont révélées très efficaces contre les cancers du sein mais aussi du poumon et ont été synthétisées par l’équipe de Pierre Potier dès les années 80 à l’ICSN de Gif-sur-Yvette dans la région parisienne [2].
Un protocole de chimiothérapie fait souvent appel à une association de plusieurs médicaments qui agissent sur ces différents processus. Les chimiothérapies sont souvent redoutées en raison de leurs effets secondaires (chute des cheveux, nausées, vomissements, baisse du nombre de cellules sanguines…). En effet, ces molécules s’attaquent aux cellules en développement rapide telles que les cellules tumorales mais aussi aux cellules saines qui se multiplient activement comme celles des cheveux, du sang ou des muqueuses digestives. Plus récemment des approches plus spécifiques des cellules tumorales ont été développées.
Les thérapies ciblées constituent une autre famille de traitements du cancer le plus souvent disponibles par voie orale. En ciblant spécifiquement certaines molécules de l’organisme, elles bloquent des mécanismes qui sont indispensables à la prolifération des cellules cancéreuses ou, plus globalement, au développement de la tumeur. Certains agissent sur les cellules cancéreuses à proprement parler et d’autres sur les cellules du micro-environnement tumoral, par exemple en bloquant la formation des vaisseaux sanguins qui irriguent une tumeur solide (médicaments antiangiogéniques) ou en activant des cellules immunitaires (immunothérapie). Selon les cancers, les thérapies ciblées peuvent être prescrites seules, en association entre elles ou avec d’autres traitements [3]. En éliminant avant tout les cellules porteuses de l’anomalie moléculaire ciblée, ces thérapies sont généralement mieux tolérées que les chimiothérapies conventionnelles mais elles ne sont pas exemptes d’effets indésirables.
L’immunothérapie regroupe un ensemble de stratégies visant à mobiliser ou à renforcer les défenses immunitaires des patients de manière à ce qu’elles s’attaquent aux cellules tumorales.
L’immunothérapie « spécifique » consiste à bloquer spécifiquement des protéines à la surface des cellules cancéreuses ou dans leur micro-environnement pour freiner la croissance tumorale. Elle repose notamment sur l’utilisation d’anticorps monoclonaux (les anticorps sont des protéines produites par le système immunitaire pour neutraliser et signaliser des éléments anormaux présents dans l’organisme). Un anticorps monoclonal est spécifique d’une seule cible, il se lie fortement à l’antigène (un antigène est une molécule toxique (virus, bactérie…), présente dans l’organisme (sang) qui stimule une réponse immunitaire). Les anticorps monoclonaux sont des anticorps qui n’existent pas naturellement dans l’organisme. Ils sont produits en laboratoire à partir de cellules-mères (animales) sélectionnées en culture à partir de levures ou de bactéries pour bloquer des mécanismes spécifiques, essentiels aux cellules cancéreuses. Cette méthode a fait l’objet de l’attribution du Prix Nobel de Médecine en 1984 au britannique César Milstein, au danois Niels Jerne et au suisse Georges Köhler. De nombreux anticorps monoclonaux sont sur le marché ; ils reconnaissent des protéines de surface spécifiques de la cellule tumorale et bloquent leur activité conduisant à la mort de la cellule et la reconnaissance de cette cellule par le système immunitaire. Historiquement, les premiers exemples de cette classe de traitements sont le bevacizumab, un « antiangiogénique » (il bloque le signal qui stimule la production de nouveaux vaisseaux sanguins dans les tumeurs) et le trastuzumab, un « anti HER2 » utilisé avec succès notamment pour traiter les cancers du sein dits HER2 positifs [4].
Une autre stratégie consiste à réactiver les lymphocytes T (globules blancs fabriqués dans le thymus (T), glande située à la base du cou) du système immunitaire qui sont désactivées par certaines cellules tumorales.
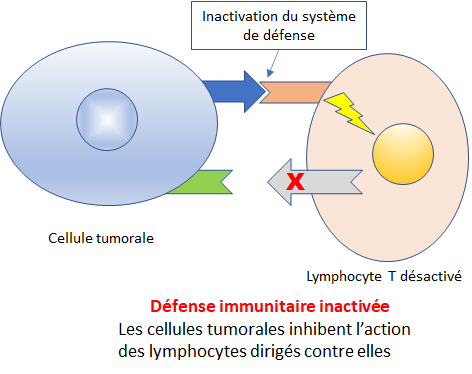
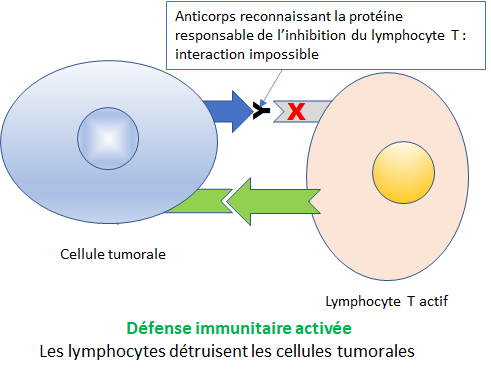
L’administration d’un anticorps monoclonal dirigé contre les protéines de la cellule tumorale qui inhibent l’activité des cellules T permet de retrouver un système immunitaire actif qui détruit la cellule tumorale.
Les immunoconjugués
Le concept est de « marier » la spécificité des anticorps monoclonaux à la puissance d’un agent anticancéreux pour augmenter l’efficacité de l’un et l’autre et diminuer les effets secondaires si possible. Ces immunoconjugués (en français) ou antibody-drugs conjugates (ADC) (en anglais) sont des « prodrogues » constituées par une molécule toxique (cytotoxique, toxine ou élément radioactif), et un anticorps qui sont reliés par un lien chimique (« linker » en anglais) réalisé par des liaisons chimiques covalentes.
Le mécanisme d’action de ces immunoconjugués est : 1) la fixation de l’anticorps sur la surface de la cellule cancéreuse grâce à une interaction anticorps-antigène, 2) l’endocytose (pénétration) dans le cytoplasme de la cellule conduisant à une structure appelée endosome accompagnée d’une acidification du milieu, 3) une coupure du lien par des enzymes permettant de libérer la molécule cytotoxique dans la cellule cancéreuse.
Signalons que les molécules cytotoxiques utilisées doivent être 100 à 1000 fois plus puissantes que les molécules classiques de la chimiothérapie car le greffage des molécules cytotoxiques sur l’anticorps est limité pour des raisons stériques à un certain nombre.
L’agent de liaison joue un rôle primordial, il doit : 1) être suffisamment stable pour éviter la libération de l’agent cytotoxique dans le sang ce qui conduirait à des effets toxiques indésirables, 2) permettre la libération de l’agent toxique uniquement dans la cellule cancéreuse. La réunion de la molécule antitumorale avec l’anticorps s’effectue par un lien chimique fonctionnalisé. Une fonction de ce lien permet une réaction avec certaines fonctions polaires de l’agent antitumoral et, du côté anticorps, une autre fonction du lien va réagir avec certains acides aminés de l’anticorps tels que des lysines ou cystéines. Les liaisons sont de type peptidique donc hydrolysables par des enzymes ou de type ponts disulfures qui peuvent alors être réduits[5]. L’immunoconjugué, grâce à la reconnaissance spécifique d’une protéine de surface de la cellule tumorale amène l’agent toxique majoritairement sur les cellules tumorales ciblées évitant ainsi les effets sur les cellules saines [6].
Une autre technique pour éviter les effets indésirables est que les immunoconjugués peuvent être encapsulés dans des microgouttelettes (utilisation de la microfluidique pour produire les microgouttelettes), qui sont injectées par voie intraveineuse et acheminées vers la tumeur grâce au flux sanguin. Le largage de l’immunoconjugué se fait au niveau de la tumeur grâce à des ultra-sons à l’endroit voulu et au moment voulu, la tumeur étant repérée grâce à un échographe. C’est ce qui a été réalisé, en particulier, avec la prodrogue [monométhylauristatine]. Les immunoconjugués actuellement en essai clinique ainsi que la mise au point de nouvelles techniques [7] permettent d’envisager des activités antitumorales sur les cancers du sein de grade élevé et des leucémies aigües avec une bonne efficacité et en minimisant les effets secondaires.
NB : L’auteur tient à remercier vivement Nicole Moreau, Janine Cossy et Jean-Marc Paris pour leurs aides à la rédaction de ce texte et leurs encouragements.
Références bibliographiques
[1] Biologie de synthèse : une nouvelle voie pour le traitement du cancer, C de Obaldia, colloque Chimie et Biologie de synthèse (14 février 2018), conférence et article (Mediachimie.org)
[2] Recherche et découverte de nouveaux médicaments antitumoraux : la Navelbine et le Taxotère, P. Potier, L'Actualité Chimique (janvier-février 1995) n° 185 p. 5
[3] Les anticorps monoclonaux : un fantastique arsenal thérapeutique en plein devenir, M. Fougereau, medecine/sciences (2009) 25:997–998
[4] Petites et grosses molécules innovantes dans le traitement des cancers, J.-P. Armand, colloque Chimie et nouvelles thérapies (13 novembre 2019), conférence et article (Mediachimie.org)
[5] Un point sur : Les immunoconjugués en oncologie (fiche 45) L. Gauzy-Iazo, L'Actualité Chimique (décembre 2016) n° 413 p. 63
[6] La montée en puissance des immunoconjugués en oncologie, Une liaison réussie entre un anticorps et une petite molécule cytotoxique, E. Vigne et I. Sassoon, medecine/sciences (2014) 20:855-863
[7] Nature et chimie : des alliées pour accéder à de nouveaux médicaments, J. Cossy, colloque Chimie et nouvelles thérapies (13 novembre 2019), conférence et article (Mediachimie.org)
Crédit illustration : Catharanthus roseus, Vengolis, CC BY-SA 4.0, WikiMedia
