Décidément la prestigieuse académie suédoise est séduite par l’intelligence artificielle. Après le prix Nobel de physique décerné à deux spécialistes des réseaux de neurones en électronique avancée, le prix Nobel de chimie a récompensé des chercheurs qui se sont servis de l’intelligence artificielle pour transformer les recherches sur les structures tridimensionnelles des protéines. La moitié du prix a été décerné à 2 spécialistes, un anglais Demis Hassabis et un américain John Jumper qui appartiennent tous deux à l’entreprise Google DeepMind pour y avoir développé un programme d’IA nommé « AlphaFold » qui permet de prédire la structure complexe des protéines à partir de données sur des acides aminés. L’autre moitié du prix revient à David Baker, un biochimiste de l’université Washington à Seattle, qui réussit à concevoir des protéines entièrement nouvelles.
Ces découvertes ont une importance primordiale en biologie, car les protéines sont les molécules de la vie, elles sont dans les muscles qui nous donnent la force, dans les anticorps qui nous protègent des maladies et aussi dans celles qui lisent et copient l’ADN.
On se rappelle tous les études des structures par cristallographie à Grenoble à l ESRF ou à Saclay sur SOLEIL complétées par RMN, elles pouvaient prendre plusieurs mois. Ces travaux menés depuis plus de 40 ans dans tous les pays ont permis de nourrir une base de données internationale qui contient plus de 200 000 protéines avec leurs structure. C’est le fruit de plusieurs décennies de recherche, mais c’est encore peu en comparaison des 100 fois plus de protéines existant dans la nature.
Les protéines sont comme des chaines ou des colliers dont les maillons ou les perles sont des acides aminés. La façon dont elles s’enroulent est très importante, on parle de repliement de la protéine, qui lui donne ses propriétés. Avec le programme Alphafold en rentrant une séquence d’acides aminés, l’IA donne la structure tridimensionnelle de n’importe quelle protéine.
David Baker procède presque à l’inverse du programme Alphafold de ses collègues de Google Deepmind. On propose une structure 3D que l’on veut produire et son programme optimise la séquence d’acides aminées qui pourrait donner une protéine stable. C’est ainsi qu’il a développé une protéine nouvelle capable de bloquer la protéine Spike responsable du Covid-19. On voit là un champ immense qui s’ouvre pour la recherche de nouveaux médicaments en sachant l’importance des formes des récepteurs pour affuter des protéines sachant les copier afin d’annihiler les protéines dysfonctionnelles que nous avons dans notre corps lors d’une maladie.
La Fondation de la maison de la chimie avait déjà bien perçu l’importance de l’IA pour la chimie ; elle avait sensibilisé en février 2023 le grand public et les jeunes lycéens sur ce sujet brûlant au sein d'un colloque Chimie et Intelligence artificielle. Citons notamment les 2 conférences plénières de François Xavier Coudert, directeur de recherche CNRS, professeur attaché ENS – Université PSL, et de Carlo Adamo, Directeur Institute of Chemistry for Life and Health Sciences (i-CLeHS) – Chimie ParisTech, et la conférence de clôture de Cédric Villani, Université Lyon I, Institut des Hautes Études Scientifiques.
L’intelligence artificielle en recherche ne remplace pas le chercheur mais elle lui permet de manipuler des millions de données en un temps record c’est un accélérateur de découvertes !
Jean-Claude Bernier
Octobre 2024
Pour en savoir plus
Colloque Chimie et intelligence artificielle, Fondation de la maison de la chimie, février 2023, accès aux videos et articles des conférences sur Mediachimie.org
Concepts d’IA et Machine Learning ; utilisation en chimie ; les méthodes d’IA comme nouveau langage, François Xavier Coudert, article et vidéo, Colloque Chimie et intelligence artificielle, Fondation de la maison de la chimie, février 2023
L’Intelligence Artificielle comme moteur dans la recherche en chimie, Carlo Adamo, article et vidéo, Colloque Chimie et intelligence artificielle, Fondation de la maison de la chimie, février 2023
Intelligence artificielle pour la science et l’industrie, Cédric Villani, article et vidéo, Colloque Chimie et intelligence artificielle, Fondation de la maison de la chimie, février 2023
L'intelligence artificielle, un moteur dans la recherche en chimie !, Éric Bausson, Fiche Chimie et… en fiches lycée, Mediachimie.org
La Fête de la science 2024 se tiendra en France métropolitaine du 4 au 14 octobre. La thématique mise à l’honneur cette année est « Océan de savoirs ».
Des milliers de scientifiques, enseignants, médiateurs culturels, bibliothécaires partagent avec les publics leur enthousiasme et leur curiosité pour les sciences, les techniques et les innovations à travers de multiples animations. Les activités proposées par chaque région de France et d’Outre-mer sont consultables sur le site https://www.fetedelascience.fr/.
Mediachimie.org accompagne également cette fête de la science 2024 en vous proposant une sélection de ressources en relation avec cette thématique : voir la page Eau et Chimie.
N’oubliez pas de vous inscrire au colloque Chimie et eau du 6 novembre à la Fondation de la maison de la chimie : Colloque Chimie et eau - mercredi 6 novembre 2024. Le colloque sera également retransmis en direct toute la journée sur la chaîne YouTube de mediachimie.org.
Crédit : llustration : Capture écran site fetedelascience.fr
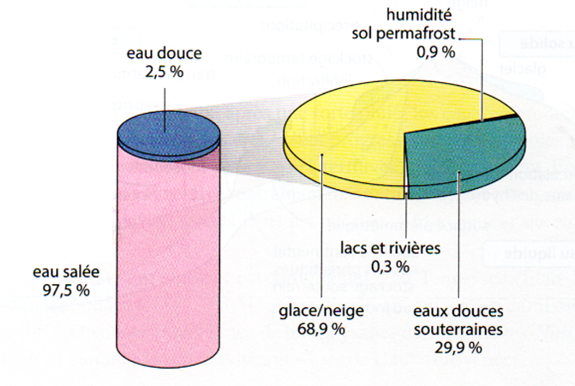
Quoi de plus simple et anonyme que la molécule H2O, elle est pourtant vitale (1). Notre corps en contient plus de 65% soit 45 litres si vous pesez 70 kg. Sur notre bonne vieille planète l’eau est essentiellement sous forme d’eau salée, 97,5% (mer et océans), et l’eau douce ne représente donc que 2,5%. Mais seulement 30% de cette eau douce constitue les nappes phréatiques et les rivières, le reste étant sous forme de glace ou de neige.
En France ce sont des milliers de rivières, fleuves, cours d’eau et ruisseaux qui serpentent sur 500 000 km et sous nos pieds 2000 milliards de m3 sont stockés dans nos nappes phréatiques. Sans eau il n’y a pas de vie et on sait quel rôle essentiel elle joue dans notre alimentation, nos sources d’énergie (2) et notre industrie. Rien d’étonnant alors que les épisodes de sécheresses, de cumuls de précipitations, de pollutions, de pressions agricoles et urbaines trouvent de larges échos dans les médias et l’opinion. Pour répondre à ces problèmes y a t-il encore de la recherche sur les technologies liées à l’eau ? Essayons par trois exemples d’esquisser une réponse.
La lutte contre les espèces exotiques envahissantes
C’est un véritable fléau à l’échelle mondiale ! Ces espèces étouffent la vie aquatique, gênent l’écoulement dans les rivières et canalisations et sont sources de dégâts à l’environnement et de pertes économiques. Claude Grison et son laboratoire montpelliérain en étudiant des espèces comme la laitue de mer et la Jussie d’eau ont découvert qu’une bonne partie de la plante était au contraire capable de dépolluer l’eau (3). Transformées en fine poudre, elles sont des filtres très efficaces pour récupérer des métaux comme le palladium, le manganèse, le zinc et le nickel. Elles peuvent aussi être utilisées pour la récupération de polluants comme les herbicides.
La valorisation de ces découvertes est réalisée par une startup qui va transformer ces poudres gorgées de microparticules métalliques comme catalyseurs pour diverses réactions chimiques industrielles en remplacement de ceux issus des extractions minières. L’équipe de Montpellier espère avec ses partenaires industriels monter en puissance ces solutions de dépollution grâce à ces plantes envahissantes dont la croissance risque d’être accélérée par le changement climatique.
La pollution chimique organique
La chimie analytique a fait d’énormes progrès depuis 20 ans. Les procédés de séparation, d’extraction, et de caractérisation ; chromatographie inverse ou d’exclusion, spectrographies de masse… permettent d’identifier les polluants à des concentration très faibles comme le ppb (microgramme par kilo) et même moins. On est donc capable de caractériser les micropolluants (4) dans l’eau. Hélène Budzinski et son laboratoire de Bordeaux, l’EPOC, savent caractériser des milliers de molécules organiques. Mais d’après elle, alors qu’il y en a des millions, un enjeu de taille se dresse pour les chercheurs en chimie analytique : comment analyser ce qui n’est pas encore connu ! Ce projet novateur se fait en collaboration avec la régie de l’eau de Bordeaux (5). Il va demander de grands progrès méthodologiques de séparation et d’identification pour anticiper des actions sur des polluants potentiellement toxiques dont la recherche et l’analyse ne sont pas encore réglementées. Le challenge va aussi plus loin car on peut observer des effets sur la santé, la faune, l’environnement sans identifier les polluants et l’inverse est aussi possible. Un pesticide n’est peut-être pas en cause puisque l’effet escompté n’est pas constaté mais le mélange avec d’autres herbicides par un effet cocktail peut être impactant. S’y ajoutent des conditions environnementales, pH, température, turbidité… qui peuvent intervenir. Le projet de recherche mené par le CNRS, la régie de l’eau et l’office français de la biodiversité va essayer de caractériser par la chimie couplée à des bio-essais l’impact de rejets dans un affluent de la Garonne.
La prédiction des ressources et de la consommation
La recherche d’une meilleure qualité de l’eau au robinet c’est bien, mais la disponibilité de la ressource, son usage, sont aussi pour les collectivités locales une préoccupation constante (6). On l’a vu cet été lors du stress hydrique de certains départements et villes du sud de la France. C’est ainsi qu’un laboratoire de Mathématique du CNRS à Nice travaille avec la régie Eau Azur sur un projet complexe. Comment modéliser la prévision des demandes en eau des usagers au moins trois semaines à l’avance et aussi en amont prévoir le niveau des nappes phréatiques sur plusieurs mois.
Un premier modèle s’appuyant sur des méthodes statistiques classiques et sur un traitement des données par intelligence artificielle fournit des prévisions à six jours encore loin des six mois ! Mais il y a un réel intérêt scientifique à développer un outil mathématique de pointe pour traiter un sujet concret et utile. Le problème est bien sûr les prédictions météorologiques aléatoires qui influencent les niveaux des nappes. Mais la prédiction du stock disponible et du prélèvement permettra d’arrêter ici les pompes, là de les conserver, sans risques de pannes et des couts associés à ces défaillances et aux réparations. L’objectif pour les collectivités locales est de mieux gérer l’eau actuelle et future, prévoir la demande et dimensionner de nouveaux réservoirs si nécessaire.
En France la recherche dans la filière eau rassemble plus de 200 laboratoires et près de 3000 personnes à travers le CNRS, le BRGM, l’INRAE et plusieurs universités (7). Il s’agit d’accroître les connaissances sur les polluants, leur détection et leur élimination, les risques naturels, inondations et sécheresse, la valorisation des eaux usées, les réseaux de distribution intelligents, les nouveaux matériaux d’infrastructure de canalisation et les accès aux ressources. Le PEPR (Programme et équipements prioritaires de recherche) « One water - eau bien commun » financé sur 10 ans accélère la recherche académique et industrielle en ce domaine. Il sera décrypté lors du colloque « chimie et eau » du 6 novembre prochain.
Jean-Claude Bernier
Septembre 2024
Pour en savoir plus
(1) L’eau, une ressource essentielle à la vie, D. Soissons, dossier Nathan / Fondation de la Maison de la Chimie (Mediachimie.org)
(2) L’eau et l’énergie sont-elles dépendantes ?, A. Charles, N. Baffier et J.-C. Bernier, fiche Chimie et… cycle 4 (Mediachimie.org) et Pourquoi économiser l’eau potable est-il aussi source d’économie d’énergie ? F. Brénon et O. Garreau, Question du mois (Mediachimie.org)
(3) Zoom sur la phytoremédiation des métaux lourds, J.P. Foulon, Zoom sur… (Mediachimie.org)
(4) L’eau, sa purification et les micropolluants, M. Coquery et S. Martin Rue, in Chimie et nature (EDP Sciences) 2012, isbn : 978-2-7598-0754-3
(5) La bataille de l’eau propre, C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny, in La chimie et la sécurité des personnes, des biens, de la santé et de l'environnement, collection Chimie et... Junior, EDP Sciences, Fondation de la Maison de la Chimie
(6) L’eau ressource indispensable pour la ville, A. Charles, A.Harari et J.-C. Bernier, fiche Chimie et… cycle 4 (Mediachimie.org)
(7) Les chimistes dans les métiers de l’eau, F. Brénon et G. Roussel, série Les chimistes dans… (Mediachimie.org)
Crédits :
- Figure : répartition de l'eau sur Terre. DR.
- Illustration : Goutte d’eau, José Manuel Suárez/Wikimedia Commons CC BY 2.0
Le méthane, CH4, est le principal constituant du mélange gazeux d'hydrocarbures, appelé gaz naturel, qui s’est formé par sédimentation et décomposition de matières organiques sur des millions d’années aussi bien dans des terrains sédimentaires qu’au fond des océans. Il fait ainsi parti des énergies fossiles et est très largement utilisé à des fins énergétiques (centrales thermiques, carburant...).
C’est aussi l'hydrocarbure le plus abondant dans l'air, car il est produit naturellement, en particulier dans les zones humides : gaz des marais, responsable de la formation des feux follets, qui terrifiaient nos ancêtres il n'y a pas si longtemps. C’est en étudiant ce gaz des marais que Alessandro Volta (celui qui a inventé la pile voltaïque) l’a découvert en 1776 (1).
Le méthane est produit par fermentation anaérobie (i), de la matière végétale grâce à divers micro-organismes.
En mimant la nature, il peut aussi être produit volontairement à partir de déchets organiques dans des installations spéciales de méthanisation, allant d’unités de petites tailles « à la ferme » jusqu’à des usines. On est donc ici dans un processus de renouvelabilité. C’est ainsi que le méthane issu de ces procédés est appelé « biogaz » ou « biométhane ».
Historique
Le principe de gestion des déchets apparaîtra en France au XVIe siècle, lorsque François Ier démocratise l'emploi des paniers pour récupérer les déchets ménagers. En 1883, le préfet de la Seine Eugène Poubelle (2) invente le célèbre récipient qui porte encore son nom. En 1922, à l'initiative de la ville de Paris, est créée la société TIRU (3), qui, après la loi « Grenelle 1 » (4), et la reprise par le groupe Paprec, devient une société qui conçoit, construit et exploite des unités de valorisation des déchets, en particulier par méthanisation.
Comment est gérée la méthanisation (5) ?
Selon l'arrêté du 23 novembre 2011 (modifié par l'arrêté du 24 juin 2014) (6) fixant la nature des intrants dans la production de biométhane pour l'injection dans les réseaux de gaz naturel, peuvent être méthanisés des déchets : agricoles (fumier, lisier, sous-produits animaux, résidus de cultures…), de l'industrie agroalimentaire (fruits et légumes, déchets d'abattoirs…), urbains (biodéchets ménagers triés, ou issus de la restauration collective, des grandes et moyennes surfaces, déchets verts, boues de stations d'épuration…), et industriels (eaux de lavage de procédés industriels, boues industrielles, graisses…).
Depuis le 1er janvier 2016, conformément à la loi Grenelle II (ii), les entreprises et les professionnels de la restauration doivent traiter leurs biodéchets s’ils en produisent plus de 10 tonnes/an et ainsi éviter la mise en décharge, aboutissant à un tassement, donc à un milieu anaérobie, producteur de gaz à effet de serre (dont surtout le méthane !). À l’horizon 2025, dans le cadre de la loi de transition énergétique, l’intégralité des biodéchets en restauration devra être triée à la source, y compris ceux des ménages (7).
Comment s'obtient ce biométhane ?
Les déchets fermentescibles sont stockés dans une cuve cylindrique et hermétique que l’on appelle « digesteur » ou « méthaniseur » dans laquelle ils sont soumis à l’action de micro-organismes (bactéries) en l’absence d’oxygène. Les réactions biologiques mises en jeu par la méthanisation sont complexes, mais globalement on repère trois grandes étapes : l’hydrolyse et l’acidogénèse où les chaînes organiques complexes (protéines, lipides, polysaccharides) sont transformées en composés plus simples (acides gras, peptides, acides aminés) suivi de l’acétogénèse où les produits de l’acidogénèse sont convertis en acide acétique et enfin la méthanogénèse où l’acide acétique est transformé en méthane et en gaz carbonique.
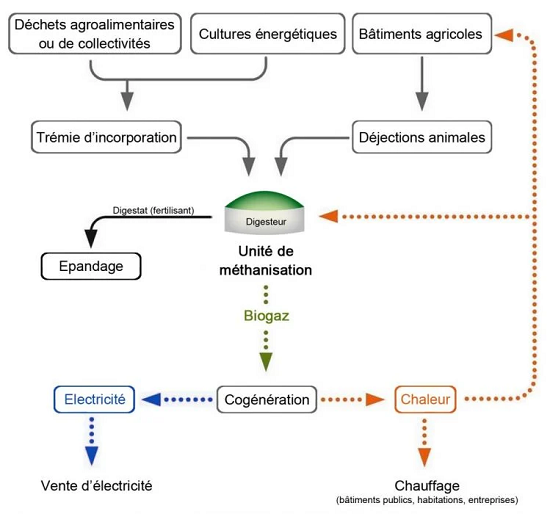
Schéma explicatif du processus de méthanisation (©Connaissance des Énergies)
Source https://www.connaissancedesenergies.org/fiche-pedagogique/methanisation
Le processus produit deux sortes de composés, le Biogaz et le Digestat. Le processus produit aussi des CSR, Combustibles Solides de Récupération, utilisables en cimenterie. Le biogaz, appelé Biométhane après purification et odorisation , est envoyé dans les réseaux et sert à produire de l'énergie pour les usages industriels, domestiques, ou comme carburant (il est alors appelé GNV (iv)(v)). Le digestat peut lui aussi être utilisé, sa partie liquide, riche en azote sous forme ammoniacale comme engrais, et la partie solide comme amendement des sols qu'il enrichit et restructure (compost).
Ce processus peut aussi être réalisé dans les exploitations agricoles où il permet d'éviter l'émission libre de méthane dont l'effet de serre, 25 fois plus puissant que celui du dioxyde de carbone, le rend dangereux pour l’environnement.
Bénéfices pour l'environnement
La valorisation énergétique des déchets joue un rôle important dans la mise en œuvre de la transition énergétique et écologique de notre pays à double titre : en tant que solution de traitements des déchets, complémentaire du recyclage ; dans une logique de souveraineté et d’élargissement du mix énergétique.
Déjà, l’incinération avec récupération d'énergie entraîne une économie significative de combustibles fossiles (gaz, fioul, charbon…). Elle permet, par la vente de l'énergie, de diminuer d'au moins 20 % le prix de traitement des déchets urbains. Elle réduit de 90% le volume et de 70% la masse des déchets. Mais elle entraîne un dégagement de CO2.
Mais l’intérêt de la méthanisation est de pouvoir faire une double valorisation :
- une valorisation matière via la production du digestat : 90% des matières entrantes seront transformées en engrais organique, local et renouvelable, qui permet de remplacer les engrais minéraux actuellement utilisés, dont la synthèse implique des énergies fossiles et l'importation de composés comme les phosphates, ou la potasse, coûteux.
- une valorisation énergétique via la production du biogaz : 10% des matières entrantes sont transformées en biogaz renouvelable, en remplacement de gaz fossile importé.
Les déchets organiques sont en effet une matière parfaitement recyclable, dont notre agriculture a besoin, et qui ne doivent plus être jetés en mélange avec les déchets ultimes : leur tri à la source, pour produire du compost ou du digestat utilisés pour fertiliser les champs, évite leur gaspillage et des importations et augmente le taux de valorisation des déchets non dangereux. Leur valorisation en méthanisation participe à la production d'énergie renouvelable.
Développement de la méthanisation
L'Europe est la principale zone de production de biogaz par méthanisation. Le processus se développe d’abord en Allemagne et en Italie, puis en France.
Selon le Commissariat général au développement durable, le nombre d'installations de sites d'injection de biométhane en France, de 1 en 2011, 17 en 2015, 214 en 2020, 551 en 2023 devrait continuer à fortement augmenter dans les prochaines années, au regard des nombreux projets en cours et au fort potentiel de la filière (7000 sites prévus en 2050).
Mais il faut rester vigilant quant à l'utilisation des « cultures énergétiques » (8). En effet, les possibles changements d’usage des terres et/ou des systèmes de production pour assurer l’alimentation du méthaniseur, production de cultures dédiées sur des terres anciennement dédiées à la production alimentaire (terres arables ou prairies) ; modification des successions de cultures pour maximiser l’insertion de cultures intermédiaires à vocation énergétique (CIVE) peuvent conduire à une possible compétition avec l'alimentation, d'où un impact sur les volumes et les prix, voire une annulation de l'intérêt climatique de la méthanisation.
Par exemple, en Allemagne la politique publique a favorisé un fort développement des surfaces en maïs pour l’alimentation des méthaniseurs, en partie au détriment des surfaces en prairies. L'Italie a tendance à suivre ce modèle, mais de façon plus modérée, grâce à des fermes diversifiées.
Nicole Moreau et l’équipe question du mois
(i) anérobie = sans oxygène. Le contraire est aérobie
(ii) directive mise à jour en décembre 2023 https://www.ecologie.gouv.fr/politiques-publiques/biodechets
(iii) Quel que soit le procédé, le traitement comprend au moins les 3 étapes : désulfurisation, qui enlève le SH2; déshydratation, qui enlève l'eau; décarbonation, qui enlève le CO2.
(iv)Tout gaz injecté dans le réseau de distribution doit posséder une odeur suffisamment caractéristique pour qu'une fuite puisse être immédiatement perceptible. On ajoute au biogaz un liquide incolore à l'odeur caractéristique, le tétrahydrothiophène (THT), à hauteur de 15 à 40 mg/m3.
(v) GNV = Gaz Naturel pour Véhicules, et les véhicules l'acceptant.
Pour en savoir plus
(1) Volta sur Wikipédia
(2) Poubelle sur Wikipédia
(3) Histoire de la société TIRU
(4) Le Grenelle de l'environnement : quels engagements ? sur le site Vie-publique.fr
(5) FNADE Fédération nationale des activités de dépollution et de l'environnement
(6) Arrêté du 23 novembre 2011 fixant la nature des intrants dans la production de biométhane pour l'injection dans les réseaux de gaz naturel sur le site Legifrance.fr
(7) Biodéchets sur le site écologie.gouv.fr du ministère de la Transition écologique et de la Cohésion des territoires
(8) Effet de la méthanisation sur l’usage des sols et les systèmes de production PDF - F. Levavasseur, L. Boros, M. Carozzi, R. Girault, L. martin, P. Martin et S. Houot HAL open science, Effet de la méthanisation sur l'usage des sols et les systèmes de production (PDF), Florent Levavasseur, Léa Boros, Marco Carozzi, Romain Girault, Lucie Martin, et al., Webinaire CLIMAE « Quel impact de développement des énergies renouvelables sur l'usage des sols agricoles », Métaprogramme CLIMAE, May 2023, En Ligne, France. ⟨hal-04262845⟩
La Fondation de la Maison de la Chimie s’est associée à la manifestation culturelle et scientifique « Sur les épaules des géants » organisée par la ville du Havre dont la vocation est la diffusion des savoirs et le goût des sciences.
Montons bien volontiers « Sur les épaules des géants » pour donner à découvrir notre site Mediachimie qui fourmille d’informations scientifiques et plus particulièrement de chimie et œuvre de façon constante pour accompagner les avancées dans l’industrie mais aussi pour améliorer notre quotidien.
Découvrez des ressources produites spécifiquement pour accompagner cet événement sur le thème Chimie et Lumière :
- Un dossier pédagogique, pour aborder avec des élèves des notions de chimie et lumière dans les classes de seconde, première et terminale du LEGT
- Un dossier pédagogique, pour aborder avec des élèves des notions de chimie et laser dans les classes de première et terminale du LEGT
- un dossier métiers pour découvrir les métiers de la chimie et les entreprises de la chimie de la ville du Havre et de ses environs
- Un petit dictionnaire Mediachimique, lisible par tous, qui suscitera sans aucun doute votre curiosité et vous donnera envie d’en savoir plus sur les liens de la chimie et la lumière ».
Via notre site www.Mediachimie.org, nous montrons combien le secteur de la chimie est ouvert et transdisciplinaire et combien ses avancées sont compatibles avec des secteurs aussi variés que la cosmétologie, l’industrie pharmaceutique, pétrochimique, automobile et même le sport avec les équipements et les matériaux.
Au cœur de ce site, nous profitons de ces épaules solides des géants pour proposer des milliers de ressources (vidéos, articles, conférences, quiz…) présentées par des chercheurs, professionnels, et des enseignants de premier plan.
L’un de nos objectifs est de donner le goût des sciences.
Dès l’école primaire, nous sommes associés à La Fondation « La main à la pâte » pour que les plus jeunes découvrent et manipulent de multiples objets et en comprennent leur fonctionnement.
Au collège, au lycée et à l’Université, nous accompagnons nos jeunes pour les questionner sur des sujets d’actualités, les pousser à avoir un raisonnement scientifique et leur donner envie d’embrasser des carrières dans le domaine des sciences en leur présentant toute la diversité des métiers possibles.
Soyez curieux et venez nous retrouver durant ce bel évènement qui se tiendra du 26 au 28 septembre 2024 au Havre et sans plus attendre, assouvissez votre curiosité sur Mediachimie.org
Après un été riche en évènements sportifs, Mediachimie vous propose de prolonger l’esprit des Jeux Olympiques et Paralympiques au travers de nombreuses ressources sur le thème Chimie et sports.
- Quels matériaux pour les prothèses des parasportifs ? - Question du mois
- Témoignage d’un sportif, Alexis Hanquinquant - Vidéo
- Conférences du colloque Chimie et sports en cette année olympique et paralympique :
- Christophe Clanet : Science 2024® : quand scientifiques et sportifs s’associent pour faire gagner la France
- Adrien Sedeaud : Gagner avec les données : comment mettre les données au service du sport de haut niveau
- Virginie Couharde Louvel : Matériaux de hautes performances au service du (handi-)sport
- Yves Rémond Le rôle des matériaux composites dans les performances sportives
- Le dopage dans le sport - Quiz
Cérdit illustration : © J. Gomez
Le terme « perform + ance » a pour signification « ce qui est accompli, une chose effectuée ». Que ce soit pour les arts, le théâtre, dans le sport ou dans notre vie quotidienne, cette notion est de plus en plus présente.
Si lors des Jeux Antiques, les athlètes devaient juste être les plus forts, les premiers sur la ligne d’arrivée, de nos jours s’ajoute à ce concept d’être le/la meilleur(e), celui de la performance sportive. Il faut non seulement monter sur un podium mais en plus, battre un record (le sien ou celui existant au niveau européen ou mondial), bref performer dans des contextes parfois complexes (conditions météo, acoustiques, concurrence accrue, minima, sélections…).
Les athlètes, valides ou porteurs de handicap, sont obnubilés par ce concept. Les fédérations sportives et les coachs ne le sont pas moins. C’est pourquoi, chacun sollicite chercheurs, industriels dont de nombreux chimistes… la science en général pour imaginer des process, des équipements, des matériaux, des produits « licites » permettant d’accroître leurs performances. D’ailleurs, le lieu sacré en France d’entrainements des athlètes et para-athlètes de haut niveau ne s’appelle-t-il pas l’INSEP (Institut national du sport, de l’expertise et de la performance) et la devise olympique n’est-elle pas « Plus haut, plus vite, plus fort – ensemble » ?
Aller plus vite, optimiser sa pénétration dans l’air, personnaliser la charge de travail en fonction de la morphologie, pouvoir bénéficier de textiles compatibles avec des efforts longs ou dans des conditions extrêmes… pour tous ces objectifs, la science apporte son savoir-faire, ses batteries de données qui permettent d’apporter des solutions individuelles ou plus globales pour cette quête de performance.
À l’approche des Jeux Olympiques et Paralympiques de Paris 2024, ce terme sera sur toutes les lèvres, dans tous les esprits. Les scientifiques ont travaillé dur pour réfléchir à des textiles, des matériaux plus souples, plus légers et résistants, apporter données et savoirs pour que les sportives et sportifs se sentent prêts et compétitifs pour performer !
Jean Gomez
Pour en savoir plus
Colloque Chimie et Sports, Fondation de la maison de la Chimie, février 2024
Chimie dans le sport - Sports et matériaux, É. Bausson, dossier Nathan / Fondation de la Maison de la Chimie (Mediachimie.org)
Quels matériaux pour les prothèses des para-sportifs ?, A. Harari, Question du mois (Mediachimie.org)
Des textiles pour sportifs, apport de la chimie pour améliorer confort et performances, F. Roland, La chimie et le sport (EDP Sciences, 2011) isbn : 978-2-7598-0596-9, p. 239
Crédit illustration : Flickr, domaine public
Les vélos du Tour de France
Avec le Tour de France 2024 parti d’Italie fin juin et deux Français vainqueurs des deux premières étapes l’audience télévision explose en Europe. Ce sont des centaines de milliers de spectateurs sur les routes et des millions de téléspectateurs sur leurs canapés qui suivront les coureurs sur leurs petites merveilles de technologie que sont devenus les vélos de course.
Loin des vélos en acier des années 1913 réparables dans une forge par Eugène Christophe, la demande de légèreté des machines a exigé d’abord des épaisseurs de tubes du cadre de plus en plus faibles, puis le remplacement de l’acier par l’aluminium et plus récemment l’usage des composites carbone qui apportent le faible poids et une rigidité améliorée (1). Tous les vélos des équipes du Tour de France ont maintenant non seulement des cadres moulés en fibre de carbone + polyester mais aussi des roues en carbone pour que le poids avec les accessoires soit de l’ordre de 7 kg (2).
Parlons d’ailleurs des accessoires. Pour transmettre l’effort, le moyeu du pédalier est muni d’un capteur d’effort qui traduit au coureur la puissance qu’il dépense, en watt. Depuis quelques années les roulements « en céramique » (3) disposent de billes en alumine dans les couronnes d’acier, très dures sur des surfaces de contact réduites et améliorent ainsi de plus de 80% le glissement et la fluidité des pièces en mouvement. Il en est de même pour le dérailleur électromagnétique qui peut être commandé par un « shifter », un petit bouton sur le guidon qui par bluetooth commande les changements de vitesse. Enfin, depuis longtemps, les bons vieux freins à patins ont été abandonnés. Ce sont des freins à disques sur les moyeux des roues à commande, soit hydraulique, soit électrique. Par ailleurs sur les roues en carbone les boyaux et chambres à air ont laissé place aux tubeless qui contiennent un solvant avec un polymère qui, en cas de crevaison limitée, comble le trou et permet au coureur de rouler encore un peu (4). Chaque vélo est adapté à la taille du coureur et à sa recherche d’aérodynamique, pour cela la tige du guidon est abaissée et même la tige de selle est creusée à l’arrière d’une cavité qui diminue la trainée arrière. Toutes ces améliorations technologiques n’ont qu’un seul but, améliorer le rendement énergétique , donc faire économiser quelques « wattheures » au coureur et diminuer son rythme cardiaque. Bien sûr la Fédération internationale a veillé à ce que ces progrès technologiques ne rompent pas l’égalité des chances et elle a limité le poids minimum des machines à 6,8 kg. Ne vous y trompez pas le coût de ces superbes vélos n’est pas à la portée du tout-venant, il est compris entre 12 000 et 20 000 €. Quand on sait qu’il y a entre 1000 et 2000 vélos qui se baladent dans la caravane du Tour voilà une caravane en or !
Le vélo de tout le monde
J’espère que vous avez payé moins pour votre vélo. En Europe la mode et le souci de préserver notre environnement continuent à soutenir le marché du vélo. Il s’en est vendu environ 25 millions en 2023 dont à peu près 20% avec assistance électrique (VAE). En France, le marché représente un CA de 3,5 Mrd € avec 2,23 millions de machines vendues à un prix moyen de 980 € dont 700 000 VAE au prix moyen de 1 900 €.
Alors avez-vous bien contribué à la préservation de notre chère planète ? Si vous avez un VAE l’empreinte carbone en France est de l’ordre de 17 g (CO2e)(i)/km parcouru si vous gardez votre engin 15000 km. C’est légèrement plus que pour un vélo ordinaire mu par la force musculaire qui est de 11 à 13 g CO2e/km parcouru. Ces chiffres sont très bons comparés au TGV 35 g CO2e/km parcouru par passager, 70 g CO2e/km pour une voiture électrique et plus de 100 g CO2e/km pour une voiture thermique. Seule la marche à pied (1 à 2 g CO2e/km) et le métro (8 à 10 g CO2e/km) sont plus performants que le vélo. L’essentiel de cette empreinte carbone est dû à la fabrication. Prenons un vélo de 20 kg en aluminium : la production du cadre en Chine exige 181 kg CO2e ; s’il est à assistance électrique il faut ajouter 20 kg CO2e pour la batterie et 37 kg CO2e pour le moteur. Comment réduire son empreinte carbone ? il est clair que s’il était fabriqué en France, avec de l'aluminium de recyclage ou de refusion, de 181 kg CO2e on passerait à peine à 20 kg CO2e (compte tenu de l'énorme différence d'énergie entre l'aluminium primaire et celui de seconde fusion et des mix électriques Français et Chinois comparés). Et encore moins si par « retrofit » (ii) on transformerait votre bon vieux vélo en VAE.
Bien, me diriez-vous : « mais je consomme de l’électricité ! ». Les batteries des voitures électriques (5) ont mauvaise réputation à cause de leurs poids, mais sur le VAE la batterie est bien plus petite et d’une capacité souvent inférieure à 1 kWh. Par exemple, pour faire 100 km un VAE demande environ 1 kWh ce qui représente en France 0,5 g CO2e/km parcouru soit moins de 4% des émissions totales, et en Allemagne 4 g CO2e/km un peu plus à cause du mix électrique.
Si vous êtes passionnés de cyclisme et d’environnement on peut encore améliorer l’empreinte carbone du VAE avec d’autres matériaux comme un cadre en bois ou en fibres de carbone recyclées ou en aluminium vert (6) avec des batteries au sodium (7) plutôt qu’au lithium, etc.
La forme physique
En cette année olympique n’oubliez pas que tous les jours faire du vélo vous fait perdre des calories par km parcouru et entretient votre moteur personnel : le cœur. Grâce aux hormones fabriquées par le cerveau au cours de l’effort, comme l’endorphine, vous vous sentirez mieux (8).
On a parfois accusé nos champions qui montraient une débauche de « watts » lors d’ascensions en montagne, d’avoir dissimulé dans le cadre de leur vélo de course un micromoteur et une micro-batterie électrique : les contrôles par infrarouge en course et par rayons X au garage ont montré que c’était faux. Par contre le dopage chimique par détournements de médicaments reste toujours possible, mais la chimie analytique fait continuellement des progrès et les risques de se voir rattraper par la patrouille toujours plus probables.
Pour vous en pédalant au fil des kilomètres, dopez-vous de grand air pur et de paysages apaisants, alors vous réussirez vos vacances.
Jean-Claude Bernier
Juillet 2024
(i) (CO2e) pour CO2 équivalent, unité créée par le GIEC pour mesurer et comparer les effets climatiques d’un gaz à effet de serre, sachant que les différents gaz n’ont pas le même impact sur l’effet de serre et ont une durée de vie dans l’atmosphère différente.
(ii) rénovation
Pour en savoir plus
(1) Les matériaux dans le sport, (r)évolutionnaires !, P. Bray, O. Garreau et J.-C. Bernier, fiche Chimie et... en fiches cycle 4 (Mediachimie.org)
(2) Les matériaux de la performance C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny, La chimie dans le sport, collection Chimie et... Junior (EDP Sciences, 2014)
(3) Les céramiques et les réfractaires, indispensables à l’industrie primaire, J. Poirier, Colloque Chimie et matériaux stratégiques, novembre 2022
(4) Comment fabriquer des pneus à partir d’un arbre ? La vulcanisation, J.-C. Bernier, série Réaction en un clin d'œil (Mediachimie.org)
(5) Le lithium un élément chimique indispensable pour notre mobilité actuelle, É. Bausson, fiche Chimie et... en fiches cycle 4 (Mediachimie.org)
(6) Comment verdir les métaux ? J.-C. Bernier et F. Brénon, éditorial (Mediachimie.org)
(7) Les batteries sodium-ion, J.-C. Bernier, éditorial (Mediachimie.org)
(8) Sport et cerveau, C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny, La chimie dans le sport, collection Chimie et... Junior (EDP Sciences, 2014)
Crédit illustration : Pexels / Pixabay
Parasport : les origines
La compétition sportive pour les personnes souffrant de handicaps physiques trouve son origine en 1948, lorsque le Dr. Guttmann, neurochirurgien britannique d’origine allemande, décide d'organiser les premiers « Jeux mondiaux des chaises-roulantes et des amputés », pour réinsérer psychologiquement ses patients paraplégiques, vétérans de la Seconde Guerre mondiale.
En 1952, cet événement prend une dimension internationale et, depuis les premiers Jeux paralympiques de 1960 qui se tiennent à Rome, une semaine après les J.O., les suivants se déroulent tous les 4 ans dans la ville choisie pour les Jeux olympiques.
Le handisport nécessite du matériel adapté, aussi bien pour les déplacements (prothèses de membres ou fauteuils roulants), que pour les accessoires spécifiques (sangles, ballons pour non-voyants, protections, etc.).
Les prothèses sont les dispositifs artificiels destinés à remplacer une partie amputée du corps, membre, portion de membre, articulation. Elles existent depuis l’Antiquité ! Jusque dans les années 1980, les athlètes handicapés ne portaient pas de prothèses spécifiques lors des compétitions sportives.
Par la suite, des prothèses spécialement conçues pour les parasports ont été développées. Elles doivent remplir plusieurs fonctions : légèreté, résistance mécanique, biocompatibilité, confort. Les matériaux et les conceptions utilisés dans les prothèses diffèrent selon le type de sport pratiqué.
Elles sont souvent faites sur mesure et privilégient l’efficacité plutôt que l’esthétique.
De quoi sont faites les prothèses des sportifs handicapés ?
Les prothèses des blessés de la Première Guerre mondiale étaient en bois et cuir ! Désormais elles se caractérisent par des matériaux aux propriétés différentes. Les métaux comme le titane, l’aluminium ou l’acier, sont utilisés pour leur résistance et leur légèreté (en réalité ce sont des alliages acier inox, nickel-titane, etc.). Mais de nouveaux matériaux ont fait leur apparition comme la fibre de carbone, le kevlar, la fibre de verre, les matériaux composites, les silicones, etc. et ils ont largement modifié les performances des athlètes handicapés.
Oscar Pistorius, champion paralympique et olympique sur 400 m, utilise des lames en fibre de carbone, jouant le rôle de pied et de mollet. Sa « flex foot » est inspirée de la jambe arrière du guépard, le plus rapide des animaux.
Herr Hugh, grimpeur de très haut niveau dans les années 80, a créé des jambes prothétiques lui permettant d'escalader à nouveau après son accident. Dans son cas, le pied est en titane.
Ces prothèses sont aujourd’hui largement utilisées et résument bien l’apport des matériaux nouveaux.
Exemple d’une prothèse de membre inférieur
Elle comporte 3 éléments : l’emboîture, le manchon, la prothèse (fig. 1).

Figure 1. Flex foot. Source Brevet national des collèges 2020
https://lewebpedagogique.com/technopp/archives/640
1 - L’emboîture relie la prothèse au moignon (membre amputé), elle est la base sur laquelle se fixent les éléments de la prothèse, elle permet l’appui au moignon et transmet l’énergie du corps vers le « membre artificiel ».
Elle peut être réalisée avec un matériau composite (i) appelé « carbone tubulaire ». Ce sont des fibres de carbone (ii) imprégnées de résine acrylique (iii).
D’autres composites sont formés avec du Kevlar (iv), des fibres de verres ou de carbone, tous biocompatibles, qui permettent l’allègement de la prothèse et un meilleur aérodynamisme.
L'emboîture est conçue sur mesure pour éviter tout mouvement du moignon dans l'emboîture.
2 - Le manchon est l’interface entre la peau et l’emboîture, il est destiné à protéger le membre.
Partie souple de la prothèse, il est le plus souvent en silicone (v), matériau choisi pour son élasticité, sa biocompatibilité, sa durabilité et sa capacité à réduire les frottements et les irritations. Des copolymères ou du polyuréthane sont aussi employés.
3 - La prothèse elle-même, pied, genou, jambe, main… ne supporte pas les mêmes efforts selon le sport pratiqué.
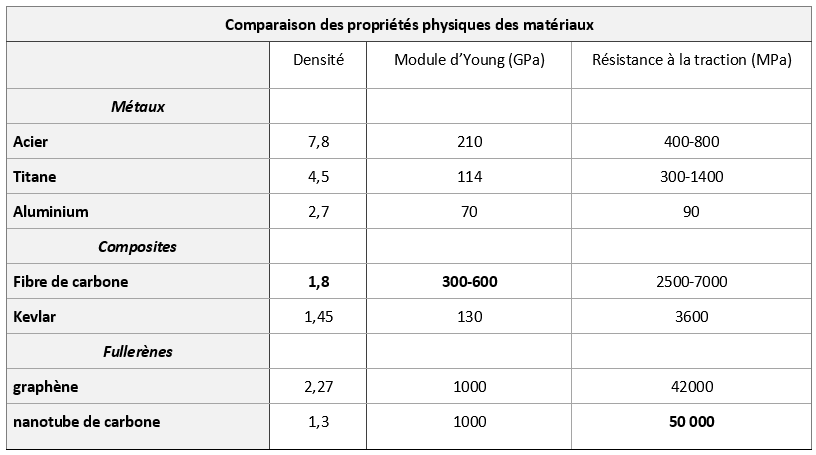
Les « lames de course » constituant les prothèses des coureurs à pied sont désormais majoritairement en fibre de carbone.
En fait, les fibres de carbone tissées sont imprégnées de résine époxy et c’est ce matériau composite qui possède un ensemble de propriétés remarquables (cf. tableau comparaison) :
- légèreté due à la très faible densité de 1,8
- résistance 10 fois supérieure à celles de l’acier, ce qui donne une résistance spécifique 50 fois supérieure à celle de l’acier (quotient résistance /densité) (résistance à la compression et la traction, flexibilité)
- tenue en température
- longévité, due à l’inertie chimique (sauf à l’oxydation).
La fibre de carbone contribue au renforcement de nombreux composites. Mais sa production est complexe (vi) et la rend très coûteuse. La réparation et le recyclage des pièces sont problématiques.
Les avancées et les perspectives
Aujourd’hui de nouveaux composants électroniques révolutionnent l’efficacité des prothèses pour compenser le handicap.
Les progrès les plus innovants résident dans les prothèses bioniques (fig. 2) dans lesquelles un (ou plusieurs) composant(s) est géré électroniquement pour reproduire au mieux le fonctionnement humain. (bionique est la contraction de biologique et électronique).

Figure 2. Main bionique https://fr.motorica.org/blog
Des capteurs et des composants, conducteurs ou semi-conducteurs électroniques, captent l’activité (contraction-énergie) des muscles du membre résiduel et la transmettent à la prothèse.
Dans ce domaine, le graphène et les nanotubes de carbone, nouvelles formes (allotropes) du carbone de découverte récente, sont très prometteurs. Le graphène (vii) est constitué d’un feuillet d’atomes de carbone disposés sur un réseau de type nid d’abeille. Sa résistance à la rupture est deux cents fois supérieure à celle de l'acier (tout en étant six fois plus léger).
Un ou plusieurs feuillets peuvent s’enrouler pour former un nanotube de carbone (viii) (fig. 3).
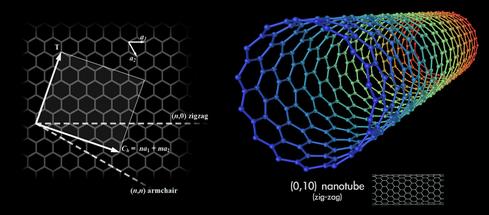
Figure 3. Nanotube de carbone.
Source : Mstroeck. Licence CC BY-SA 3.0, Wikimedia Commons
Flexibles et ultra-résistants, les nanotubes de carbone peuvent, entre autres propriétés, transmettre les courants électriques du corps humain, grâce à leur comportement métallique ou semi-conducteur. Ainsi la présence de nanotubes de graphène a-t-elle permis (1) de fabriquer des mains prothétiques fonctionnelles capables d'interagir avec des écrans tactiles (utile pour les sports électroniques !).
En conclusion, le temps de la jambe de bois du pirate est bien révolu ! L'évolution scientifique et technologique des prothèses permet maintenant aux sportifs handisports de pratiquer leur discipline à haut niveau.
Dans certains cas, les avancées technologiques donnent des capacités accrues aux athlètes handicapés, au point que leurs performances peuvent égaler voire devancer celles des sportifs valides. Par exemple la prothèse permet à l'athlète une restitution d'énergie plutôt constante (et donc moins de fatigue pour l’athlète). La lame de carbone d’un sprinter, selon sa conception ou sa longueur, donne à l’athlète une foulée plus longue et transmet une énergie supérieure à celle des athlètes non amputés. Peut-on alors parler d’« athlètes augmentés par la technologie » ?
Des questions éthiques sur la participation de ces athlètes au côté d’athlètes valides dans les compétitions internationales (2) existent déjà. Toutefois, au cours de l’histoire de l’athlétisme paralympique, seuls quelques athlètes ont atteint les performances des athlètes valides…
Andrée Harari et l’équipe question du mois
(i) Les matériaux composites sont constitués de deux ou plusieurs composants dont les propriétés, différentes mais complémentaires, confèrent au composite des caractéristiques spécifiques.
Dans le cas présent ils présentent, pour l’application recherchée, les avantages suivants :
- résistance : le matériau supporte de nombreux chocs et pressions externes grâce au renfort des fibres de carbone,
- volume et masse plus faibles : allègement parfois considérable du produit final,
- durée de vie : du fait de sa résistance et sa relative inertie chimique, le matériau est durable.
(ii) La fibre de carbone est constituée de fibres extrêmement fines (5 à 10 microns de diamètre) d’atomes de carbone agglomérés en microcristaux. L’alignement des cristaux le long de l’axe de la fibre la rend très résistante. Plusieurs milliers de fibres de carbone sont enroulées ensemble pour faire un fil. Les fibres de carbone étant formées de domaines graphitiques, elles présentent les propriétés électriques du graphite.
Cependant les propriétés sont unidirectionnelles, (anisotropie). Ce n’est pas le cas des métaux qui sont capables de supporter des charges dans n’importe quelle direction (propriété isotrope).
(iii) Une résine acrylique est un polymère thermoplastique ou thermodurcissable obtenu à partir d'acide acrylique (H2C=CHCOOH), ou autres composés apparentés. Ses propriétés utiles sont la résistance mécanique, la biocompatibilité, la transparence.
(iv) Le Kevlar (nom commercial du poly(p-phénylènetéréphtalamide) (PPD-T) est un polymère thermoplastique constitué de noyaux aromatiques séparés par des groupes amide. Les liaisons hydrogène lui confèrent son exceptionnelle résistance spécifique (rapportée à la densité), supérieure à celle de l'acier, mais inférieure à celle des fibres de carbone.
Comme les autres fibres textiles, il ne fait pas partie des matières plastiques (fig. 5).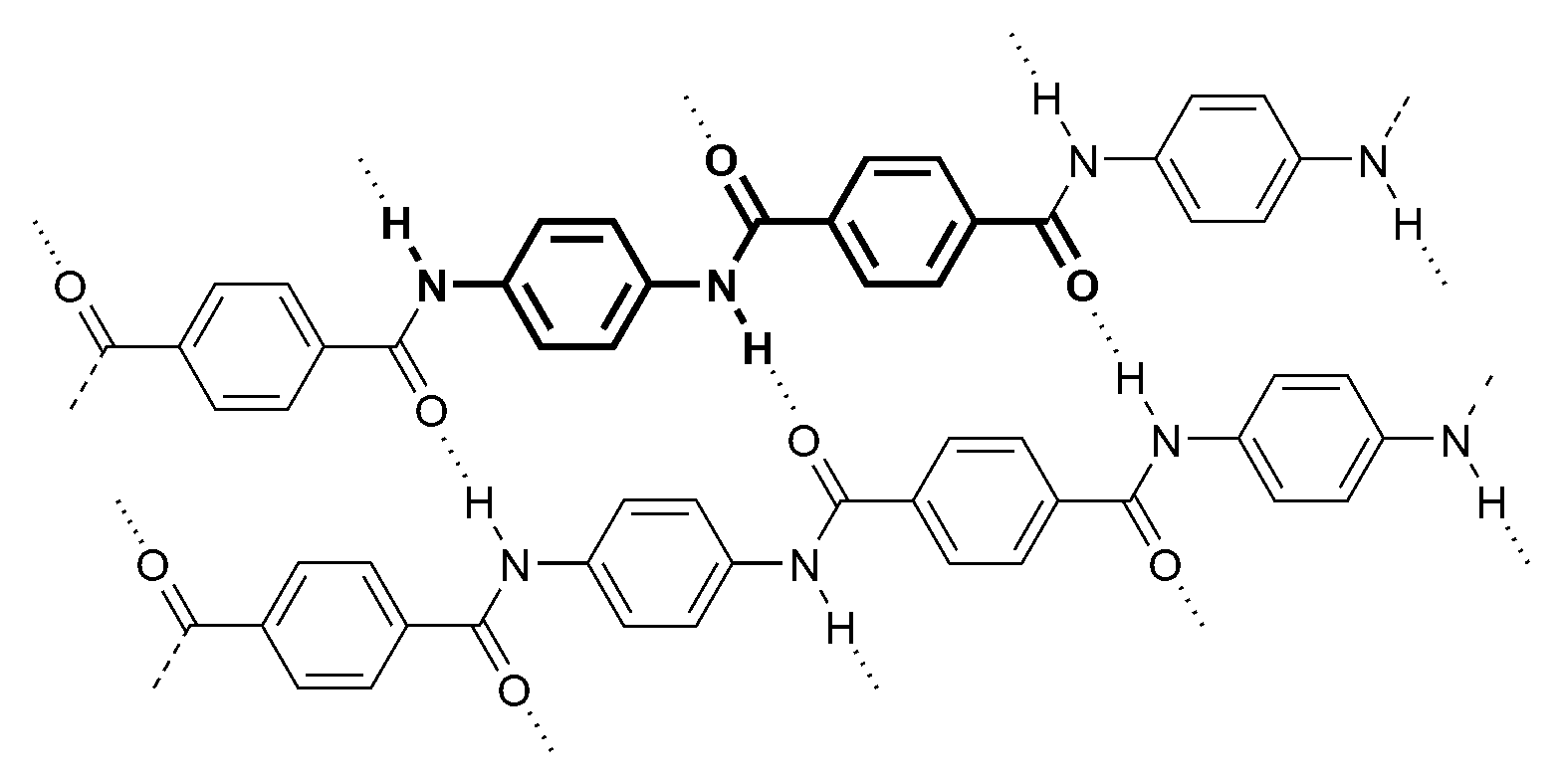
Structure du kevlar. Licence CC BY-SA 3.0, Wikimedia Commons
(v) Les silicones, ou polysiloxanes, sont des composés inorganiques (il n’y a pas d’atomes de carbone dans la chaîne principale) formés d'une chaîne silicium-oxygène dans laquelle des groupes se fixent sur les atomes de silicium. Le type le plus courant est le polydiméthylsiloxane linéaire (PDMS).
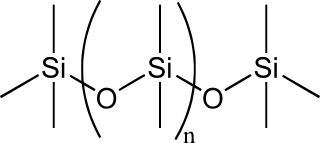
PDMS. licence CC BY-SA 3.0, Wikimedia Commons
Si l'on fait varier les chaînes, les groupes fixés et les liaisons entre chaînes, les silicones fournissent une grande variété de matériaux dont la consistance varie du liquide au plastique dur, en passant par le gel.
(vi) La fibre de carbone est fabriquée à partir des précurseurs comme :
- Les fibres de polyacrylonitrile (fibres de PAN de formule H2C=CH–C≡N). Ces dernières sont oxydées vers 200-300°C pendant une durée allant de 30 minutes à 3 heures et deviennent infusibles. Ces fibres sont ensuite carbonisées sous atmosphère inerte entre 1 000 °C et 1 500 °C pour éliminer les éléments H, N, et O. La graphitisation par un second traitement thermique à haute température (plus de 2 000 °C) améliore la structure des fibres.
- Le brai, goudron issu de distillation de résidus de pétrole ou de houille.
- La cellulose.
(vii) Le graphène est un composé bidimensionnel cristallin, identifié en 2004.
Cette forme de carbone, correspond à un feuillet unique de graphite, de réseau hexagonal, type nid d’abeille. Ses propriétés sont donc bidimensionnelles :
- résistance à la rupture deux cents fois supérieure à celle de l'acier (tout en étant six fois plus léger)
- exceptionnelles conductivités électrique et thermique
- durabilité

Structure du graphène. Domaine public, Wikimedia Commons
(viii) Un nanotube de carbone, observé pour la première fois en 1991 (4) (5), est une structure cristalline composée d'atomes de carbone qui peut être décrite comme un feuillet de graphène enroulé sur lui-même. C’est un tube creux, de diamètre interne d’environ un nanomètre (10-9 m) et d’une longueur de l'ordre de quelques microns.
Les nanotubes peuvent être mono-feuillet ou multi-feuillets. La structure d'un nanotube de carbone multi-feuillets correspond soit à plusieurs feuillets de graphène concentriques, soit à un seul feuillet de graphène enroulé sur lui-même de façon hélicoïdale.
Du point de vue électrique, les nanotubes mono-feuillets ont la particularité remarquable d’être soit métalliques (conducteurs) soit semi-conducteurs. En outre ils ont une excellente rigidité (mesurée par le module de Young), comparable à celle de l'acier et une extrême légèreté.
Références
(1) Nanotubes de graphène, sur le site Motorica (2021)
(2) Le sport augmenté, une révolution en marche à autoriser ?, Journée Transhumansime : de nouveaux droits, Mai 2021, Aix-en-Provence, France, M. Lahaye, V. Perkins, Ch. Charleux, G. Nicolas, V. Andrieu et A. Mahalatchimy, halshs-03406451v2
(3) Electric Field Effect in Atomically Thin Carbon Films K. S. Novoselov, A. K. Geim, S. V. Morozov et al., Science, vol. 306, n° 5696 (2004) p. 666–669
(4) Helical microtubules of graphitic carbon, S. Iijima, Nature, 354 (1991) p. 56-58.
(5) Who should be given the credit for the discovery of carbon nanotubes? M. Monthioux et V. L. Kuznetsov, Carbon, vol. 44, n°9 (2006) p. 1621-1623
Pour aller plus loin
* Les nouvelles prothèses Serge Lécolier, Revue Chimie Paris, n°338-339 (2012) p. 8-11
* Handicap et évolution scientifique et technologique : la prothèse dans le handisport (PDF) Comité Départemental Olympique et Sportif de l'Aisne, aisne.franceolympique.com
* Société Össur, fabricants de produits orthopédiques non invasifs
* Cours de physique du solide : les nanotubes de carbones (pdf) sur le site de l'Institut Rayonnement-Matière de Saclay (Iramis) - CEA
* Cette main bionique peut fonctionner plusieurs années, R. Fouchard, News de science (2023) sur le site des Techniques de l’Ingénieur
* Prothèses bioniques : retrouver les fonctions perdues, article réalisé avec M. Maier, de l'École des neurosciences (unité FR3636), CNRS - Université Paris Descartes, Site de la Fondation pour la Recherche Médicale
Crédit illustration : Championnats du monde d'athlétisme IPC 2013. 200 mètres féminin T44. De gauche à droite : Sophie Kamlish (GB), Marie-Amelie Le Fur (France), Marlou van Rhijn (Netherlands)
Fanny Schertzer, licence CC BY-SA 3.0, Wikimedia Commons
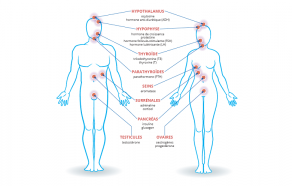
L’activité endocrinienne c’est la vie, la perturbation endocrinienne pose un problème.
Le système endocrinien est l'ensemble des glandes (dites « endocrines ») qui libèrent des hormones dans le sang : ovaires chez les femmes, testicules chez les hommes et pour tous, thyroïde et parathyroïdes, hypophyse, hypothalamus, pancréas (ilôts), glandes surrénales [...]
Accédez au Zoom sur les perturbations endocriniens
Crédit illustration : plateforme PEPPER