Alors que l’Agence internationale de l’énergie note qu’en 2022 les énergies éoliennes et solaires ont dépassé les 11% de l’électricité sur le plan mondial, une conférence de Daniel Lincot au Collège de France et un rapport de l’Académie de technologie sur le photovoltaïque doivent attirer notre attention (1).
Les panneaux solaires
Pour rappel, l’énergie solaire via un panneau photovoltaïque s’appuie sur le fait que l’absorption de photons par un matériau semi-conducteur peut générer un courant électrique (i).
Parmi ces matériaux, le silicium est particulièrement bien placé car son « gap » correspond en énergie à celle du rayonnement solaire (2). Il reste à capturer les électrons excités pour en faire un courant électrique, avec un collecteur. Depuis 1955 et les premières cellules basées sur des jonctions P/N (ii) simples avec 6% de rendement on a d’abord amélioré le dopage avec des éléments comme le bore ou le phosphore. L’adjonction de grille pour drainer les électrons, la passivation de la surface et sa texturation pour réduire la réflexion de la lumière ont permis de monter le rendement entre 15 et 20%. L’innovation des hétéro-jonctions avec des dépôts de couches minces sur le silicium cristallin ont encore amélioré le rendement à 26%. Pour aller plus loin on pense à mieux absorber les photons dans l’ultra-violet ou ceux qui ont une grande longueur d’onde : on superpose alors à la cellule silicium d’autres cellules qui ont ces propriétés d’absorption, ainsi les cellules dites « tandem » peuvent atteindre 30 à 40% de rendement (3). La recherche est toujours très active en ce domaine avec les nouvelles pérovskites et les cellules organiques.
Pour l’instant face à la concurrence du silicium, la filière couche mince CIGS (iii) ou CdTe n’a pas encore réussi à s’imposer et ne dépasse pas 5% de la production. Cependant en France Solar Cloth produit des panneaux souples légers et performants puisque les modules en couche mince CIGS atteignent un rendement de 17% pouvant recouvrir les toits trop fragiles ou avoir des applications dans les tentes ou serres photovoltaïques (4).
Le silicium photovoltaïque
Pour fabriquer des panneaux photovoltaïques la chimie des matériaux est complexe et énergivore (5). On peut distinguer six étapes.
- Il faut réduire le sable (silice) par le carbone selon SiO2 + C = Si + CO2. Pour cela on utilise du coke à haute température, 1500 – 2000°C dans un four à arc.
- Le silicium est fondu à 1500 °C et par balayage de gaz on élimine la calcium et l’aluminium initialement présents dans le sable, pour obtenir le silicium métallurgique pur à 98%.
- Par attaque à l’acide chlorhydrique, HCl, on obtient le composé de formule SiHCl3 qui, une fois purifié par distillation à 300°C, est décomposé par le dihydrogène, H2, pour obtenir le silicium suivant la réaction SiHCl3 + H2 = Si + 3 HCl. Fondu sous vide on obtient du silicium pur à « cinq neuf » soit 99,999%
- Les lingots sont alors purifiés par zone fondue pour obtenir du « 7 neuf » (99,99999 %), par le procédé Czochralski). On amorce le bain fondu avec un germe et on étire un cylindre monocristallin (6).
- On découpe ensuite les « wafers (iv) » qui ont 0,2 mm d’épaisseur sur 20 cm et on opère les opérations de dopage dans des fours à atmosphère contrôlée.
- Viennent les opérations de surfaçage puis de montage avec les circuits de cuivre et insertion dans les cadres en aluminium et les protections en verre.
Toutes ces opérations exigent pas mal d’énergie, des réactifs chimiques, acide et bases, des quantités d’eau souvent pure de qualité électronique et inévitablement génèrent des effluents qui demandent à être traités.
La situation en France et en Europe
La France dispose de 17 GW de puissance photovoltaïque installée au premier trimestre 2023 et une production de l’ordre de 2,2% de l’électricité nationale. On est en retard sur le tableau de marche (20 GW en 2023 et 35 GW en 2028) ce qui imposerait d’installer au moins 3 GW par an (7).
Le problème est que si en 2022 les exportations de panneaux photovoltaïques (PV) représentaient 7% de l’excédent de la balance commerciale chinoise les importations de ces mêmes panneaux représentaient 2% du déficit commercial en France. Car la production de silicium de la silice aux wafers est à 95% aux mains de la Chine qui a investi des dizaines de milliards de dollars dans cette filière et qui investit encore dans les nouveaux produits hétérojonction et tandem. Le prix du Watt solaire s’est écroulé et le MWh est devenu compétitif dans les pays très ensoleillés, largement en dessous de 60 €. Cette redoutable machine chinoise a laminé l’industrie européenne du silicium. S’il reste un fondeur allemand Wacker et quelques fabricants de wafer notamment en Norvège, l’Europe n’est riche que de projets exigeants des milliards d’investissements pour espérer émerger sur ce marché en 2030. Et le pire c’est que ces modules PV sont fabriqués actuellement avec une énergie qui en Chine s’accompagne d’environ 600 g de CO2/ kWh, souvent issue de centrales thermique à charbon.
Des calculs très précis ont été faits sur les dépenses énergétiques des six stades de fabrication. La dépense énergétique la plus forte est paradoxalement le dernier stade, on n’est pas très loin de 3000 kWh par m² de modules. S’ils sont produits en Chine cela représente près de 1,8 tonnes de CO2 alors que s’ils étaient fabriqués en France cela ne représenterait plus que 180 kg, méritant mieux le label bas carbone. Sachant qu’un panneau PV produit en moyenne 300 kWh/m² par an on voit qu’il faut quelques années de production pour compenser l’énergie dépensée pour sa fabrication.
D’où l’intérêt en France et en Europe pour des solutions moins énergivores telles que les couches minces de CIGS développées par l’IPVF (l’Institut Photovoltaïque d'Île-de-France) à Saclay.
Les recommandations de l’Académie de technologie sont de dire que même si l’Europe est actuellement pieds et mains liés à un seul fournisseur, la Chine, comme le fut l’Allemagne au gaz russe, la situation est grave mais non catastrophique. Si au niveau européen on s’entend pour produire, du sable au wafer, des cellules de silicium européennes fabriquées avec une énergie plus propre, nous avons une carte à jouer en industrialisant au plus vite les technologies TOPcon (v) et Tandem à base de pérovskites pour avoir un avantage concurrentiel sur le rendement des cellules. Indépendamment, encourager l’industrialisation des panneaux couches minces qui peuvent s’avérer décisifs dans l’évolution du photovoltaïque et redonner une compétitivité européenne dans le PV bas carbone.
Enfin il faut, à l’instar du « Inflation Reduction Act » (IAR) des États-Unis, que l’Europe se donne les moyens d’un investissement colossal et des arrangements fiscaux pour une industrie capable de rivaliser avec les géants américains mais surtout chinois.
Jean-Claude Bernier
Juin 2023
(i) Le comportement électrique des semi-conducteurs peut être expliqué par le modèle de la théorie des bandes d’énergie. Dans ce modèle, les électrons dans l’état fondamental (état stable, non conducteur), sont répartis dans une bande d’énergie appelée bande de valence. Si un apport extérieur d’énergie est apporté au matériau, certains électrons peuvent absorber cette énergie et sauter dans une bande dite de conduction. Le matériau conduit alors le courant. L’écart d’énergie entre ces deux bandes est appelé bande interdite ou « gap ». Il faut donc que l’apport d’énergie extérieure soit supérieur à ce gap.
(ii) Pour en savoir plus sur les jonctions P/N : L’essentiel sur les cellules photovoltaïques sur le site du CEA
(iii) CIGS pour les éléments chimiques cuivre, indium gallium, et sélénium.
(iv) On appelle Wafer une « tranche » ou une plaque très fine de matériau semi-conducteur monocristallin.
(v) « Nous avons choisi la technologie TOPCon pour notre future gigafactory française de production de cellules solaires », L'Usine nouvelle, 23 mai 2022
Pour en savoir plus
(1) La solution photovoltaïque, D. Lincot, vidéo CNRS
Énergie solaire photovoltaïque et transition énergétique, D. Lincot, leçon inaugurale au Collège de France - D. Lincot
Académie des technologies : pour le développement de productions industrielles de panneaux photovoltaïques en France et en Europe sur le site de l'IPVF
(2) La conversion photovoltaïque de l’énergie solaire, D Lincot, Revue du Palais de la découverte n° 344-345 (janvier-février 2007)
(3) Les nouvelles filières photovoltaïques, D. Lincot, vidéo CNRS
(4) Les filières photovoltaïques en couches minces et leurs perspectives d’application à l’habitat, D. Lincot, in La chimie et l’habitat (EDP Sciences, 2011)
(5) L’électronique, c’est de la chimie, P. Bray, O. Garreau et J.C. Bernier, fiche Chimie et en fiches… cycle 4, Mediachimie.org
(6) De la chimie au radar du rafale, Bertrand Demotes-Mainard, Colloque chimie et technologie de l’information (2013)
(7) La R&D au service de la décarbonation de l’industrie, J. Ph. Laurent, Colloque Chimie et énergie nouvelles (2021)
Crédit illustration : andreas160578/ Pixabay
Fin avril une déclaration de France Chimie qui regroupe la plupart des industries chimiques en France a fait état de ses préoccupations face à l’inflation, à la crise de l’énergie et à la perte de compétitivité face aux États-Unis.
L’industrie chimique européenne très énergivore a subi de plein fouet l’inflation des matières premières et le coût de l’énergie qui ont entamé sa compétitivité. Elle a vu sa productivité chuter de 6,2% en 2022 (11% en Allemagne) avec des périodes d’arrêt de production. En France le secteur s’est montré plus résilient avec une baisse en volume de 3%. C’est le secteur amont de chimie minérale et de chimie organique qui a le plus reculé (10%) comme ses voisins européens, avec comme exemples l’ammoniac et le PVC lourdement handicapés par le coût du gaz et de l’énergie. Dans l’Hexagone ce recul a été compensé par le secteur aval où les spécialités n’ont baissé que de 1,9% alors que celui des savons, cosmétiques et produits d’entretien a lui au contraire progressé de 6% en 2022. Une des caractéristiques de la chimie française est que ce secteur de spécialités des parfums, cosmétiques et détergents représente près de 60% de la valeur ajoutée.
La chimie reste encore le premier secteur exportateur avec 81,5 milliards d’euros devant l’agroalimentaire et un solde positif de 9,5 milliards devant l’aéronautique. En 2022 les investissements ont progressé de 7% à plus de 6 milliards d’euros, portée par le plan de relance France 2030. Ce sont surtout des projets de croissance et plus de 250 projets industriels sur le recyclage notamment des plastiques, sur la transition énergétique et écologique (1) et sur les filières haute performance comme celles des batteries et l’hydrogène. La branche emploie 225.000 salariés (2) et renouvelle ses compétences avec une nouvelle croissance de ses effectifs en accueillant 25.000 nouveaux employés y compris les alternants (3) .
Les perspectives pour 2023 ne sont pas flamboyantes, l’inquiétude vient du plan de soutien aux industries vertes aux États-Unis. Lourd de 400 milliards d’aide publique « l’Inflation Reduction Act » (IRA) va augmenter encore le manque de compétitivité européen. Les exemples du PVC et surtout de l’hydrogène décarboné (4) sont très illustratifs. Alors qu’en Europe son prix est de l’ordre de 5 à 7 euros le kilo aux États-Unis revient à 2 euros et même moins s’il est issu de l’électrolyse alimentée en électricité par l’énergie nucléaire. France Chimie demande à ce que les aides dans les projets d’investissements soient accrues comme aux USA et pousse à une réforme du marché de l’électricité en Europe, seuls moyens de conserver une industrie chimique sur notre continent.
Jean-Claude Bernier
avril 2023
Pour en savoir plus
(1) Pour une industrie chimique propre et durable, C. Agouridas, J.-C. Bernier, D. Olivier et P. Rigny in La chimie et la sécurité des personnes, des biens, de la santé et de l'environnement, collection Chimie et... Junior, EDP Sciences, Fondation de la Maison de la Chimie (2016)
(2) Les chimistes dans l’industrie chimique, fiche Les Chimistes dans…, site Mediachimie.org
(3) Village de la Chimie - 10 et 11 février 2023 , site Mediachimie.org
(4) Les derniers résultats de la production de l’ hydrogène « décarboné », Zoom sur... , site Mediachimie.org
Crédit illustration : Image par Talpa de Pixabay
Les bactéries sont des cellules très simples protégées par une paroi et responsables d'infections quand elles pénètrent et se multiplient dans un endroit de l'organisme où elles ne devraient pas être. Pour combattre une infection, des antibactériens sont utilisés avec pour objectif d’inhiber les différents processus indispensables à la vie de la bactérie ciblée. Mais un grand nombre de bactéries ont développé des résistances aux antibactériens rendant la lutte contre les infections plus difficile.
Pour mieux comprendre comment la bactérie crée une infection, les processus mis en jeu par les antibactériens et la résistance des bactéries, accédez :
- au Zoom sur les bactéries et les antibactériens
- et au Zoom sur la résistance des bactéries aux antibactériens
Crédits : illustration E. coli : Image par Gerd Altmann / Pixabay
Dès avril les média alertent les Français sur le faible niveau des nappes phréatiques et anticipent sur une crise de l’eau qui peut se produire en 2023 si la sécheresse due au manque de pluie s’installe à nouveau comme en 2022. L’an passé, 93 départements avaient pris des mesures de restriction d’usage de l’eau. En ce printemps, quelques communes font face à l’asséchement de leur réseau de distribution d’eau potable, d’autres mettent fin aux projets de nouveaux lotissements qui risqueraient de n’être pas alimentés. Les incidents violents dans les Deux-Sèvres entre les opposants aux réserves d’eau « les bassines » pour l’irrigation agricole et les forces de l’ordre montrent que les variations de la météo (1) peuvent enflammer nos concitoyens.
Comment faire pleuvoir ?
Et si nous nous intéressions aux nuages, sources d’eau, et pluies qui nous ont cruellement manquées en 2022. Les nuages sont composés d’une multitude de gouttelettes d’eau en surfusion qui ne demandent qu’à se transformer en glace, qui, en perdant de l’altitude, engendrent la pluie. Parlons un peu de ce phénomène physique qu’est la surfusion. En haute altitude, à des températures en dessous de zéro pour un liquide pur comme l’eau, sans impuretés, l’énergie libérée par la chaleur latente de solidification (2) ne compense pas l’énergie nécessaire pour créer l’interface solide–liquide. Cet état méta stable est perturbé par des germes comme des poussières, des aérosols, ou un abaissement brutal de la température, causes qui permettent à des micro-cristaux de glace (3) de se former et de croître en capturant l’eau des gouttelettes voisines ou en agglutinant d’autres cristaux.
Pour favoriser ces phénomènes, il y a deux types d’ensemencements ; le premier pour éviter la grêle on disperse de grandes quantités de particules d’iodure d’argent (AgI) qui est insoluble dans l’eau mais qui a une structure cristalline proche de celle de la glace. Ces milliards de petites particules vont multiplier les noyaux de croissance de cristaux de glace, empêcher qu’ils grossissent et favoriser leur fonte. Le second est d’ensemencer avec des sels solubles dans l’eau comme le chlorure de sodium, ils vont alors dissoudre la glace formée (4) et transformer les cristaux ou grêlons en gouttes de pluie. Il y a une troisième variante celle où est déversée de la glace sèche (de la neige carbonique) ou même de l’azote liquide, l’abaissement brutal de la température va former une myriade de cristaux de petite taille qui vont fondre rapidement en pluie dans les couches atmosphériques plus chaudes.
Une technique généralisée
Historiquement l’ensemencement des nuages pour provoquer la pluie a été utilisé en 1946 dans la région de New-York où sévissait une sécheresse durable. Elle s’est ensuite généralisée dans plusieurs pays du monde. En France c’est l’Anelfa (Association Nationale d’Études et de Lutte contre les Fléaux Atmosphériques) qui dès 1951 a mis en étude cette pratique en liaison avec des universités, notamment dans les régions vinicoles sujettes aux orages de grêles. Elle a mis au point un générateur de noyaux de congélation. À partir du sol les nuages vont pomper par courant ascendant l’humidité et les milliards de particules d’iodures d’argent dispersés à partir de quelques grammes d’AgI. Pour être efficace il faut intervenir le plus vite possible sur le nuage orageux, car lorsque la grêle s’est déclenchée on ne peut la stopper. D’autres moyens sont utilisés avec des mortiers qui lancent des fusées dispersant l’iodure dans le nuage ou des ballons qui supportent la charge d’iodure et commandés à distance lorsque le ballon est au-dessus du nuage. De nombreux pays ont recourt à ces techniques ; plus d’une dizaine de pays africains devant faire face aux pénuries d’eau les utilisent pour faire pleuvoir. Aux Émirats arabes unis de grosses quantités d’iodure semées par avion ont même réussi à faire tomber de la neige. La Chine a un ambitieux programme d’ici 2025 sur la moitié de son territoire soit plus de 5 millions de km2 de « géo-ingénierie » qui n’est pas sans inquiéter ses voisins. Car il n’y a pas de murs aux frontières entre les pays. On a ainsi vu l’Iran protester contre les programmes d’ensemencement d’Israël et des Émirats, les accusant de voler les nuages et donc la pluie à leurs profits. En réalité s’il est possible de faire pleuvoir un nuage plus vite que prévu, sous un ciel clair bien bleu il est impossible de créer un nuage qui va précipiter.
Une efficacité discutée
La communauté scientifique reste très mesurée sur l’efficacité des ensemencements. L’Anelfa, qui a un très bon réseau en France soutenue par les régions, a mis en place des « grêlomètres » et affirme qu’il y a une réelle diminution de 50% de l’intensité de la grêle lorsque les générateurs sont mis en action suffisamment tôt. Les experts de l’Organisation Météorologique Mondiale (OMM) restent prudents sur la modification du temps (5) et soulignent que même s’il reste difficile de faire pleuvoir là où on veut, la recherche et les techniques se sont intensifiées et ont bien progressé avec le changement climatique. Reste un dernier point polémique la toxicité possible de l’iodure d’argent dans l’environnement qui sous les rayons UV du soleil se transforme en argent et en dérivés de l’iode. D’après l’Anelfa les quantités libérées sont 1000 fois inférieures au seuil de toxicité.
Un nouveau plan sur l’eau en France
Le président E. Macron a présenté le 30 mars un certain nombre de mesures pour planifier la gestion de l’eau en France ; bien sûr l’ensemencement des nuages n’en fait pas partie, mais quantité d’objectifs concernant l’anti-gaspi et la sobriété sont sous-tendus de budgets chiffrés. Quoique l’opinion publique puisse penser, la France n’est pas trop mal dotée (6) avec une moyenne de précipitations de 935 mm/an (avec bien sûr de grandes disparités régionales) c’est environ 500 milliards de m3 d’eau qui nous tombent dessus. Les prélèvements sont de l’ordre de 32 milliards dont une grande partie est restituée, la consommation en eau potable représente une faible partie de l’eau consommée, sa production est de l’ordre de 5 mrds m3. Or on sait que le réseau de distribution de 850 000 km qui commence à dater devrait être mieux entretenu car plus de 20% du débit est perdu et gaspillé par des fuites permanentes ou occasionnelles soit presque 1 mrd m3, on est évidemment loin des quelques millions de m3 obtenus par ensemencement et l’urgence est bien de mettre tout en œuvre pour réparer et moderniser le réseau d’ici 2030.
Jean-Claude Bernier
avril 2023
Pour en savoir plus
(1) Fluctuations climatiques extrêmes et sociétés au cours du dernier millénaire, E. Garnier, colloque Chimie et changement climatique (novembre 2015)
(2) Changement d’état, vidéo Palais de la Découverte
(3) Comment est la neige cet hiver ?, Question du mois, site Mediachimie.org
(4) Pourquoi met-on du sel sur les routes lorsqu’il gèle ?, Question du mois, site Mediachimie.org
(5) Faut-il fertiliser l’océan pour contrôler le climat ?, S. Blain, Colloque La chimie et la mer (2009)
(6) L’eau, une ressource indispensable pour la ville, A. Charles, A. Harari, et J. C. Bernier, fiche Chimie et… en fiches, Mediachimie.org
Crédit illustration : Łukasz Cwojdziński / Pixabay
Comment fonctionne une éolienne ?
L’éolienne ou « aérogénérateur » est la version moderne du moulin à vent dont l’utilisation remonte au 7e siècle en Asie Mineure. Son nom vient d’Éole, « dieu du vent, vif, rapide, inconstant ».
Elle transforme l’énergie cinétique du vent - gratuite, renouvelable mais intermittente - en énergie mécanique. Celle-ci est ensuite convertie en énergie électrique via un alternateur. Par exemple dans une éolienne à entrainement direct, le vent agit sur des pales qui entraînent la rotation d’un axe (ou arbre) sur lequel est fixé un aimant cylindrique, lui-même placé au sein d’un bobinage en cuivre (stator), ce qui induit une tension électrique aux bornes de celle-ci.(i)
Cette électricité est ensuite acheminée à l'aide de câbles conducteurs vers le lieu de stockage ou d’utilisation.
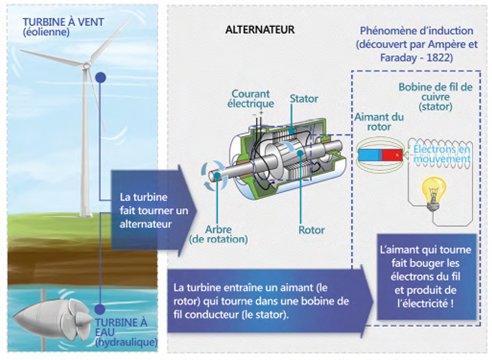
L’alternateur transforme l’énergie mécanique (rotation d’une roue sous l’effet d’un courant liquide ou gazeux) en énergie électrique. C’est l’élément de base des centrales électriques à charbon, gaz ou pétrole ainsi que des centrales nucléaires et des éoliennes. Source : De la force musculaire aux énergies renouvelables in La chimie, l'énergie et le climat, collection Chimie et... Junior, EDP Sciences, Fondation de la Maison de la Chimie (2017) p. 29
Quels éléments constituent une éolienne ?
Une éolienne comporte 3 parties principales :
- Une tour (ou mât) qui élève le système dans les zones ventées. Elle est en acier et/ou en béton, solidement ancrée dans le sol ou dans les fonds marins s’ils sont peu profonds au voisinage des côtes. Il existe aussi désormais des éoliennes flottantes en pleine mer (offshore) ancrées aux fonds marins par des câbles.
Le mât peut atteindre plus de 100 m de hauteur et ses fondations accueillent une masse de béton d’environ 600 à 800 tonnes (95% du poids de l’éolienne…). - Les pales (au nombre de deux ou trois) qui tournent sous l’action du vent peuvent avoir de 25 à 50 mètres de long. Elles doivent donc être mécaniquement solides, légères et résistantes à la corrosion. C’est pourquoi, pour pouvoir les mouler, elles sont fabriquées jusqu’à ce jour dans un matériau composite thermodurcissable(ii), qui répond à ces contraintes et qui est constitué de fibre de carbone ou de fibre de verre piégées dans une résine(iii) époxy ou polyester(iv). Malheureusement les polymères thermodurcissables ne sont pas recyclables. De nouvelles résines à caractère thermoplastique et recyclables voient le jour(v).
- La nacelle qui est le cœur de la machine. Elle abrite tous les composants essentiels qui transforment l'énergie cinétique du vent, en énergie mécanique de rotation et in fine en électricité.
On y trouve :- Un système mécanique d’engrenages et de moyeux pour la transmission et l’accélération de la rotation produite par le vent.
- L'alternateur ; certains des aimants permanents utilisés contiennent au moins un des éléments magnétiques suivants : fer, cobalt ou nickel, alliés à des métaux de terres rares (néodyme, dysprosium, samarium).
L’alliage à base de fer, néodyme et bore, noté FeNdB (de formule exacte Nd2Fe14B) est un exemple d’aimant puissant. À ce jour, l’usage de ces aimants puissants concerne essentiellement les éoliennes en mer, avec la technologie synchrone à entrainement direct et seulement 6,2% des éoliennes terrestres françaises recourent à celle-ci(vi). Les câbles pour injecter l’électricité produite dans le réseau ou pour la stocker via des stations de transfert d’énergie par pompage (STEP) ou dans des batteries.
Pourquoi et comment recycler une éolienne ?
La durée de vie moyenne est de 25 ans. Les plus anciennes éoliennes installées sont déjà en bout de course et doivent être remplacées.
La réglementation de plus en plus contraignante exige, lors d’un démantèlement, la remise en état des lieux d’implantation et le recyclage des matériaux au-delà de 90%.
Étant donné le développement attendu des parcs éoliens sur terre et en mer, le recyclage des éoliennes en fin de vie doit largement se développer, entre autres pour économiser les matières premières nécessaires.
Le prix de revient d’une éolienne industrielle de 5 MW est estimé à 5 millions d’euros, soit 1 million par MW. Ce coût élevé justifie la récupération et le recyclage des constituants.
Récupération du béton ou de l’acier
Elle est déjà opérationnelle, car le béton et l’acier sont présents en grande quantité dans maintes autres productions.
Les parties métalliques comme le mât (s’il est en acier) et le rotor (axe solidaire des pales) se recyclent sans problème dans les filières existantes. La valeur marchande de ces métaux justifie le démontage d’une éolienne.
Le béton, composé de ciment, d'eau, de sable et de gravillons, peut parfaitement être concassé ou broyé et réutilisé pour former de nouvelles briques, éléments de construction ou revêtements de route.
Pour les métaux tels que le cuivre, leur récupération et recyclage sont largement répandus.
Les problèmes se posent avant tout pour les pales et certains aimants et la recherche se concentre sur leurs recyclages.
Les aimants permanents
Actuellement, la technologie avec aimants permanents contenant des terres rares reste modeste en France(vii). Mais les quantités à recycler bien que minimes sont précieuses.
Ces terres rares proviennent majoritairement de Chine et leur coût est croissant. Toutefois l’exploitation de nouvelles sources se développe ailleurs, pour s’affranchir de cette dépendance(viii). Par ailleurs, leur extraction est très polluante et elles ont des propriétés physico-chimiques très voisines, rendant leur séparation difficile (dissolution sélective dans des solvants organiques).
Les aimants permanents sont actuellement traités par un procédé de décrépitation à l’hydrogène(ix) qui fournit une poudre qui présente une faible teneur en oxygène, réutilisable pour obtenir des aimants par frittage.
Un nouveau procédé chimique propose une alternative en remplaçant l’hydrogène par l’eau. Les aimants sont mis en contact avec de l’eau sous des pressions et températures modérées, ce qui conduit à la pulvérisation de l’aimant et permet une réutilisation des grains magnétiques.
Enfin, les grandes entreprises de l’éolien cherchent à développer des aimants de nouvelle génération pour s’affranchir de l’usage des terres rares.
Les pales
Le démontage et le transport des pales sont complexes. Comme le broyage et l’enfouissement ne sont plus autorisés, leur recyclage se limite pour l’instant au réemploi, par découpage ou usinage, des résines très solides qui les composent, ce qui fournit mobilier urbain, bouches à incendie, abris de vélos ou de bus, jeux de plein air, etc.
Cependant la recherche en matériaux développe une pale d’éolienne 100% recyclable, en composite fibres de carbone ou de verre piégées dans une résine thermoplastique(x). La méthode chimique de recyclage utilisée consiste alors dans un 1er temps à séparer la fibre de verre de la résine par fusion de celle-ci, puis à la dépolymériser complétement afin de récupérer les monomères purs qui permettront une nouvelle synthèse du polymère. Les tests grandeur nature sont en cours, en particulier sur les propriétés mécaniques de ce nouveau composite(xi). Dans le cas des fibres de carbone coûteuses et de plus en plus utilisées, des technologies sont mises en œuvre pour les récupérer(xii).
Conclusion
Le rendement d’une éolienne varie de 30 à 50% voire 65% de sa puissance théorique (en fonction de son implantation, de la taille des pales, de la force et des fluctuations du vent) ; l’éolienne fonctionne pour des vitesses du vent comprises entre 11 et 90 km/h.
L’énergie éolienne est la troisième source d'électricité décarbonée en France, (derrière les énergies nucléaire et hydraulique)(xiii). Elle est appelée à jouer un rôle majeur dans la transition vers des énergies décarbonées. Toutefois, l’obtention de l’acier et du béton nécessaires à sa construction et le démantèlement sont sources d’émission de dioxyde de carbone : en moyenne 14 g de CO2 par kWh pour l’éolien comparés à 4 g pour l’hydraulique, 16 g pour le nucléaire, 48 g pour le photovoltaïque, 469 g pour le gaz naturel et jusqu’à 1000 g pour le charbon(xiv).
On comprend donc la nécessité de bien choisir les matériaux et matières premières nécessaires à la construction des éoliennes et à leur fonctionnement optimal tout en ayant prévu dès leur conception le procédé de recyclage en fin de vie.
Andrée Harari et Françoise Brénon
(i) Il y a plusieurs types d’éoliennes : celles à entrainement direct dites synchrones, avec un rotor constitué d’aimants permanents et les asynchrones avec un rotor bobiné en cuivre, sans aimant, utilisées pour les éoliennes terrestres où l'entretien et révision sont plus faciles qu'en mer. Pour en savoir plus sur le fonctionnement d’une éolienne sans aimant, on consultera la ressource très pédagogique du blog de Timo van Neerden.
(ii) Un polymère thermodurcissable a une structure moléculaire tridimensionnelle, demeure à l’état solide une fois durci et sa forme ne peut alors plus être modifiée. Il ne peut pas être refondu.
(iii) On appelle résine le mélange liquide contenant des additifs et le ou les monomères réactifs initialement dilués.
(iv) Les composés de type époxy sont à base de Bisphénol A et les polyesters sont de type orthophtalique.
(v) On peut citer par exemple la résine Elium® de Arkema, à base de polyacrylate. Voir la fiche de préparation au Grand oral – Mediachimie/ Nathan « Quel rôle joue la chimie pour les matériaux stratégiques ? »
(vi) Selon un avis technique de l’Ademe datant d’octobre 2020, 6,2% des éoliennes terrestres françaises recouraient à cette technologie, soit 372 tonnes d’aimants permanents contenant 122 tonnes de néodyme et 17 tonnes de dysprosium. Les éoliennes asynchrones avec boites de vitesse n’utilisent pas d’aimant mais nécessitent plus d’entretien.
(vii) Terres rares, énergies renouvelables et stockage d'énergies Librairie Ademe
(viii) Ressources déjà connues au Brésil, au Viet Nam, en Russie, en Inde, en Australie… Nouveau gisement découvert en Laponie.
(ix) Décrépitation : l’aimant est placé sous hydrogène, qui diffuse et forme des poches qui font exploser la structure. La poudre obtenue est ultérieurement broyée et réutilisable pour obtenir des aimants par frittage.
(x) Un polymère thermoplastique est rigide à l’état solide mais se ramollit à la chaleur et peut être durci à nouveau.
(xi) Projet ZEBRA piloté par l’IRT Jules Verne et un consortium d’acteurs majeurs de l’industrie, dont Arkema, Corning…
(xii) Que faire des pales d’éoliennes ?, J.-C. Bernier, éditorial (Mediachimie.org)
(xiii) Pour avoir une idée des productions d’énergie par l’éolien, dont les valeurs évoluent régulièrement, on pourra consulter les sites suivants : pour 2019 EDF l’éolien en chiffres 34,1 TWh représentant 6,3% de la production d’électricité et pour 2022 Ministère de la transition écologique avec 25,0 TWh au cours des trois premiers trimestres 2022, soit 7,4% de la consommation électrique française. Et le Vrai / faux sur l’éolien terrestre
(xiv) Rapport ADEME 2015- page 7- Impacts environnementaux de l'éolien français
Pour aller plus loin
Que faire des pales d’éoliennes ?, J.-C. Bernier, éditorial (Mediachimie.org)
De la force musculaire aux énergies renouvelables, in La chimie, l’énergie et le climat, collection Chimie et junior (EDP Sciences, 2017) p. 29 à 31
Les enjeux matériaux pour la fabrication et le recyclage des éoliennes, Frédéric Petit (Siemens), résumé et conférence Colloque Chimie et matériaux stratégiques (9/11/2022)
Chimie métallurgique pour résoudre les problèmes des métaux rares, J.-C. Bernier, résumé et conférence Colloque Chimie et matériaux stratégiques (9/11/2022)
Crédit illustration : EdWhiteImages/Pixabay
L’éclairage participe à près de 20 % de la consommation mondiale d’électricité. L’ADEME prévoit une baisse d’environ 50 % de la consommation liée à l’éclairage vers 2030. Par ailleurs, l’arrêt des ventes des lampes à incandescence d’une part, des lampes et tubes fluorescents et lampes halogènes d’autre part est fixé pour 2023. La période des fêtes de Noël voit chaque année les rues et places de nos villes et villages s’illuminer. L’éclairage est assuré par des diodes électroluminescentes pour diminuer les dépenses dues à la consommation électrique associée.
Accédez au Zoom sur Les progrès de l’optoélectronique : des LED aux OLED
Crédit illustration : MolnarSzabolcsErdely - Pixabay
Actuellement en France, un homme sur deux et une femme sur trois seront atteints d’un cancer dans leur vie… on dénombre environ 380.000 nouveaux cas de cancer par an et on enregistre 140.000 décès ! [1]. Le cancer est une maladie complexe qui résulte d’une prolifération anormale des cellules. Comme chacun sait, il n’y a pas un cancer mais des cancers et ceci impose donc de posséder des stratégies curatives adaptées à chaque type de cancer. Les principales stratégies utilisées dans le traitement des cancers sont la chirurgie, la radiothérapie, la chimiothérapie, les thérapies ciblées, et l’immunothérapie. […]
Accédez au Zoom sur Les traitements des cancers : petites ou grosses molécules ?
En cette fin de février et début de mars se tient à Paris le Salon de l’Agriculture qui après près de trois ans de pandémie renoue avec une tradition bien établie et avec probablement autant sinon plus de visiteurs qu’en 2019. Cette fête du monde agricole ne doit cependant pas cacher les fortes préoccupations des agriculteurs sur la pérennisation de leur métier et de leurs exploitations (1).
Comme nombre de PME ils sont frappés par le coût de l’énergie, gaz, électricité et fuel ; s’y ajoute l’augmentation du prix des engrais et intrants, les diverses réglementations concernant les phytosanitaires et enfin la sécheresse qui semble s’installer durablement, indice du changement climatique.
1. L’énergie
Comme nombre d’entreprises qui ne bénéficient pas du bouclier tarifaire les agriculteurs doivent faire face à une augmentation plus ou moins forte des tarifs de l’électricité, du gaz et du fuel pour les engins agricoles. Ils peuvent cependant bénéficier de subventions du ministère et de l’ADEME dans le cadre de l’accélération des énergies renouvelables. Pour les installations de biométhane (2), on sait qu’il est possible par fermentation bactérienne anaérobie de traiter les déchets végétaux et déjections animales par hydrolyse acidogénèse puis acétogénèse donnant un acide acétique qui se transforme en gaz CH4 + CO2 en laissant un digestat riche en azote et ammoniaque. Il y a maintenant en France 1600 unités dont 966 produisant de l’électricité et 442 qui après purification injectent le méthane dans le réseau. GDF rachète le biométhane entre 95 € et 45 € le m3 et EDF 140 à 190 € le MWh ce qui peut faire un complément de revenu agricole.
Se met en place aussi l’agrivoltaïque, qui consiste à mettre au-dessus d’une culture habituelle des nouveaux panneaux solaires semi transparents qui fournissent de l’électricité en fonction de l’ensoleillement qui profite aussi aux cultures sous-jacentes. Les nouveaux panneaux (3) avec des rendements de l’ordre de 20% vont bientôt être concurrencés par les panneaux PV tandems qui mêlent silicium et pérovskites avec un rendement amélioré. L’IPV de Saclay que nous connaissons bien s’apprête à lancer une fabrication industrielle de tels panneaux en Alsace avec VOLTEC Solar.
2. Les intrants
Après la crise du gaz en Europe dont les prix avaient atteint des sommets en mars 2022, la pénurie d’ammoniac (4) avait aussi atteint les engrais azotés qui avaient dépassés les 1000 €/t en avril 2022 semant la panique notamment dans les exploitations familiales. Depuis, le cours du gaz est retombé à un niveau de l’ordre de 50 € le MWh, l’ammonitrate est aussi retombé à environ 500 €/t et l’urée à 400 €/t, niveaux qui cependant sont le double de ceux de 2020. Cela entraine une « sobriété » dans l’épandage de ces engrais qui, sans aller vers une agriculture « bio » qui représente en France environ 7 à 10 % des exploitations, va tout de même modifier le rendement des sols et probablement une baisse de revenus.
3. Les insecticides et l’Europe
Sans revenir sur « le glyphosate » interdit en Europe mais toujours pas sur d’autres continents, en janvier une directive de Bruxelles met fin aux dérogations nationales sur les néonicotinoïdes (5) enrobés autour de la graine de betterave. La France avait interdit dès 2018 plusieurs insecticides qui agissent sur le système nerveux des insectes dont l’imidaclopride et l’acétamipride. Huit États européens avaient profité de cette dérogation pour autoriser leurs agriculteurs à utiliser les semences déjà enrobées pour la campagne betteravière 2023. En France le ministre de l’Agriculture a l’interprétation la plus stricte, celle où le directive de Bruxelles s’applique immédiatement. Les betteraviers français protestent devant cette concurrence qui s’installe entre productions européennes en rappelant qu’en 2020 leur récolte avait été amputée de 30% suite aux attaques de pucerons ravageurs. Ils sont d’autant plus remontés qu’en Allemagne l’acétamipride est autorisé en pulvérisations.
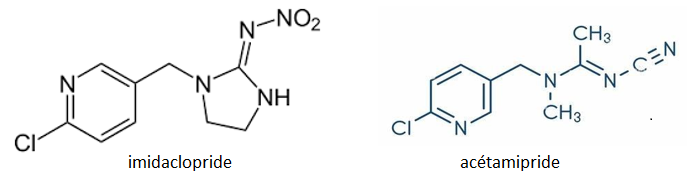
Même si on voit dans la structure des deux molécules une assez forte différence dans la chaine azotée (6) il est probable que leur mode d’action sur les insectes ravageurs est de même type. Une fois de plus on constate que le principe de précaution vis-à-vis de l’environnement et de la biodiversité se heurte à des considérations de concurrence entre États.
4. L’eau recyclée
L’impact du changement climatique se fait ressentir, l’augmentation des températures et la baisse des précipitations se traduisent par une baisse des rendements et de la qualité des produits agricoles (7). Dès lors, la réutilisation des eaux usées (REUT) est une alternative qui devrait permettre la pérennisation de l’agriculture et la préservation des ressources en eau. Déjà pratiquée en Italie et en Espagne (8 et 14% respectivement), peu développée en France où sur le gisement de 8,4 Mrds de m3 seuls 8 à 10 millions de m3 sont utilisés chaque année, alors que le gisement exploitable est 1,6 Mrds.
Et pourtant ces eaux usées présentent de multiples avantages pour l’agriculture – elles pallient un problème temporaire d’accès à l’eau d’irrigation – leur volume n’est pas soumis aux arrêtés préfectoraux de restriction d’usage de l’eau - si aucun traitement de dénitrification et de déphosphorisation n’est réalisé par la station d’épuration leurs teneurs en éléments fertilisants organiques n’est pas négligeable (8).
Bien sûr elles doivent obéir à une réglementation stricte et à des prescriptions sanitaires pour ne pas mettre en danger la santé publique. Suivant leurs qualités elles sont classées en quatre classes en fonction de l’usage :
- pour les cultures maraîchères, fruitières et légumières non transformées par un traitement thermique - qualité A
- pour les cultures maraichères, fruitières et légumières transformées par un traitement thermique – qualité A ou B
- pour les cultures céréalières et fourragères – qualité A ou B ou C*
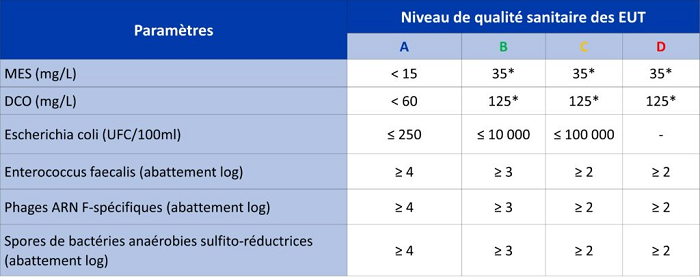
Selon l’arrêté du 18 juillet 2015 relatif aux systèmes d’assainissement collectifs et non collectifs (legifrance.gouv.fr),
figure provenant du site Bonnes pratiques pour l’eau du Grand Sud-Ouest
Il ne faut pas se cacher que la procédure pour en arriver à l’irrigation est complexe, il faut avoir accès aux eaux usées par une collectivité ou une société locale d’eau et d’assainissement. Il faut ensuite confier le stockage et la distribution à une société prestataire agrée et financer ces opérations par le groupe d’agriculteurs concernés. Si dans les régions littorales le REUT est plus adapté car il vise à la réutilisation de l’eau douce avant son rejet à la mer dans les régions continentales il pose plus de problèmes. D’autant que les prescriptions européennes en matière de classement semblent se durcir en 2023.
Jean-Claude Bernier
février 2023
Pour en savoir plus
(1) Série chimie et agriculture durable pour tous (vidéos), Mediachimie.org
(2) Les déchets valent de l’or ! (fiche Chimie et... en fiches, Mediachimie.org)
(3) Les nouvelles filières photovoltaïques (vidéo, CNRS)
(4) Comment fabriquer des engrais avec de l’air : la synthèse de l’ammoniac (série Une réaction en un clin d'oeil, Mediachimie.org)
(5) Chimie de synthèse et agriculture durable peuvent-elles faire bon ménage ? (fiche Chimie et... en fiches lycée, Mediachimie.org)
(6) Les chimistes dans : L’industrie des phytosanitaires (série Les Chimistes dans, Mediachimie.org)
(7) H2O, la molécule vedette de l’été (éditorial, Mediachimie.org)
(8) Fiche orientation : secteur du traitement de l’eau (Mediachimie.org)
Crédit illustration : Les Haines, licence CC BY 2.0, PxHere
La première chose à savoir est que nous ne sommes pas capables de synthétiser la vitamine C (i). Nous devons donc la trouver dans l’alimentation : les fruits colorés (agrumes, cassis, fraise, kiwi, ananas...) et les légumes frais (poivron, brocoli, chou de Bruxelles...). L'apport nutritionnel quotidien conseillé est d'environ 100 mg chez l'adulte. Comme elle est très fragile, il faut choisir des aliments frais et crus ou très brièvement cuits. Elle se trouve facilement en pharmacie, mais il faut prendre garde à ne pas en consommer plus de 1 g/jour, car en excès elle peut être métabolisée (ii) en oxalate (iii) de calcium et éliminée dans les urines où elle est le composant majeur des calculs rénaux.
Propriétés
Chimiquement, il s'agit de l'acide ascorbique (a).
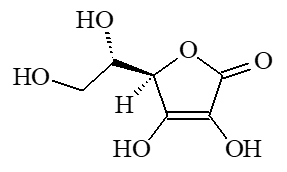 | 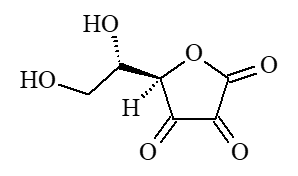 |
| (a) acide L-(+)-ascorbique | (b) acide déshydroascorbique |
Nomenclature IUPAC : (5R)-5-((11S)-1,2-dihydroxyethyl))-3,4- dihydroxy-5-hydrofuran-one |
Ses propriétés viennent de sa capacité à s'oxyder en acide déshydroascorbique (b). C'est donc un antioxydant, qui élimine les dérivés réactifs de l'oxygène (ou radicaux libres). On dit qu'il protège les cellules contre le stress oxydatif, qui est une oxydation des constituants de notre organisme due à un excès de ces radicaux libres (iv) qui sont très instables et oxydent d'autres molécules, ce qui leur confère un important effet cytotoxique (v).
Il n'y a pas de véritable forme de stockage de la vitamine C, et lorsque l'apport cesse les réserves chutent de moitié en 10 à 20 jours.
Le nom ascorbique vient du préfixe a, privatif, et de scorbut. Le scorbut est devenu une maladie rare, mais était très fréquent dès la Renaissance et jusqu'au XIXe siècle chez les marins au long cours. Il s'agit d'une carence en vitamine C, qui provoque un déchaussement des dents, un pourrissement des gencives, des hémorragies et pour finir la mort. Les marins n'avaient pas toujours le loisir de faire escale pour s'approvisionner en fruits et légumes frais. On peut encore l'observer aux USA chez les adolescents suivant un régime alimentaire aberrant (beignets et café noir, sandwich au beurre de cacahuète !).
Rôles physiologiques
On la pare de toutes les vertus : combat la fatigue, le vieillissement de la peau, améliore le tonus, aide à combattre les infections... Sans qu'elle soit la molécule magique que pensent certains, elle possède bien ces propriétés, ce qui sera expliqué plus loin. En 1970, le prix Nobel de chimie Linus Pauling écrivit un article "Vitamin C and the Common Cold" (vi) où il prescrivait de combattre un rhume débutant par la prise de 1 g par jour de vitamine C, ce qui a plutôt fait consensus. Utilisée pendant de courtes périodes à cette dose, elle ne semble pas toxique, puisqu'il a vécu jusqu'à 93 ans !
Elle catalyse l'hydroxylation des acides aminés proline (c) et lysine (d), constituants du collagène, qui entre dans la composition de la peau, de l’os, des dents, du cartilage (on comprend les symptômes du scorbut).
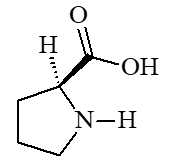 | 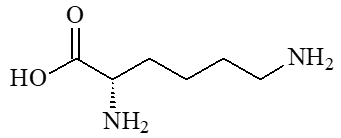 |
| (c) proline | (d) lysine |
La carnitine (e), obtenue à partir de ces mêmes acides aminés, est importante dans la synthèse des acides gras et aussi dans la maintenance de la masse osseuse ; elle joue aussi un rôle dans l'athérosclérose et le risque cardiovasculaire. La vitamine C est essentielle à la synthèse de la carnitine.
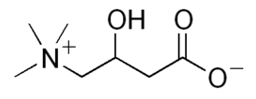 |
| (e) carnitine |
Enfin ses propriétés anti-oxydantes lui confèrent de multiples rôles (synthèse d'hormones, fonctionnement des enzymes, du système immunitaire, absorption du fer par l'intestin).
Plus généralement, les carences en vitamine C, même plus discrètes que dans le scorbut, se manifestent par de l’asthénie, de l’amaigrissement, des céphalées, des douleurs osseuses, une moindre résistance aux infections et des troubles hémorragiques. Le traitement curatif et prophylactique des carences, d’origine alimentaire ou provoquées par des conditions particulières, constitue une indication indiscutable de la vitamine C. Elle est aussi préconisée comme stimulant des défenses de l’organisme au cours des infections virales comme la grippe et le coryza. Il est donc essentiel d'en consommer journellement (fruits et légumes frais).
Nicole Moreau et l’équipe question du mois
(i) La vitamine C est découverte en 1928 par Albert von Szent Györgyi, un scientifique hongrois (prix Nobel de médecine en 1937)
(ii) Le métabolisme est l'ensemble des réactions chimiques qui se déroulent à l'intérieur des cellules d'un être vivant, soit pour lui permettre de synthétiser les molécules qui lui sont essentielles pour se maintenir en vie et se reproduire (anabolisme), soit pour dégrader des molécules en excès voire toxiques (catabolisme).
(iii) Acide oxalique C2H2O4 oxalate de calcium Ca2+, −OOC-COO− ou Ca(COO)2
oxalate de calcium Ca2+, −OOC-COO− ou Ca(COO)2
(iv) Un radical libre est une espèce chimique qui possède un électron non apparié et est très réactif.
(v) Cytotoxique: du grec cyto, cellule et toxique. Il s’agit d’un effet toxique pour les cellules d'un organisme
(vi) « La vitamine C et le rhume »
Pour aller plus loin
Chimie et alimentation : produits de synthèse / produits naturels, Pierre Feillet, in La chimie et l'alimentation (EDP Sciences, 2010) p. 17
Le vieillissement cutané : prévention et réparation, Philippe Piccerelle, Colloque Chimie, dermo-cosmétique et beauté (2016), Le rôle des vitamines dans le vieillissement cutané §4.4. p 102-103
La découverte des vitamines, Louis Irissou, Revue d'Histoire de la Pharmacie (1953) n° 137
François Martin apothicaire et explorateur, Louis Irissou, Revue d'Histoire de la Pharmacie (1946) n° 116, sur le premier apothicaire français s’étant rendu à Sumatra et qui a fait paraitre en 1604 un « Traité du scorbut » à la suite de son voyage où il recommande comme traitement l'emploi du jus de citron.
Crédit illustration : balt/Pixabay