|
Pourquoi les bananes brunissent-elles ?
|
Pourquoi les bananes brunissent-elles ?
Rubrique(s) : Question du mois

Les bananes font partie des fruits qui murissent après cueillette.
Composition de la banane et de sa peau
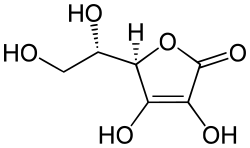
La banane contient entre autres de la cellulose (1), des glucides (2), des lipides (3), des enzymes (4) et des polyphénols (5). Au sein des cellules il existe des compartiments, ce qui permet aux composés phénoliques de ne pas être en contact avec les enzymes présentes.
Altération de la peau et action du froid
Si les membranes des cellules sont altérées ou blessées, les enzymes et les polyphénols vont se trouver simultanément en contact entre eux et avec l’oxygène de l’air.
Cette altération peut avoir lieu par égratignure de la peau, par choc ou par refroidissement excessif. En effets les lipides des membranes des cellules végétales ajustent les proportions d’acides gras insaturés en fonction de la température. Si la température est trop basse la membrane devient trop fluide et perd son étanchéité. Alors enzymes et polyphénols peuvent se mélanger et réagir. La banane subit alors la « chilling injury » ou « blessure par refroidissement ». Pour ce fruit, on estime à 12,5 °C la limite au-dessous de laquelle il y a altération.
Les réactions mises en jeu dans le brunissement
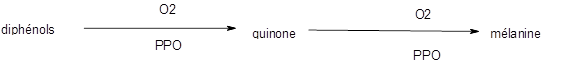
En présence d’oxygène, les enzymes polyphénol oxydases (PPO) (6) permettent l’oxydation des phénols en quinone. Puis le processus se continue par une polymérisation en mélanine (7) qui est brune à noire.
Alors, comment éviter d’avoir des bananes avec des taches noires ?
- Achetez-les plutôt vertes
- Ne les mettez pas au réfrigérateur et ne les choquez pas
- Ne les stockez pas près d’autres fruits car ils émettent tous de l’éthylène qui accélère le murissement
Certains conseillent de les suspendre par la tige et de les envelopper dans un sac plastique pour éviter le contact avec l’oxygène. C’est un peu contradictoire avec l’atmosphère alors confinée qui contiendra de l’éthylène qui va continuer à les faire murir plus vite !
Dans de nombreux cas la lutte est dérisoire car hélas dans les grandes surfaces les fruits sont stockés dans des chambres froides et l’induction des réactions est déjà dans le fruit sur l’étal !
Vous voulez faire une salade de fruits ? Comment éviter le noircissement des bananes coupées ?
Les polyphénol oxydases étant inhibées par les acides, pour éviter que les rondelles de la banane coupée noircissent on peut les arroser avec du jus de citron ou de l’eau dans laquelle on a dissous un peu de vitamine C (acide ascorbique) (8). Ceci est aussi vrai pour les pommes.
Jean-Claude Bernier, Françoise Brénon et l'équipe Question du mois de Mediachimie
(1) La cellulose est un enchaînement linéaire de molécules de D-glucose. C’est le principal constituant de la paroi des cellules végétales.
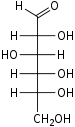 D-glucose.
D-glucose.
Source : https://fr.wikipedia.org/wiki/Glucose
(2) Le glucose est un exemple de glucide.
(3) Les lipides constituent la matière grasse de l’aliment.
(4) Une enzyme est une très grosse protéine jouant un rôle de catalyseur, c’est-à-dire qui est capable d’accélérer une réaction chimique.

Source : http://biochim-agro.univ-lille1.fr/brunissement/co/ch2_II_b.html
(6) Transformation d’un diphénol en quinone. La catécholoxydase est une PPO, métalloenzyme contenant du cuivre qui est le site d’interaction avec l'oxygène et le substrat phénolique.
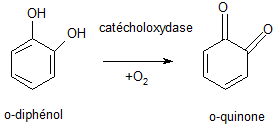
Source : http://biochim-agro.univ-lille1.fr/brunissement/co/ch2_II_b.html
(7) La mélanine est une macromolécule brune.
(8) La vitamine C est identique à l’acide L-ascorbique. Le citron contient naturellement de l’acide citrique et de la vitamine C. L’acide inhibe l’enzyme. La vitamine C est un réducteur qui subit l’oxydation à la place des polyphénols, ce qui les conserve. On parle aussi de rôle « anti-oxydant » ou « anti-oxygène ». La vitamine C porte le nom de code E 300 parmi les additifs alimentaires.
 |
La chimie « inclusive » ?
|
La chimie « inclusive » ?
Rubrique(s) : Éditorial
Le manuel d’écriture inclusive suivi d’une pétition signée par près de 400 enseignants favorables à cette féminisation de la langue fait polémique et débat, même dans les plus hautes sphères de l’Éducation Nationale et du gouvernement. Même le premier ministre confronté à « la déclaration des droits humains et du·de la citoyen·ne » s’en est offusqué. Mediachimie.org toujours à la pointe de l’actualité pédagogique se doit de poser la question : dans notre discipline, la chimie, la parité des genres est-elle respectée ?
Il semble hélas en regardant la classification périodique du tableau de Mendeleïev (1) (2) que le genre masculin prédomine : Li le lithium, Na le sodium, Fe le fer, Co le cobalt etc… Tout paraît masculin, même les dérivés : NaCl le chlorure de sodium, FeO le protoxyde de fer, BaO l’oxyde de baryum. On peut cependant aller chercher Fe3O4 la magnétite, CaO la chaux vive et même Ba(OH)2 la baryte ou SiO2 la silice pour mettre un peu de douceurs dans cette assemblée de brutes.
En réalité le féminin est plutôt réservé à des objets ou assemblages plus évolués et complexes. On parle d’un atome mais mieux d’une molécule, du produit de la réaction, d’une solution et de son soluté. En hommage aux fonctions biologiques supérieures de la femme, on remarque surtout la synthèse chimique et peu son catalyseur. En chimie du solide, même si on identifie le procédé du frittage, l’objet fini reste la céramique.
C’est dire que notre discipline est assez bien équilibrée entre le masculin et le féminin. Les choses se compliquent peut-être au laboratoire ou dans l’entreprise où peuvent travailler l’ingénieur et la laborantine, dénotant un machisme qui n’est plus d’époque. Heureusement dans les écoles de chimie de la fédération Gay-Lussac il y a maintenant autant d’élèves féminines que masculins qui préparent des diplômes d’ingénieur·e·s - si j’applique la règle du point médian encore appelé point d’altérité ! Mais que faire avec les mots épicènes identiques au masculin et au féminin comme linguiste mais aussi chimiste ? Aurais-je l’audace lors d’une évaluation dire et écrire : « ce laboratoire comporte d’excellent·e·s chimistes bien formé·e·s par des professeur·e·s sérieux·euses ». Cela allongera sans doute mes rapports et mes mails.
Mediachimie.org a déjà souligné depuis longtemps dans les fiches métiers (3) qu’ils étaient accessibles soit à un homme soit à une femme (H/F) et de nombreuses vidéos montrent autant de femmes que d’hommes occupant des fonctions en laboratoire ou en entreprise. Faudra-t-il modifier toutes les fiches pour indiquer directrice ou directeur d’usine, assistant ou assistante d’ingénierie ou encore technicien.ne de laboratoire… ou abandonner la langue française pour researcher, manager, physicist… ? Nos amis canadiens qui ont franchi le pas depuis longtemps nous regardent curieusement, mais les gardiens du temple de l’Académie française auront sans doute un regard plus sévère.
Jean-Claude Bernier
décembre 2017
Quelques ressources pour en savoir plus
(1) Site des éléments chimiques
(2) Classification périodique (application)
(3) Fiches métiers
Marie Curie décrit les expériences qui lui ont permis de déterminer la masse molaire du radium par précipitation du chlorure d’argent à partir de chlorure de radium et de nitrate d’argent.
Elle a reproduit ses expériences en 1902 puis en 1907 afin d’améliorer la concordance de ses résultats.
Cet article très détaillé avec des expériences simples et facilement compréhensibles nous enseigne que les avancées scientifiques dépendent d’une volonté et d’une obstination rigoureuse.
Source : Radium (Paris), 1907, 4 (10), pp.349-352.
 |
Colloque Chimie et Biologie de synthèse : les Applications - 14 février 2018
|
Colloque Chimie et Biologie de synthèse : les Applications - 14 février 2018
Rubrique(s) : Événements

Le colloque Chimie et Biologie de synthèse : les Applications a eu lieu le mercredi 14 février 2018 à la Maison de la Chimie, à Paris.
Nous appelons tous de nos vœux une chimie et des méthodes de production industrielle respectueuses de l'environnement et une médecine personnalisée. Parmi les approches susceptibles de répondre pour partie de ces vœux, la biologie de synthèse occupe une place de choix. Elle offre dans plusieurs secteurs des solutions innovantes. Citons des médicaments, vaccins et diagnostics aux performances améliorées ; des techniques novatrices en médecine régénérative ; de nouveaux outils pour réhabiliter les sols pollués ou traiter l'eau ; des matières plastiques ou textiles avec une empreinte carbone réduite. Alors qu'appelle-t-on "biologie de synthèse" ?
L'ambition de ce domaine est de concevoir rationnellement et de construire de manière standardisée de nouveaux systèmes de production inspirés par la biologie, ou fondés sur ses composants. Construire un système biologique qui fonctionne comme prévu est une manière de s'assurer que l'on a compris les phénomènes sous-jacents, et en ce sens la biologie de synthèse permet de faire progresser les connaissances scientifiques sur le monde vivant. Cependant l'aspect ingénierie y est dominant, et il s'ensuit que les applications industrielles ne sont jamais loin. De nombreuses applications consistent à faire produire à des microorganismes des composés précieux ; ces bio-productions s’appuient sur l’usage de ressources renouvelables. D’autres applications ne font pas appel à des organismes vivants ; c’est le cas par exemple de la nanomédecine. Le potentiel économique de ces applications est considérable, puisqu'elles touchent aussi bien à la santé, l'environnement, l'énergie et les matériaux. Un aussi large spectre d'applications nous indique que la biologie de synthèse ne consiste pas en une collection limitée de solutions industrielles, mais plutôt en un ample socle méthodologique et scientifique.
Ce nouveau domaine à l’interface de de la biologie, de la biochimie, de l’informatique et de l’ingénierie suscite fascination, mais aussi inquiétude.
C’est déjà une réalité, puisque plus d’une centaine de produits industriels bénéficiant de cette technologie sont commercialisés ou proches de l’être comme nous le verrons à l’occasion de ce colloque. Elle permet déjà la fabrication de médicaments et d’outils de diagnostic utiles à des milliers de patients.
L’émergence de la biologie de synthèse est assez semblable à celle de la chimie de synthèse il y a 150 ans. Ses succès se multiplient dans de nombreux domaines, notamment dans la pharmacologie, où de très nombreux projets sont en cours de développement pour répondre aux besoins de nouveaux médicaments plus efficaces et moins chers.
Dans quelques années, cette discipline sera certainement utilisée très largement dans le monde entier. La France est actuellement bien placée à cet égard et il nous est apparu important de faire le point, avec quelques-uns des meilleurs experts dans les différents domaines de recherche et d’application concernés.
Ce colloque est ouvert à un large public avec une attention particulière aux lycéens, aux étudiants et à leurs enseignants. Le niveau des interventions se veut accessible à tous pour permettre un large débat.
Soyez les bienvenus.
Bernard Bigot
Président de la Fondation de la Maison de la Chimie
Directeur Général de ITER Organization
Réservez votre journée du mercredi 14 février 2018 pour participer au colloque (accessible au grand public).
L'inscription se fait en ligne. Elle est gratuite mais obligatoire.
Colloque Chimie, Aéronautique et Espace : les vidéos sont disponibles
Rubrique(s) : Événements

Le colloque Chimie, Aéronautique et Espace a eu lieu mercredi 8 novembre 2017. Il a rassemblé 1250 participants dont plus d'un tiers de lycéens et leurs enseignants.
La captation vidéo de l'intégralité des conférences et des débats est maintenant disponible ici.
 |
Quid du glyphosate ?
|
Quid du glyphosate ?
Rubrique(s) : Éditorial

L’imbroglio politique à Bruxelles et à Paris sur le renouvellement d’autorisation de cet herbicide nourrit les polémiques qui s’étalent dans les journaux. Mais connaît-on bien en tant que chimiste cette molécule ?
Le glyphosate est un composé de formule brute C3H8NO5P appelé N-(phosphonométhyl)glycine. C’est un acide organique analogue à un acide aminé naturel auquel on a ajouté un groupement phosphonate (C–PO–(OH)2). Sa synthèse industrielle n’est pas trop complexe et il a été fabriqué initialement par Monsanto qui en a possédé le brevet jusqu’en 1974. Plusieurs firmes depuis le fabriquent. Il est commercialisé sous le nom de « Roundup », l’herbicide systémique le plus utilisé dans le monde. Il comporte des adjuvants pour accroître sa solubilité et la pénétration dans la plante, notamment un surfactif (tensioactif) : le polyoxyéthylène amine (POEA) ou Tallowamine.
Les agriculteurs souhaitent la poursuite de son autorisation car ils utilisent ce produit pour éviter la pratique des labours profonds qui changent la structure des sols (1) au détriment de la biodiversité. Les ONG et les écologistes souhaitent au contraire son interdiction en tant que produit chimique et susceptible d’être cancérigène (2).
En fait dès 1997, une étude coordonnée par l’Agence américaine de la protection de l’environnement avait montré que ce n’était pas le glyphosate mais plutôt le POEA et ses produits de dégradation qui étaient toxiques pour les poissons et batraciens en milieu humide (3). Les études réglementaires nécessaires pour la mise sur le marché pour le glyphosate jusque l’an 2000 ne montraient aucun danger tératogène ou toxique pour l’homme.
C’est un rapport en 2015 du CIRC (Centre international de recherche sur le cancer), agence de l’OMS, qui a classé le glyphosate comme cancérogène probable pour l’homme à forte dose. On se rappellera que c’est ce même organisme qui a classé le café dans la même catégorie probable et la charcuterie comme cancérigène certain. En 2016, l’EFSA pour l’Europe concluait qu’il était improbable que cette substance soit cancérigène ; l’ANSES (4) pour la France, plus prudente, considérait que le niveau de preuves était insuffisant pour le classer comme cancérigène mais recommandait de ne plus l’additionner du POEA.
Passons sur les polémiques qui d’un côté accusent les organismes officiels d’avoir repris une étude faite par Monsanto et de l’autre côté accusent un rapporteur indélicat d’avoir changé les conclusions du CIRC de peu probable en probable ! Elles n’apportent rien à la clarté scientifique.
Le monde agricole pose alors la question des produits phytosanitaires alternatifs ? (5) Sont proposés les acides gras qui n’ont une efficacité que sur 14 jours, l’acide pélargonique (géranium) ou l’acide caprique proposé par Bayer qui ne fonctionnent que sur de petites surfaces et de coût assez élevé. Un autre herbicide de Monsanto, le Dicamba ou acide 2-méthoxy-3,6-dichlorobenzoïque renoue avec les organochlorés encore bien pires et qui fait déjà l’objet aux États-Unis de nombreuses plaintes d’agriculteurs. Restent l’huile de coude pour le sarclage et l’arrachage à la main, difficilement compatibles avec la désertification rurale.
C’est le vrai problème de l’agriculture moderne, appelée à nourrir des milliards d’êtres humains et confrontée à l’usage de produits respectueux de l’environnement et de la santé alimentaire (6) et bien sûr de ses rapports avec la chimie. Si depuis 40 ans le nombre de molécules pesticides, herbicides et insecticides a été réduit des 2/3 et si les micropolluants des eaux se sont réduit de 60% (7) avec une belle amélioration de la chaine alimentaire, c’est que les organismes de réglementation et la recherche de solutions (8) ont travaillé ensemble mais l’on peut encore faire des progrès.
Jean-Claude Bernier
Novembre 2017
Quelques ressources pour en savoir plus :
1) Biogéochimie et écologie des sols (330)
2) Chimie et santé : risques et bienfaits (307)
3) Biochimie naturelle et traitement de l’eau : de la chimie des écosystèmes et des cocktails… (284)
4) Le défi posé aux chimistes pour la protection de la santé et de l’environnement. Le point de vue de l’ANSES (1099)
5) La chimie en agriculture : les tensions et les défis pour l’agronomie (313)
6) Réglementation de l’évaluation des risques alimentaires : la place de la chimie (285)
7) Les micropolluants dans les écosystèmes aquatiques : enjeux de la directive eau (1101)
8) La nature pour inspirer le chimiste : substances naturelles, phytochimie et chimie médicinale (292)
Les fleurs et plantes odorantes de la région ont fait de Grasse la capitale des « parfums ». Cette vidéo nous immerge dans le laboratoire grassois des parfums de l’Université de Sofia-Antipolis et fait découvrir avec beaucoup de clarté et de pédagogie tout ce que la chimie d’aujourd’hui - synthèse, analyse, modélisation… - apporte non seulement à l’industrie traditionnelle des parfums mais aussi à toutes les nombreuses autres applications qui se développent dans notre vie quotidienne.
Cette vidéo montre notamment combien il est scientifiquement faux d’opposer substance naturelle et synthèse chimique et que au contraire les deux sont liées et complémentaires car la synthèse chimique permet de protéger la biodiversité végétale et animale, de proposer des substituts à des composés naturels dangereux ou encore des odeurs qui n’ont pas d’équivalent dans la nature.
On y découvrira un domaine dynamique porteur d’emploi.
Source : Clins d'oeil de la Fondation Internationale de la Maison de la Chimie
Un passionnant reportage sur l’étude scientifique de l’apprentissage mémoire chez les abeilles où l’on découvre que le petit cerveau des abeilles avec ses 950000 neurones est néanmoins très performant, et que la cascade de molécules qui interviennent dans la formation de la mémoire des abeilles sont les mêmes que celles qui interviennent chez l’homme. On y découvre les dispositifs ingénieux d’études de l’animal actif et l’osmose entre l’étude en laboratoire et l’étude de l’animal dans son milieu naturel.
La connaissance des hormones impliquées (dont celles de stress) des phéromones permet non seulement de comprendre leurs rôle dans l’organisation efficace de la société des abeilles, mais aussi de soigner les abeilles contre les impacts environnementaux produits par l’homme.
Source : Clins d'oeil de la Fondation Internationale de la Maison de la Chimie
Application à la teinture du bleu indigo. Mise au point des étapes du procédé de teinture d'un morceau de tissu en jeans. Un film de la série Lumia et les catalyseurs