 |
Diffusion en direct du colloque Chimie et Lumière
|
Diffusion en direct du colloque Chimie et Lumière
Rubrique(s) : Événements

Vous qui n’aurez pas la possibilité de venir à la Fondation de la Maison de la Chimie le 26 février 2020, vous pourrez assister en direct au « Colloque Chimie et Lumière »
sur Mediachimie ou sur Youtube.
La captation des conférences sera par la suite disponible en ligne et leur mise à disposition sera indiquée sur la page d'accueil de Mediachimie.
 |
Pourquoi met-on de l'alcool dans l'essence ?
|
Pourquoi met-on de l'alcool dans l'essence ?
Rubrique(s) : Question du mois

En 2003 la directive européenne RED (Renewable Energy Directive) a demandé aux pays européens des réductions d’émission de gaz à effet de serre (GES), notamment pour le transport, en faisant appel aux biocarburants capables de diminuer de 35% en 2017 puis de 50% en 2018 les émissions. Les pétroliers ont alors ajouté de l’alcool dans l’essence et des esters d’huiles végétales dans le gasoil, d’origine biosourcée.
Comment fabrique-t-on le bioéthanol (selon les procédés dits de 1re génération) ?
L’éthanol ou alcool éthylique, de formule chimique C2H5OH, est principalement synthétisé lors de la fermentation du sucre, soit de canne à sucre, soit de betterave suivant la réaction :
ou à partir d’amidon de blé ou de maïs, préalablement hydrolysé en sucre, selon :
(C6H10O5)n + n H2O = n C6H12O6 suivi de la fermentation (1).
Lors de ces réactions, l’alcool obtenu est mélangé à de l’eau que l’on doit absolument éliminer.
Pour cela l’opération industrielle se poursuit par une distillation pour obtenir un mélange eau-alcool à 90% (2) en éthanol. Puis les 10% d’eau restants sont éliminés sur tamis moléculaires pour que l’alcool purifié à 99,8% puisse être mélangé à l’essence. Les pétroliers en transforment une partie en ETBE (éthyl ter-butyl éther) (3) par réaction avec l’isobutène (4) afin d’avoir un carburant moins volatil.
Le rendement énergétique de l’éthanol est inférieur à celui de l’essence. En effet le rendement avec un litre et demi d’éthanol équivaut environ à celui d’un litre d’essence. Il faut donc s’attendre pour une automobile à une consommation supérieure au 100 km.
Les différents carburants à la « pompe à essence » : pour quels moteurs ?
En France les différents carburants à essence contiennent des quantités variables d’alcool.
Nom du carburant | SP 95 | SP 98 | SP95 E10 | super éthanol E 85 |
| Logo à la pompe depuis octobre 2018 | E5 | E5 | E10 | E85 |
Pourcentage maximum d’éthanol pur | 5 % | 5% | 10 % | 65 à 85 % selon la saison |
Tous les moteurs modernes sont conçus pour fonctionner avec les 3 premiers carburants.
Par contre pour le E85 il faut une automobile dite « flexfuel » équipée d’un système d’injection et de réglages du moteur lui permettant d’utiliser tous les carburants modulables. Seuls quelques constructeurs commercialisent ces véhicules qui ne représentent à l’achat que 0,3% du neuf. Heureusement depuis 2018 des boitiers électroniques agréés s’adaptent sur les autres automobiles leur permettant de rouler à l’E85 et environ 6000 automobilistes par an y recourent. C’est qu’ils recherchent des économies et une rentabilité car l’E85 est bien moins taxé que l’essence normale (0,12 € au lieu de 0,68 €) ce qui donne un prix moyen de 0,70€/L à la pompe pour l’E85.
Pour une voiture consommant 6 L/100 km de SP 95 à 1,50€/L et équipée pour rouler avec 7L/100 km d’E85 à 0,70 €/L, l’économie est de l’ordre de 4 €. Il faut alors de 20 000 à 25 000 km pour rentabiliser la pose du boitier FlexFuel d’environ 1000€.
[Ajout octobre 2020 : Les données actualisées mensuellement sont disponibles sur le site du Syndicat National des Producteurs d'Alcool Agricole, notamment sur la répartition de l’utilisation des carburants et les coûts et gains d’utilisations du SP95-E10 et du Superéthnol-E85. En 2020, l’estimation d’installations de boitiers est de 3000 par mois.]
Concurrence entre cultures à des fins énergétiques et cultures alimentaires
Alors « sauverons-nous la planète » (5) en roulant au bioéthanol ? La polémique a grossi dès 2010 après des rapports américains qui dénonçaient l’utilisation de cultures vivrières à des fins énergétiques et s’est enflée en 2016 après une étude très documentée de l’ADEME, de l’INRA et d’une ONG « Transport et environnement » pour la Commission de Bruxelles. Non seulement les gains en émission de GES étaient très inférieurs à 30% pour l’éthanol issu des céréales – avec de grandes disparités selon les céréales - mais le chiffrage du CAS (Changement d’affectation des sols) plombait encore ce bilan (6). C’est pourquoi la commission n’a pas voulu augmenter le pourcentage de biocarburants de 1re génération après 2018 comme prévu dans la directive RED.
[Ajout octobre 2020 : Une étude commandée par la Commission européenne a débouché sur la publication en mars 2019 d’un règlement délégué de la Commisssion. Les impacts sur le Changement Indirect d’Affectation des Sols sont détaillés en annexe pour les différentes cultures céréalières, sucrières et oléagineuses. Ces cultures sont classées en dessous du seuil limite de 10% définissant les biocarburants à risque ILUC élevé (risque de changement indirect d’affectation des terres), à l’exception de l’huile de palme dont la valeur est à 45%.]
Quelle est la situation en France ?
Le SP95 E10 est devenu le carburant le plus vendu avec plus de 40% des ventes à la pompe en 2019. L’éthanol représente environ 10% des carburants vendus en France.
Le dernier rapport du ministère de l’Écologie solidaire et celui de la commission parlementaire du 22 janvier précise qu’en 2017 543 millions de litres d’éthanol ont été produits, issus de matières premières française (55% maïs et blé, 33% betterave, 12% divers). De même 753 ML d’ETBE ont été produits à partir de 55% de matières françaises (80% blé et maïs, 18% betterave).
[Ajout octobre 2020 : La production française de bioéthanol utilise moins de 1% de la surface agricole utile nationale.]
Ces deux rapports recommandent d’accélérer la recherche pour l’obtention d’éthanol dit « cellulosique » produit à partir de la biomasse « lignocellulosique » issue de déchets végétaux (bois, paille, bagasses de végétaux), selon des procédés biochimiques.
Pour l’instant des cocktails d’enzymes capables de transformer la cellulose en sucres ont été trouvés et on sait à la fois séparer la lignine et mener la fermentation en bioréacteurs mais le coût de l’alcool produit n’est pas encore compétitif. En France le projet Futurol mené par 11 participants, dont l’IFPEN (8), est arrivé à son terme en 2018 après dix ans de recherche. La bioraffinerie pilote de ce projet à Pomacle-Bazancourt dans la Marne a été cédée à la société ARD (Agro Industrie Recherches et Développements) chargée de son maintien et de la commercialisation de cet éthanol cellulosique français pour le biocarburant 2G (9).
Un peu d’histoire (un retour aux sources ?)
L’inventeur du moteur à explosion, Nicolas Otton, avait conçu ce moteur avec l’alcool comme carburant et le record de vitesse automobile avait été obtenu en 1903 à 177 km/h sur une Gobron-Brillé roulant à l’éthanol. C’est seulement quand les hydrocarbures sont devenus moins chers que l’essence a remplacé l’alcool.
La production de futurs biocarburants respectant les enjeux environnementaux et économiques est un défi exaltant auquel doivent répondre les chimistes et bio-technologistes. Pour nous, automobilistes dans une société économe des ressources, quel que soit le carburant adoptons une conduite cool et écolo !
L’équipe question du mois
(1) Un schéma présentant les étapes de la production de bioéthanol est disponible sur le site SNPAA des Industriels de l'Alcool et du Bioéthanol
(2) Il s’agit de la fraction molaire en éthanol du mélange eau/éthanol
(3) Le nom ETBE est le nom industriel. Son nom selon la nomenclature est le 2-éthoxy,2-méthylpropane.
(4) La réaction mise en jeu entre l’isobutène et l’éthanol pour donner l’ETBE est
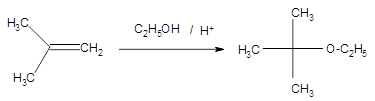
(5) Un exemple d’énergie renouvelable : l’essence verte
(6) Les enjeux de la R&D en chimie pour le domaine des carburants et biocarburants
(7) Polémiques dans le monde des biocarburants
(8) IFPEN : Institut Français du Pétrole et des Énergies Nouvelles
 |
La Chimie et ses emplois sont au bois de Vincennes
|
La Chimie et ses emplois sont au bois de Vincennes
Rubrique(s) : Éditorial

Les 28 et 29 février 2020 se tient, au parc floral de Paris au bois de Vincennes, le
Village de la chimie des sciences de la nature et de la vie
Les collégiens, lycéens et étudiants avec leurs professeurs ou leurs parents sont comme chaque année les bienvenus, et nombreux sont ceux qui grâce aux différents espaces et stands vont pouvoir trouver une orientation scolaire, un parcours professionnel, un stage en entreprise, un futur job.
Comment rendre efficace votre venue ?
- 1 – En rencontrant les professionnels à votre disposition : ingénieurs, recruteurs, techniciens de grandes entreprises internationales, de PME, de start–up, d’organismes de recherche ; ils vous parleront métiers et carrières.
- 2 – En vous renseignant auprès des établissements de formation et des filières : Bac Pro, BTS, DUT, Universités, Écoles d’ingénieurs, qui vous accueilleront au cours de ces deux journées.
- 3 – En préparant votre future insertion professionnelle grâce aux ateliers pour peaufiner votre CV, utiliser mieux internet, bâtir ou améliorer votre entretien d’embauche,
Vous aurez aussi la possibilité d’écouter et de vous instruire, au cours des conférences d’experts ou de chercheurs en chimie, sur le traitement des surfaces, l’innovation dans les verres, une méthode révolutionnaire de dépollution des sols.
Ne loupez pas les démonstrations spectaculaires de réactions chimiques et une découverte amusante des éléments de la classification périodique.
Enfin Jean Marie Lehn prix Nobel de chimie sera présent à l’occasion de la remise des prix des Olympiades de la chimie en Île-de-France et parlera de « la chimie de la vie ».
Venez en famille ou avec vos professeurs à Vincennes. L’industrie chimique emploie 165 000 salariés, et il y a de très nombreux chimistes dans d’autres industries comme la pharmacie, la métallurgie, l’automobile, l’aéronautique, la plasturgie, les cosmétiques et parfums. Cela représente chaque année des dizaines de milliers d’embauches. De plus, avec le développement de l’alternance et de l’apprentissage, de nombreuses possibilités sont offertes : venez à la table ronde spécialement consacrée à ces voies le samedi 29.
Préparez votre venue avec votre classe ou vos parents en consultant sur Mediachimie.org l’espace métiers, les fiches métiers par fonction et domaine d’activité et la série de fiches « Les chimistes dans… ». Vous y découvrirez des dizaines de métiers de l’agent de laboratoire à l’ingénieur procédé, du biochimiste au commercial, du responsable du laboratoire d’analyse au chercheur, tout un panel de métiers est décrit.
Mediachimie sera aussi présent au village (stand M6) et une équipe de Mediachimie assurera deux conférences / ateliers : « La chimie, une grande diversité de métiers riches d’avenir » les vendredi et samedi à 14h.
Jean-Claude Bernier et Catherine Vialle
Février 2020
Plus d'informations : Village de la chimie des sciences de la nature et de la vie
#villagechimie
#gracealachimie
Préparez votre venue au Village de la chimie en testant vos connaissances sur les métiers (quiz)
Socle :
- Domaine 4 : les systèmes naturels et les systèmes techniques
Programme Cycle 4 :
- L’énergie et ses conversions (Identifier les sources, transferts et conversion d’énergie ; notion de puissance)
Source : D’après l’article La chimie face aux défis de la transformation du système énergétique de Sébastien Candel publié dans l’ouvrage « Chimie et changement climatique », EDP Sciences, 2016, 978-2-7598-2035-1
Socle :
- Domaine 3 : la formation de la personne et du citoyen ;
- Domaine 4 : les systèmes naturels et les systèmes techniques ;
- Domaine 5 : les représentations du monde et l'activité.
Programme Cycle 4 :
- Décrire la constitution de la matière
Source : D’après l’article La chimie pour la séparation et la gestion des déchets nucléaires de Bernard Bouillis publié dans l’ouvrage « Chimie et enjeux énergétiques », EDP Sciences, 2013, ISBN : 978-2-7598-0973-8
Socle :
- Domaine 4 : les systèmes naturels et les systèmes techniques
Programme Cycle 4 :
- Utilisations des ressources de la nature
- Modes de vie
Source : D’après l’article Gaz de schistes : quels problèmes pour l’environnement et le développement durable ? de Jacques Varet publié dans l’ouvrage « Chimie et expertise, santé et environnement »; EDP Sciences, 2016, ISBN : 978-2-7598-1848-8
Socle :
Domaine 4 : les systèmes naturels et les systèmes techniques
Programme Cycle 4 :
Synthèse d’espèces chimiques, transformation chimique
Source : D’après l’article CO2 et microalgues, pour une chimie renouvelable de Claude Gudin publié dans l’ouvrage « Chimie et enjeux énergétiques », EDP Sciences, 2013, ISBN : 978-2-7598-0973-8
Socle :
- Domaine 4 : les systèmes naturels et les systèmes techniques
- Domaine 5 : les représentations du monde et l'activité humaine
Programme Cycle 4 :
- L'énergie et ses conversions
Source : D’après l’article La complexité du réseau et l’électricité verte d’Yves Bréchet publié dans l’ouvrage « Chimie et changement climatique », EDP Sciences, 2016, ISBN : 978-2-7598-2035-1
Socle :
- Domaine 4 : les systèmes naturels et les systèmes techniques (Expliquer l’impact de différentes activités humaines sur l’environnement)
- Domaine 5 : les représentations du monde et de l’activité humaine (Analyser quelques enjeux du développement durable dans le contexte des sociétés étudiées)
Programme Cycle 4 :
- Utiliser une équation de réaction chimique fournie pour décrire une transformation chimique observée
- Identifier les sources, les transferts et les conversions d’énergie
- Identifier les différentes formes d’énergie
- Établir un bilan énergétique pour un système simple (sources, transferts, conversion d’un type d’énergie en un autre)
Source : D’après l’article La chimie donne des ailes de Jean Botti publié dans l’ouvrage « Chimie et transport », EDP Sciences, 2014, ISBN : 978-2-7598-1075-8
Socle :
- Les systèmes naturels et les systèmes techniques
Programme Cycle 4 :
- Synthèse d’espèces chimiques
- Développement durable
Source : D’après l’article La chimie au service de l’efficacité énergétique : Comment concevoir un habitat performant ? de Johann Souvestre, publié dans l’ouvrage « Chimie et Habitat », EDP Sciences, 2011, ISBN : 978-2-7598-0642-3
