Zoom sur l’insuline et ses modes de production
Voilà 100 ans, le 11 janvier 1922, que pour la première fois un enfant de 14 ans en coma diabétique reçut une injection d’un extrait de pancréas (et donc d’insuline) ; il fut sauvé et survécu 13 ans avec des injections régulières d’insuline.
Quel est le rôle de l’insuline ?
L’insuline est une hormone (i), secrétée par le pancréas, dès que la glycémie (taux de glucose dans le sang) dépasse un seuil. Cette sécrétion favorise un retour de la glycémie à une valeur de base. Son absence ou sa sécrétion insuffisante est responsable des divers types de diabète.
Quelle est la structure de l’insuline ?
L’insuline est une protéine. Sa structure a été décrite en 1955 par Frederick Sanger (ii) et représentée en 3 D par Dorothy Hodgkin (iii) en 1969.
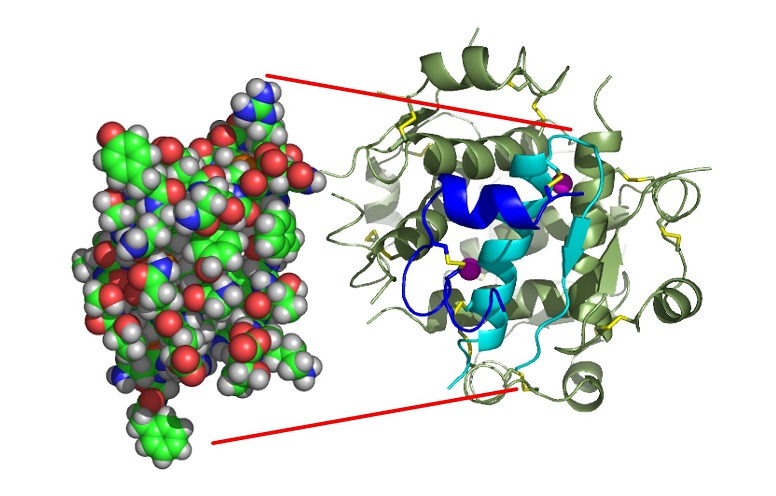
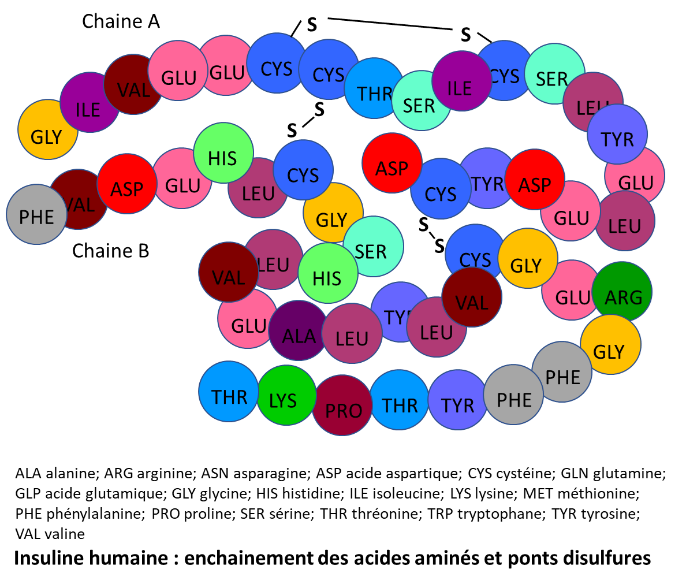
De formule brute C257H383N65O77S6, sa masse molaire vaut 5807 g.mol-1. La structure de l’insuline est complexe. Un premier brin appelé chaine A contient 21 acides aminés (acides aminés notés aa par la suite). Un deuxième brin appelé chaine B contient 30 aa. Ces 2 chaines sont reliées entre elles par 2 ponts disulfures (S-S) entre 2 cystéines de A et 2 cystéines de B. Il existe aussi un pont S-S interne entre deux cystéines de la chaine A. L’ensemble des 2 chaines forme un monomère. Voir image ci-dessous.
Trois dimères se forment grâce à des liaisons hydrogènes entre des aa des chaines terminales de B et sont assemblés entre eux via des interactions avec deux ions Zn(II). L’insuline a donc une structure hexamère.
Insuline humaine et animale
La structure de l’insuline est particulière à l’espèce, mais celles de l’homme, du porc et du bœuf sont très voisines.
L’insuline humaine est différente de l’insuline porcine juste par un aa de la chaine B en position 30. Celle du bœuf diffère en plus par 2 aa de la chaine A en positions 8 et 10.
Les premières insulines administrées aux diabétiques insulino-dépendants
Elles sont extraites de pancréas de bœuf ou de porc, mise en solution acide (pH = 3) et malheureusement imparfaitement purifiées. Le patient doit avoir 3 ou 4 injections par jour. Les impuretés et la différence structurelle de ces insulines sont responsables de réactions locales ou d’allergies. Ainsi, de 1922 jusqu’en 1999 (en France) les diabétiques ont pu recevoir des insulines extraites du porc et du bœuf. Depuis les années 80, les insulines reçues par les diabétiques ont beaucoup évolué.
L’insuline porcine modifiée appelée insuline semi-synthétique humaine
Au début des années 80, l’insuline porcine a subi des transformations enzymatiques permettant de remplacer l’aa alanine en position 30 de la chaine B par l’aa thréonine ; ainsi on obtient une insuline semi-synthétique humaine. Bien qu’apportant au malade une plus grande efficacité, ce procédé nécessitait encore un approvisionnement en insuline porcine et provoquait dans certains cas des réactions de rejet.
Des insulines différenciées pour améliorer rapidité et durée d’action
La notion d’insuline différenciée est liée à la vitesse et la durée d’action. On parle d’insulines, rapides, intermédiaires ou lentes.
Ainsi des insulines rapides sous forme d’hexamères sont injectées pour éviter une augmentation de la glycémie trop importante au moment des repas, tandis que des insulines intermédiaires permettant de combler les besoins humains en insuline indépendamment des repas, sont injectées 2 à 3 fois par jour.
Ces insulines intermédiaires, nommées NPH (Neutral Protamine Hagerdorn), proposées dès 1923 par Hagerdorn, contiennent en plus de l’insuline humaine, des protamines (iv), une quantité variable d’ions Zn2+ et un milieu neutre grâce à un tampon phosphate. Cette formulation injectée diffuse alors lentement dans le corps humain.
L’inconvénient de ces premières insulines différenciées était leur délai d’action et la durée.
L’insuline humaine obtenue par le génie génétique appelée insuline biogénétique humaine ou recombinante
Dès le début des années 80 des insulines humaines obtenues par génie génétique sont apparues sur le marché et depuis 1999 (en France) seules ces insulines sont utilisées.
Très schématiquement, un gène (portion d’ADN) codant pour l’insuline humaine est inséré dans l’ADN d’une cellule hôte, la bactérie Escherichia coli. Celle-ci produit alors de l'insuline humaine grâce au gène supplémentaire intégré. Pour la production de grandes quantités, cette bactérie modifiée est introduite dans un fermenteur où elle se multiplie et produit le composé recherché. Des étapes de séparation et purification sont indispensables.
Pour concrétiser on peut citer pour exemples, deux modes de fabrication industrielle d’insuline recombinante. Ce ne sont pas les seuls.
Dans le premier, il est d’abord créé indépendamment, par génie génétique, les 2 chaines A et B rallongées volontairement par quelques aa dont la présence facilite l’étape chimique ultérieure. À l’issue de ces fermentations ces chaines sont séparées par ultrafiltration ou centrifugation. La création des ponts sulfure (S-S) entre les 2 chaines est alors réalisée par voie chimique. Une chromatographie préparative à basse pression par échanges d’ions est alors réalisée. Une nouvelle étape de réaction chimique ou enzymatique permettant la découpe des aa excédentaires est suivie d’une ultrafiltration puis d’une chromatographie préparative à haute pression (70 bars) sur gel de silice greffé ou non, pour conduire à l’insuline humaine recombinante purifiée à usage pharmaceutique.
Dans le deuxième mode, la bactérie est programmée pour reproduire au cours de la fermentation les chaines AB accrochées entre elles en une seule chaine. Après une séparation / filtration, une découpe par voie chimique ou enzymatique et la création des ponts sulfure sont réalisées suivies d’une chromatographie par échange d’ions. Une purification finale par chromatographie HP est également nécessaire.
Le génie génétique permet aussi de produire des insulines aux actions différenciées.
Les insulines analogues rapides ou lentes
La fin des années 90 a vu arriver les insulines dites analogues rapides et lentes. Elles sont aussi issues du génie génétique. Elles ont pour objectif de modifier la cinétique ou la solubilité de l’insuline.
Ce sont des insulines très légèrement différentes de l’insuline humaine par changement de quelques aa (addition ou soustraction ou échange) et de quelques adjonctions.
On distingue les insulines analogues rapides, à début d’action plus rapide et durée d’action plus courte que l’insuline humaine (lispro (v), en 1996, asparte (vi) en 2000 ou glulisine (vii) en 2004) qui par juste quelques changements (un aa par un autre) permettent de garder la même action au niveau de la glycémie. La rapidité d’action est due au fait que ce n’est plus l’hexamère qui est formé mais le monomère.
Inversement les insulines analogues lentes ou à action prolongée (glargine (viii) en 2000 et détémir (ix) en 2004) par des modifications d’aa permettent un changement du point isoélectrique. Solubles en milieu acide ces insulines précipitent au pH physiologique et les hexamères formés ont ainsi une durée d’action beaucoup plus longue.
On peut citer quelques fabricants d’insuline dans le monde : Novo Nordisk (danois) leader mondial, Eli Lilly (américain), Sanofi-Aventis (français), Biocon en Inde, Wanbang Biopharma en Chine, Julphar au Moyen Orient…
Proche de nous, on trouve des sites de production d’insuline à Chartres (Novo Nordisk), à Fegersheim (Lilly) et Francfort (Sanofi).
D’après le rapport 2019 de la FID (Fédération Internationale du Diabète), « 578 millions d'adultes seront atteints de diabète d'ici 2030 et 700 millions d'ici 2045 ». On mesure l’importance du savoir-faire indispensable pour la production d’insuline.
Aujourd’hui les axes de recherche dans l’amélioration du traitement sont tournés non plus vers une production d’insuline toujours plus active, mais plutôt dans des injections plus efficaces : pompes en boucle fermée avec mesure en continu de la glycémie et injection en continu d’insuline via l’intervention de l’Intelligence Artificielle (c’est ce qu’on nomme le pancréas artificiel). D’autres nouvelles thérapies sont en cours d’étude : ainsi des cellules souches (implantées directement sous la peau) se transforment en cellules béta des îlots de Langerhans (les cellules pancréatiques productrices d’insuline) et produisent de l’insuline directement utilisable par le corps humain.

Monomère insuline humaine
(i) En 1922 deux biologistes canadiens Frederick Banting et Charles Best découvrent l’insuline par extraction du pancréas.
(ii) Frederick Sanger a eu le prix Nobel de Chimie en 1958 pour son travail sur la structure des protéines, particulièrement celle de l’insuline.
(iii) Dorothy Hodgkin a eu le prix Nobel de Chimie en 1964 pour « sa détermination par des techniques aux rayons X des structures de substances biochimiques importantes », ce qui lui permit de déterminer la structure tridimensionnelle de l’insuline en 1969.
(iv) Les protamines sont des petites protéines nucléaires (trouvées au centre de noyaux cellulaires) riches en aa arginine.
(v) Insuline lispro : la molécule comporte une inversion de deux aa en bout de chaîne B, qui ne modifie pas la liaison au récepteur, mais bloque la formation de dimères et d'hexamères d'insuline.
(vi) Insuline asparte : c'est une insuline analogue où un seul acide aminé a été modifié, en particulier une proline avec un acide aspartique à la position B28.
(vii) Insuline glulisine : insuline analogue où l’aa asparagine en position B3 est remplacé par la lysine et la lysine en position B29 est remplacée par l'acide glutamique.
(viii) Insuline glargine : remplacement de l'asparagine par la glycine en position 21 de la chaîne A et par l'extension carboxy-terminale de la chaîne B par 2 résidus arginine.
(ix) Insuline détémir : délétion de la thréonine en position B30 et fixation sur la lysine en position B29 de l’acide tétradécanoïque (ou myristique) de formule CH3–(CH2)12–COOH, ce qui lui permet de se complexer à l'albumine dans le sang. Puis lentement le complexe se dissocie et libère l’insuline.
Pour en savoir plus
(1) Histoire de l’insuline : entre le biologique et l’artificiel, G. El Mghari, S.Baki et N. El Ansari, Service d’endocrinologie, Laboratoire PCIM, Université Cadi Ayyad, Marrakech, Hegel vol. 4 n°2 (2014) p. 208 (DOI : 10.4267/2042/53793)
(2) L’insuline produit du jour Société chimique de France
(3) Les 90 ans de la découverte de l'insuline, par la Fédération Française des Diabétiques
(4) Les insulines, médicaments actuels et évolution dans la prise en charge du diabète insulinodépendant, Thèse Alexandre Bitil (2015), tout particulièrement les modes d’obtention pages 21 à 26 (HAL Id : dumas-01171688)
(5) Le génie génétique à la rescousse des diabétiques Musée Armand Frappier Canada
(6) État des lieux passé et actuel de l’insuline (thérapies, procédés) et perspectives d’évolution, Thèse d'exercice en pharmacie (Toulouse) de Delpech Romain (2015)
Crédits :
Illlustration : Monomère insuline humaine par Isaac Yonemoto. Transféré de en.wikipedia.org vers Commons. Premier téléchargement vers en.wp par Takometer, CC BY 2.5, Lien
Figure : Insuline humaine : enchainement des acides aminés et ponts disulfure réalisée par Lydie Amann. DR.
