Le cycle des Colloques “Chimie &…” s'enrichit d'un nouvel opus :
Chimie et Intelligence Artificielle
Mercredi 8 février 2023
Maison de la Chimie, 28 bis rue Saint-Dominique, 75007 Paris
Bien que des mouvements sociaux sont annoncés par la RATP et la SNCF pour les 7 et 8 février prochain, le colloque Chimie et Intelligence Artificielle est maintenu.
De nos jours, les nouvelles technologies permettent de générer des données et de les stocker dans des supercalculateurs. À l’aide d’algorithmes, on peut les trier et les interpréter plus vite qu’il n’est humainement possible pour prendre des décisions complexes. Le but de l’intelligence artificielle (IA) est de permettre à des ordinateurs de penser et d’agir comme le feraient des humains. De nouvelles puissances et infrastructures de calcul permettent de disposer des masses de données sans précédent, le « Machine Learning » et le « Deep Learning » les interprètent pour des tâches aussi complexes qu’innovantes.
L’intelligence artificielle est un sujet d’actualité dont la mise en application touche tous les domaines de l’industrie, de la recherche et de notre vie quotidienne. Bien que déjà présente dans la R&D, l’IA est encore pratiquement ignorée de la majorité des chimistes, n’apparaissant dans l’enseignement au niveau supérieur que depuis peu alors que tout le monde est convaincu de la place qu’elle est en train de se créer. Nous souhaitons donc présenter dans ce colloque un nouveau domaine en développement non seulement dans la recherche universitaire et industrielle, mais aussi dans l’enseignement indispensable pour préparer l’avenir.
Pour cela nous avons fait appel d’une part, aux experts universitaires et industriels des principaux domaines d’utilisation dans lesquels chimie et IA sont associés, d’autre part, aux enseignants chercheurs des établissements d’enseignement supérieur qui ont mis en place des formations initiales et continues dans cette nouvelle spécialité.
Ce Colloque est ouvert sur inscription à un large public avec une attention particulière aux jeunes et à leurs enseignants. Pour que ce colloque puisse être accessible au plus grand nombre, il sera diffusé sur la chaine You Tube de Mediachimie.
Le niveau se veut accessible à tous pour permettre un large débat.
Danièle Olivier et Jean-Claude Bernier
Co-Présidents du Comité d’Organisation
Voir le direct sur Mediachimie ou sur Youtube.
Inscription gratuite et obligatoire : INSCRIPTIONS
Retrouvez le quiz "Chimie et intelligence artificielle"
Le principe de la bougie, vieux comme le monde, consiste en un corps gras (combustible) et une mèche inflammable.
Lorsqu’on enflamme la mèche, la chaleur dégagée fait fondre le corps gras. Ce liquide cireux va alors grimper le long de la mèche par un phénomène appelé capillarité et se vaporiser sous l’action de la chaleur. Les gaz formés brûlent au contact du dioxygène de l’air : c’est la flamme de la bougie.
Cette combustion consomme la cire et le dioxygène et elle dégage de la chaleur. Elle va donc permettre la fonte de la cire restante et fournir en continu l’apport en combustible dans la mèche, ce qui entretient le processus, bien que la mèche se consume peu à peu.
En l’absence d’air (donc de dioxygène) - ou de mèche - la bougie s’éteint.
Les composants des bougies
Historiquement, la mèche était un jonc, il était trempé dans de la graisse fondue animale, suif de bœuf ou de mouton, graisse de cochon… ou cire d’abeille (beaucoup plus coûteuse et essentiellement réservée aux usages religieux) qu'on laissait ensuite durcir.
L’identification au début du XIXe siècle de la stéarine (i) extraite de graisse animale ou végétale et dont l’acide stéarique est issu puis, à la fin de ce siècle de la paraffine solide, issue du pétrole, a permis la production industrielle des bougies, formées avec des mèches en coton ou en chanvre tressé entourées d’une cire pouvant être moulée et solide à température ordinaire. Lors de leur fabrication, les bougies peuvent être colorées, si l’on introduit des pigments, ou parfumées par exemple par des huiles essentielles.
Les températures de fusion varient selon les produits utilisés. La température de fusion de la paraffine se situe entre 52 et 56°C, celle de l’acide stéarique est de 69-70°C et celle de la cire d’abeille se situe entre 62 et 65°C.
De nos jours, les bougies commercialisées sont essentiellement fabriquées à partir de paraffine.
Les constituants chimiques
Les graisses végétales ou animales sont composées de triesters du glycérol et d’acides à très longue chaine carbonée appelés acides gras (ii). Ainsi, la stéarine est le triglycéride de formule C57H110O6) (iii) dont on tire l’acide stéarique de formule CH3-[CH2]16-COOH. C’est l’acide stéarique qui a permis la production à grande échelle de bougies tout au cours du XIXe siècle (iv).
La paraffine est un mélange obtenu en raffinerie à partir de résidus solides du pétrole. Elle est constituée d’alcanes, molécules d’hydrocarbures saturés, de formule brute CnH2n+2, où la valeur de n se situe entre 18 et 32.
La paraffine qui est utilisée dans la production industrielle de bougies est en général complétée par l’apport d’un mélange appelé « acide stéarique technique » composé d’acides palmitique(v)et stéarique, et improprement appelé « stéarine »(vi). Ce mélange permet de rendre la cire plus opaque, plus dure ou encore d’augmenter la durée de combustion de la bougie.
La cire d’abeille est un mélange naturel complexe dont les constituants chimiques ne sont pas tous identifiés. Elle est composée d'environ 15% d'hydrocarbures linéaires à longues chaînes, 71% d'esters (dont 44% de monoesters d'acide gras et d'alcool gras, 12% d'hydroxyesters, 14% de di et triesters et 1% d'esters de stérols), 3% d'acides libres (vii) et 1% d'alcools libres, auxquels s’ajoutent des composés variables selon l’origine de la ruche.
La combustion de la bougie
La combustion complète des substances constituant une bougie conduit à la formation de CO2 et H2O. Mais si elle est incomplète, par manque d’oxygène elle produit aussi du monoxyde de carbone CO et des dépôts de carbone (suie).
De plus, une fois chauffés, la paraffine et les éventuels adjuvants parfumés ou colorés libèrent un peu de substances (acétone, benzène, toluène) toxiques et agressives pour les poumons. La combustion d’une bougie parfumée donne aussi naissance à des particules ultrafines associées à des HAP, hydrocarbures aromatiques polycycliques que l’on retrouve lors d’une combustion incomplète, et dont la toxicité est connue.
S’il y a de la fumée ou de la suie visibles, c’est que la bougie contient des substances polluantes.
La cire d’abeille ne dégage pas de fumée en brûlant ce qui donne des bougies moins polluantes.
Il est donc conseillé d’utiliser les bougies dans un milieu suffisamment aéré pour profiter de la magie qu’elles offrent.
Andrée Harari, Françoise Brénon et l’équipe question du mois
(i) La stéarine a été découverte par Michel Eugène Chevreul au XIXe siècle lors de ses travaux sur les corps gras entre 1813 et 1823. Voir son traité Recherches chimiques sur les corps gras d’origine animale (sur le site Gallica -BNF)
(ii) Un acide gras est un acide carboxylique dont la chaine carbonée présente de 4 à 36 atomes de carbone.
(iii) La stéarine est le triester formé à partir du glycérol (ou propan-1,2,3-triol) HOH2C–CHOH–CH2OH et de l’acide stéarique CH3-[CH2]16-COOH. Sa formule développée est :

Domaine public, Lien
(iv) M. E. Chevreul et J. L. Gay-Lussac avaient entrevu l’innovation issue de leurs travaux d’isolement des acides gras, en particulier de l’acide stéarique, et avaient pris un brevet pour la réalisation de la bougie stéarique au cours des années 1830. Source « Des produits chimiques très recherchés: les acides gras pour la fabrication des bougies. La naissance de la lipochimie industrielle au cours du XIXe siècle », Gérard Emptoz, Culture technique, n° 23 (1991), pp. 33-45.
(v) L’acide palmitique a pour formule CH3(CH2)14COOH
(vi) Voir la définition du dictionnaire Larousse
(vii) Sources "Manuel des corps gras", Technique et Documentation, Lavoisier, Paris, 1992, pages 297 et 306 et Cires et cirages E. Gomez § 2.2.2.
Pratiquement un quart de la cire d'abeille est du palmitate de myricyle C15H31-COO-C30H61 et on trouve également une quantité de l'ordre de 12% de cérotate de myricyle C25H51-COO-C30H61.
Pour en savoir plus
[1] Histoire d’une chandelle, de M. Faraday : pages 29 et suivantes (J. Hetzel (Paris) Ed.) (sur le site Gallica - BNF)
[2] Pour les différents parties éclairantes de la flamme, l’article : The candle, the light bulb and the radio, de R. de Hilster, CNPS Proceedings 2017, p. 13
Crédits illustration : DR. A. Harari pour Mediachimie
La crise européenne sur le gaz naturel (le méthane) et sur l’énergie a ses plus vives répercussions sur l’industrie et notamment sur l’industrie chimique qui est énergivore. En effet, outre les besoins en électricité et en chaleur pour les réactions chimiques industrielles, le gaz n’est pas seulement un carburant énergétique mais aussi une matière première pour des produits essentiels.
Prenons comme exemple la chaine des engrais azotés passant par le dihydrogène, l’ammoniac, l’acide nitrique et enfin les nitrates. En effet depuis la découverte du procédé industriel de synthèse de l’ammoniac dit Haber-Bosch en 1913, les engrais azotés ont permis à l’agriculture de multiplier les rendements agricoles notamment sur le blé et le maïs et aussi d’autres cultures vivrières, par un facteur 5 qui n’a pas été l’un des moindres à contribuer à l’augmentation de la population mondiale après 1920.
La synthèse de l’ammoniac, dont la réaction N2 + 3 H2 = 2 NH3, parait simple, exige hautes pression et température (300 bars ; 500°C), donc consomme de l’énergie électrique pour les compresseurs et de la chaleur pour le réacteur.
Mais il faut aussi préalablement produire le dihydrogène et le diazote ce qui s’accompagne de consommation de méthane et de formation de CO2. En effet le dihydrogène H2 est majoritairement issu de la réaction du méthane sur l’eau à haute température et le diazote N2 est obtenu en éliminant le dioxygène de l’air par combustion du méthane (réaction dont la chaleur est récupérée pour la réaction précédente). Le détail de ces réactions est consultable sur le site Mediachimie (1).
On peut aussi obtenir du dihydrogène par combustion partielle de charbon qui conduit à 1200°C au « syngas » (2) dont on peut séparer l’hydrogène. Ce procédé est notamment utilisé en Chine.
Dans le monde on fabrique près de 100 millions de tonnes de dihydrogène s’accompagnant hélas de l’émission de près de 1 milliard de tonnes de CO2 (3).
La fabrication des engrais azotés nécessite préalablement de transformer une partie de l’ammoniac en acide nitrique puis de faire réagir l’ammoniac avec une solution d’acide nitrique. On obtient du nitrate d’ammonium NH4NO3 pouvant être utilisé en solution ou en granulés (4). Un autre engrais utilisé largement est l’urée CO(NH2)2. On le fabrique industriellement par réaction de l’ammoniac sur CO2 à 180°C et sous pression de 150 bars en 2 étapes :
CO2 + 2 NH3 = NH2COONH4
suivie de NH2COONH4 = CO(NH2)2 + H2O (5)
La consommation d’engrais dans le monde s’élève à près de 180 millions de tonnes dont environ 120 Mt azotés qui exigent, rien qu’en matière première, 72 Mt de gaz naturel. On estime que rien que la production de 170 Mt d’ammoniac est responsable de 2% des émissions de CO2 mondiales.
Des procédés plus propres ?
C’est alors qu’intervient la recherche de procédés alternatifs « plus propres ». On trouve alors plusieurs couleurs pour NH3 comme pour le dihydrogène (6) :
- l’ammoniac « gris » par le procédé traditionnel Haber-Bosch issu du méthane ou d’hydrocarbures,
- l’ammoniac « bleu » avec encore Haber-Bosch mais avec la capture du CO2,
- l’ammoniac « vert » toujours Haber-Bosch mais avec de l’hydrogène obtenu par électrolyse de l’eau.
Pour l’instant seule une installation en Arabie Saoudite et un projet au Canada sont ou seront capables de fournir et commercialiser de l’ammoniac bleu qui, à cause du transport vers l’Europe, devient un peu gris-bleu !
Les deux plus importants producteurs d’ammoniac européens YARA et BASF penchent vers une solution de décarbonation en utilisant de l’hydrogène produit par des électrolyseurs proches des réacteurs d’ammoniac. Si l’électricité utilisée vient d’éoliennes alors il sera vert, si c’est de l’électricité issue du nucléaire il tendra vers le jaune. En fait techniquement on peut se passer de sources de méthane mais le problème est économique car l’ammoniac « vert » a un prix de revient lié au prix du MWh et est bien plus élevé que le « gris » sauf si le prix du gaz reste anormalement élevé.
La recherche pour des procédés « durables »
Y a-t-il des méthodes « douces » pour obtenir l’ammoniac ? Le principal problème chimique est de casser la molécule de diazote dont la liaison N≡N est particulièrement forte. Plusieurs recherches sont menées pour y parvenir, une équipe américaine a réussi à hydrogéner l’azote de l’air en solution grâce à un complexe hydrocarboné de zirconium. Des chercheurs de Rice University ont réussi par électro catalyse à produire environ 10 g d’ammoniac par heure à partir d’un catalyseur constitué de microcouches 2D de sulfure de molybdène où les atomes de soufre sont partiellement remplacés par du cobalt. Une autre équipe coréenne a simulé la même réaction d’un enzyme nitrogénase que certaines bactéries utilisent pour fabriquer l’ammoniac à partir de l’azote de l’air avec des feuillets de nitrure de Bore BN. C’est la même stratégie qu’a suivi une équipe de Montpellier en s’attaquant aux nitrates dispersés dans l’environnement pour les transformer par électro catalyse en NH3.
Ces réactions ont en commun de ne pas dégager de gaz à effet de serre (CO2) et aussi d’être à l’échelle du laboratoire capable de générer quelques grammes par heure. Il faudra encore des années avant qu’un procédé industriel robuste puisse concurrencer le procédé classique.
L’industrie européenne
Oui l’industrie de l’ammoniac en Europe est vitale. Le cours du gaz qui inférieur à 50 € le MWh en 2020 a dépassé les 300 € au plus fort de la crise en août 2022 pour revenir à des valeurs proches de 100 € pénalise fortement la production d’ammoniac et celle d’engrais azotés. Le nitrate et l’urée ont vu leurs prix multipliés par 3 entre 2021 et 2022 ce qui contraint les agriculteurs à diminuer drastiquement les intrants et même à les supprimer pour les petites exploitations avec des répercussions sur les rendements (7).
Même la chaine des constructeurs automobile est atteinte. Devant le prix du gaz et de l’énergie les chimistes européens ont partiellement arrêtés les unités d’ammoniac et réduit les fabrications d’au moins 30% d’où un manque d’urée pour la dépollution automobile (AdBlue) et industrielle. D’un point de vue plus général, la chimie européenne suivant la déclaration du président de BASF en Allemagne se pose la question de sa survie ou de ses délocalisations si la situation tendue sur l’énergie et le gaz perdure.
Jean-Claude Bernier et Françoise Brénon
Pour en savoir plus :
(1) Comment fabriquer des engrais avec de l’air ? La synthèse de l'ammoniac, Françoise Brénon (Réaction en un clin d’œil, Mediachimie.org)
(2) Comment fabriquer de l’essence avec du charbon ? La réaction de Fischer-Tropsch, Jean-Claude Bernier (Réaction en un clin d’œil , Mediachimie.org)
(3) Vision de l’hydrogène pour une énergie décarbonée, conférence et article de Xavier Vigor Colloque Chimie et énergies nouvelles, 10 février 2021
(4) Le nitrate d’ammonium, un engrais dangereux ?, Jean-Claude Bernier (éditorial, Mediachimie.org)
(5) La première synthèse organique, Marika Blondel-Mégrelis (Mediachimie.org)
(6) Qu’est-ce que l’hydrogène « vert » ?, Françoise Brénon (Question du mois, Mediachimie.org)
(7) Agriculture du futur : s’appuyer sur les savoirs et non sur les croyances, Jean-Yves Le Deaut, Colloque Chimie et Agriculture durable, un partenariat en constante évolution scientifique, 10 novembre 2021
Crédits : image d'illustration, licence CC0, PxHere
La chimie est partout et emploie des opérateurs, techniciens, ingénieurs et docteurs dans de très nombreux secteurs d’activité, la chimie mais aussi la pharmacie, la cosmétologie, l’énergie, la plasturgie, la métallurgie, l’électronique, les matériaux, la protection des cultures et même dans la police scientifique… La chimie se diversifie dans la chimie du végétal, la biomasse, le recyclage, l’environnement, la santé…
Pour en savoir plus, vous pouvez consulter :
- les fiches Les chimistes dans
- et la rubrique Où travaillent les chimistes ?
En recherche, en développement, en production, en commercial…, les compétences sont et seront encore plus recherchées au cours des prochaines années.
Lycéens et étudiants, vous qui décidez de vos choix futurs, découvrez les domaines d’activité en entreprise, les fonctions ou métiers associés ainsi que des vidéos dans l’espace Métiers.
Pour vous aider à trouver la bonne voie consultez :
- les parcours de formations
- les fiches Orientation
- les fiches Grand oral dont une partie est consacrée au projet d’orientation et aux métiers.
Une rubrique « ? Métiers, des réponses à vos questions » complète les informations.
C’est un problème de santé publique et aussi de chimie analytique !
Nous avons besoin de sel (chlorure de sodium de formule NaCl) pour maintenir constant notre équilibre électrolytique : c’est-à-dire les rapports entre les concentrations des différents ions (sodium, potassium, chlorure, calcium, magnésium, phosphate) et l’eau contenus dans notre organisme. Or on perd du sel dans l’urine et la sueur et c’est pourquoi nous devons consommer du sel. Si le sel est vital pour notre organisme un excédent de sel entraine une augmentation de la pression artérielle conduisant à des maladies cardiovasculaires et des AVC. Il est à signaler que l’organisme a besoin d’un minimum de sel pour bien fonctionner car si nous n’en absorbions pas du tout les effets de toxicité seraient les mêmes que ceux décrits lors d’une trop grande consommation. L’OMS recommande de diminuer la consommation de sel depuis une dizaine d’années pour atteindre un objectif de 30% de baisse en 2025.
Pour réduire la consommation en sel, il faut : i) diminuer la dose journalière qui est située actuellement entre 6,5 et 12,5 g de sel/jour, ii) réduire le taux de sel dans les aliments consommés, iii) réduire l’usage du sel de table, en ne dépassant pas le taux de 1,5 % en masse d’aliment, iv) abaisser l’optimum de préférence au goût en utilisant par exemple des arômes de cacahuète ou des ajouts d’herbes aromatiques (persil, basilic, origan… qui renforcent la perception du sel. Des tests sont actuellement en cours sur l’utilisation des différentes variétés de sel (sel fin, fleur de sel, sel micronisé) [1].
La saveur salée fait partie des cinq saveurs fondamentales dont l’amer, l’acide, le salé, le sucré et l’unami (qui vient du japonais : goût protéine des viandes). Leur carte de répartition n’est pas localisée dans des zones précises de la langue contrairement à une idée répandue jusque dans les années 70 [2]. La saveur salée est perçue par toutes les papilles de la langue par un mécanisme transmembranaire qui déclenche un influx nerveux transmis au cerveau nous permettant d’apprécier cette saveur. Les seuils de détection varient avec l’âge de 0,3 g/L pour les juniors à 0,8 g/L pour les seniors, sans différence observable entre les hommes et les femmes. Mais il n’y a pas que le cation sodium du chlorure de sodium qui est responsable de la saveur salée : l’ion potassium, le lithium (non consommable) et l’ion ammonium participent aussi à cette saveur. Le chlorure d’ammonium est utilisé dans les pays du Nord où les rennes sont domestiqués de cette manière car ils en raffolent !
Disposer de mesures précises de la teneur en sel de nos aliments est donc nécessaire.
Des observations qualitatives de fluorescence ont montré que le sel pénètre peu dans la viande grillée de bœuf mais assez profondément dans la chair du poulet cuit [1] .
Des mesures IRM (imagerie par résonance magnétique) issues de la résonance magnétique nucléaire (RMN) du sodium (23Na), nécessitant d’utiliser des champs magnétiques forts de l’ordre de 4,7 teslas (environ cent mille fois le champ magnétique terrestre !) permettent de doser avec une grande précision la teneur en sodium des aliments [1]. Par exemple on a pu mesurer exactement la quantité de sel dans des jambons après un séchage de plus de six mois (8 g de sel pour 55 g d’eau !) Mais cette méthode permet aussi d’obtenir une cartographie de la répartition du sel à l’intérieur des aliments (sans la destruction de cet aliment). Des carottes cuites dans des solutions classiques de cuisine ont été analysées et la concentration du sel au bord des carottes est égale à 7,2 g/L tandis qu’à l’intérieur de la carotte elle est deux fois plus faible ! Une étude plus fine des formes des spectres montre l’existence d’ions sodium libres mais aussi d’ions sodium liés aux molécules voisines contenues dans l’aliment, ce qui donne des informations sur la relation entre la saveur salée plus ou moins longue en bouche et la nature des aliments !
À noter que l’emploi du glutamate de sodium comme alternative au chlorure de sodium fait encore l’objet actuellement de travaux de recherche car il est responsable des saveurs : salée mais aussi unami !
Jean-Pierre Foulon et l'équipe Question du mois
Note : L’IRM du sodium est aussi utilisée avec succès pour doser les ions sodium dans le cerveau humain (travaux de recherche réalisés à l’hôpital de Marseille en 2022 !) permettant des diagnostics médicaux très précieux.
Pour en savoir plus :
[1] Comment réduire le sel dans notre alimentation ? série de cinq conférences vidéos par H. This, C. Hugol-Gential, J.M. Bonny, T. Thomas-Danguin, J.P. Poulain, en libre accès sur le site de l’Académie de l’agriculture, séance 19/10/2022
[2] Le goût : de la molécule à la saveur, Loïc Briand, in La chimie et les sens (EDP Sciences, 2018) pp. 189-209 ; vidéo et chapitre du Colloque La chimie et les sens (22 février 2017).
Crédits : image d'illustration, licence CC0, PxHere
Vous qui n’avez pas la possibilité de venir à la Fondation de la Maison de la Chimie le 9 novembre 2022, vous pouvez assister en direct au « Colloque Chimie et Matériaux Stratégiques »
sur Mediachimie ou sur Youtube.
La captation des conférences sera par la suite disponible en ligne et leur mise à disposition sera indiquée sur la page d'accueil de Mediachimie.
La molécule de formule NH3 appelée ammoniac(i) est un gaz, très soluble dans l’eau. On donne aussi le nom d’« ammoniaque » ou « solutions ammoniacales » à ses solutions aqueuses.
La forme gazeuse est présente à l’état naturel lors de la décomposition de substances protéiques. 80% de sa production industrielle par le procédé Haber-Bosch(ii) sert à la synthèse des engrais.
Pour ce qui est des applications domestiques, on trouve la solution aqueuse en magasin de bricolage, dans les rayons de produits ménagers ou sur Internet, avec les informations d’utilisations suivantes « nettoyant, décapant », « dégraisse, détache les tissus, ravive les couleurs », « nettoyer les tapis et moquettes, nettoyer les surfaces vitrées… ». Il existe aussi des mélanges prêts à l’emploi.
En ce qui concerne le nettoyage de l’argenterie, l’utilisation des solutions d’ammoniac est discutable(iii).
La solution d’ammoniac est également une des composantes utilisée pour réaliser des « frisures permanentes » sur cheveux(iv), ou dans des colorations capillaires.
Les noms rencontrés sur les étiquettes du commerce
Ammoniaque alcali 22° baumé ; ammoniaque 13° ; ammoniac 13% ; ammoniaque alcali 13 % ; alcali 13% ; ammoniaque (ou ammoniac) alcali 22° hydroxyde d’ammonium ref alcali en solution à 20% (en poids d’ammoniaque dans l’eau).
Ces noms recouvrent-ils la même chose et quelles sont les significations de toutes ces informations ?
Que se passe-t-il lors de la dissolution de l’ammoniac gazeux dans l’eau ?
Lors de la dissolution du gaz ammoniac dans l’eau il s’établit un équilibre dont l’équation bilan (A) est la suivante :
(A) NH3 (aq) + H2O (l) = NH4+(aq) + OH-(aq)
Mais cet équilibre ne produit qu’une très faible quantité d’ions ammonium NH4+. Ainsi la solution contient très majoritairement des molécules d’ammoniac hydratées. Par exemple, pour 17 g de gaz ammoniac NH3 dissout dans 1 L d’eau cela conduit à l’équilibre à avoir 99,6 % sous forme NH3,aq(v). Il se forme seulement 0,4 % sous forme NH4+ et simultanément la même faible quantité d’ions hydroxyde OH-.
Ainsi écrire que l’ammoniaque (correspondant à l’ammoniac en solution) aurait pour formule chimique NH4OH est donc inexact et source d’erreur(vi). Cette formulation date du XIXe siècle(vii).
La solution aqueuse d’ammoniac est aussi une solution basique en raison de la présence des ions OH-(viii).
Le mot « alcali » a pris plusieurs définitions au cours des siècles. En tant qu’adjectif il signifie que le produit est une base forte et donc que sa solution a concrètement un pH allant de 10 à 14 selon sa concentration(ix), ce qui est le cas de la solution d’ammoniac. En tant que nom, « l’alcali » ou « alcali volatil » est synonyme de solution d’ammoniac. Ce terme est toutefois désuet.
Pourquoi l’ammoniac peut-elle retirer des taches de couleurs ?
L’ammoniac NH3 peut donner des complexes en s’associant aux molécules responsables de la tache et ainsi « l’encapsuler » ou faire passer sous forme ionique un colorant qui sera alors soluble dans l’eau. Son caractère basique participe aussi au processus de dégraissage.
Ces propriétés étaient utilisées dès l’Antiquité ! À Pompéi et dans la Rome antique il existait des ateliers de foulonnerie où l’on nettoyait les vêtements des dignitaires. Le linge était foulé avec les pieds par des esclaves dans des bacs contenant des argiles et de l’urine humaine récoltée dans la ville. En effet l’urine contient de l’urée qui se transforme en ammoniac grâce à une enzyme uréase (naturellement présente dans l’urine) selon :
(NH2)2CO (urée) + H2O → CO2 + 2 NH3
Précautions à prendre dans un usage domestique(x)
En raison de son caractère basique, il est conseillé d’utiliser des gants lors de la manipulation d’une solution aqueuse d’ammoniac et d’éviter le contact avec les yeux et les muqueuses.
L’odeur caractéristique de l’ammoniac ne vous échappera pas ! Au moment de manipuler ce produit il est vivement conseillé d’ouvrir les fenêtres pour aérer la pièce et d’éviter de respirer les vapeurs.
Ne pas stocker ni manipuler le produit près d’une source de chaleur, car NH3 dissous peut facilement redonner de l’ammoniac gazeux s’échappant du flacon.
Ne pas stocker la bouteille d’ammoniac à proximité d’une bouteille d’acide chlorhydrique (éventuellement possédée comme détartrant). En effet les vapeurs de NH3 comme celles de chlorure d’hydrogène (HCl) pouvant s’échapper des flacons donneront des cristaux blancs de chlorure d’ammonium(xi), qui se déposeront sur les bouchons. On peut observer que les grandes surfaces ne respectent pas toujours ces règles de stockage !
Dans diverses circonstances vous pouvez identifier la présence d’ammoniac. Par exemple :
- L’ammoniac apparait dans des processus de fermentation réalisés dans l’industrie agroalimentaire. Ainsi les caves d’affinage du Comté se distinguent par une forte odeur due à des vapeurs d’ammoniac(xii).
- Le Hákarl, plat traditionnel de l'Islande obtenu par fermentation de chairs de certains requins, a une odeur très forte due à la transformation in fine de l’urée en ammoniac, comme vu pour les urines grâce à l’action de l’uréase. La chair du poisson passe alors d’un pH 6 à un pH 9.
- L’émanation de l’ammoniac gazeux a lieu également si on laisse vieillir trop longtemps certains fromages ou certains poissons et est associée de façon générale aux processus de putréfaction.
Pour en savoir plus sur la concentration des solutions vendues
Pour les étiquettes indiquant un pourcentage, il s’agit du pourcentage massique(xiii) correspondant au rapport entre la masse de la quantité d’ammoniac introduite(xiv) dans l’eau sur la masse totale de la solution obtenue. Donc l’information « solution à 13% » signifie que 100 g de solution contient 13 g de NH3.
Qu’est-ce que le degré Baumé ?
Il est étonnant de trouver encore une information en degré Baumé, unité exclue des unités légales françaises depuis 1961. À 20 °C, la correspondance entre la densité et les degrés Baumé (noté B) pour les liquides moins denses que l'eau (densité < 1) est : d = 140 / (B + 130). Cela donne pour la solution d’ammoniac à 22° d = 140/(22+130) = 0.921 et donc une masse volumique(xv) de 0,921 kg/L.
Les étiquettes au laboratoire de chimie
Dans les laboratoires de chimie l’étiquette indique un pourcentage massique, P, une masse volumique ρ en g par litre (g.L-1) et une masse molaire M en g par mole (g.mol-1). Ces 3 données permettent de déterminer la concentration molaire en ammoniac, [NH3,aq], exprimée en mol par litre (mol.L-1) ; la relation à utiliser est C = P* ρ /M où bien sûr la masse molaire de l’ammoniac est M = 17 g.mol-1 et non 35 g.mol-1, comme on le trouve de façon erronée sur certains flacons, sur des sites Internet grand public et même sur la fiche officielle associée à son numéro CAS(xvi) ! Cette masse molaire erronée provient de l’hypothèse fausse que l’ammoniaque aurait pour formule NH4OH(xvii).
Conclusion
Si l’ammoniac est connu depuis l’Antiquité par ses usages qui perdurent et satisfont les consommateurs, son identification ne date que de la fin du XVIIIe siècle et est due à Claude Louis Berthollet(xviii).
Et qu’en est-il des dénominations ammoniac ou ammoniaque et des formules chimiques NH3 ou NH4OH associées ? Cette chronique illustre que la chimie est une science étudiant des phénomènes complexes à modéliser dont l’interprétation ne fait pas nécessairement l’unanimité et évolue en fonction des connaissances.
Lydie Amann et Françoise Brénon et l’équipe question du mois
(i) du grec Ammoniakon, « de Ammôn », nom grec d'Amon, dieu égyptien, car on extrayait près du temple d’Ammon en Lybie un minerai nommé salmiac, qui libérait ce gaz. Le salmiac contient du chlorure d’ammonium NH4Cl.
(ii) Consulter Comment fabriquer des engrais avec de l'air ? La synthèse de l'ammoniac
(iii) Pour l’argenterie, le noircissement de l’argent étant lié à la formation de sulfure d’argent très stable, l’ammoniac ne suffit pas à le détruire par complexation. Pour en savoir plus : Nettoyer l’argenterie par « une recette de grand-mère » : comment ça marche ?
(iv) Pour en savoir plus Pourquoi ça frise ou ça défrise ?
(v) Ce calcul résulte de la valeur de la constante d’équilibre
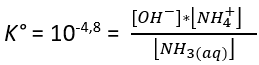
On notera que 17 g de NH3 correspond à 1 mol d’ammoniac soit environ la dissolution de 25 L de gaz à température ambiante.
(vi) Voir la bonne définition du Larousse https://www.larousse.fr/dictionnaires/francais/ammoniaque/2936
(vii) On lira avec intérêt cet article du Chemical Education Why We Are all Using a Nonexistent Substance: NH4OH
(viii) L’acidité et la basicité d’une solution aqueuse sont mesurées sur une même échelle par le pH, grandeur reliée à la concentration en ions H+aq par pH = - log[H+aq].
Les concentrations en H+aq et OH-aq étant toujours liées par la relation [H+aq] * [OH-aq] = Cte. On considère qu’une solution est basique si son pH est supérieur à 7 et acide si pH <7.
(ix) En prenant le même exemple que précédemment (cf. note v), le pH de cette solution vaut 11,6.
(x) On peut consulter la fiche de toxicologie de l’ammoniac sur le site de l’INRS ici.
(xi) La réaction mise en jeu est : HCl (gaz) + NH3 (gaz) → NH4Cl (s). À ce sujet consulter l’anecdote historique La chimie contre les mauvaises odeurs.
(xii) La teneur en ammoniac dans l’air y est de l’ordre de 23 ppm (partie par million en volume dans l’air (mL/m3) d’après le CIGC - Comité Interprofessionnel de Gestion du Comté).
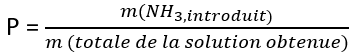
(xiv) Compte tenu de l’équilibre (A) très peu déplacé, la masse d’ammoniac introduite est quasiment égale à la masse de NH3(aq) à l’équilibre.
(xv) La masse volumique se calcule par la relation ρ = d*ρ(eau) sachant que ρ(eau) = 1 kg/L
(xvi) Le numéro CAS de la solution aqueuse est : 1336-21-6 et celui du gaz est 7664-41-7.
Il s’agit de son numéro d'enregistrement unique auprès de la banque de données de Chemical Abstracts Service.
(xvii) Exemple : Le chimiste dans son laboratoire prend une bouteille et étudie l’étiquette pour en connaitre les caractéristiques. Il lit par exemple : P = 28% ρ = 0,90 kg/L et M = 35,05 g/mol. Une autre bouteille donne les mêmes informations sauf au niveau de la masse molaire M = 17 g/mol.
Or, l’expression de la concentration molaire exprimée en mol /L a pour expression : C = P* ρ /M .
Ainsi, l’application numérique pour la bouteille 1 donne donc C voisine de 7,2 mol. L-1 et pour la bouteille 2 de 15 mol. L-1, le facteur 2 provenant du facteur 2 entre les 2 masses molaires. Pourtant les dosages acido-basiques de ces 2 solutions montrent que chacune des 2 bouteilles a une concentration en ammoniac NH3 voisine de 15 mol/L. L’erreur provient du fait que l’ammoniaque est assimilée à l’hydroxyde d’ammonium NH4OH en solution (d’où M = 14 + 16 + 5 = 35 g.mol-1) ce qui est erroné comme l’a montré l’étude de l’équilibre de dissolution dans lequel l’ammoniac reste essentiellement sous la forme NH3(aq).
(xviii) voir Berthollet et la découverte de la composition de l’ammoniac
Crédits illustration : DR. F. Brénon pour Mediachimie
L’américain Barry Sharpless (pour la seconde fois après ses travaux sur la catalyse en particulier de réactions stéréospécifiques d’époxydation, couronnés par le Prix Nobel en 2001 !), le danois Morten Meldal et l’américaine Carolyn Bertozzi ont reçu le Prix Nobel de Chimie le 5 octobre 2022 pour « le développement de la chimie click et de la chimie bio-orthogonale » selon le communiqué de l’Académie Royale de Suède.
Qu’entend-on par chimie click ?
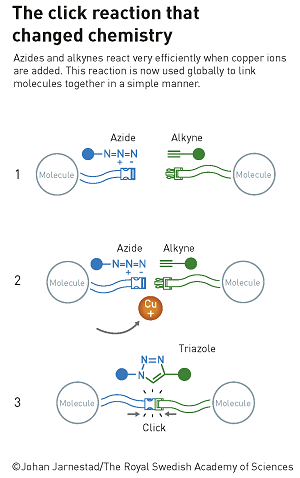
Il s’agit d’un concept simple envisagé par B. Sharpless au début des années 2000 : faire réagir deux molécules pour créer une liaison robuste, comme une ceinture de sécurité fait avec un « clic », pour reprendre la formulation du comité Nobel ; par exemple des réactions de cycloaddition mettant en jeu des molécules dipolaires 1-3 (les charges positives et négatives sont réparties sur trois atomes adjacents).
Parallèlement M. Meldal découvrait par hasard une réaction de cyclisation entre un alcyne (molécule à triple liaison carbone-carbone) avec une molécule dipolaire spécifique l’azoture (molécule à trois atomes d’azote) (i).Il généralisa alors en fonctionnalisant deux molécules l’une avez une extrémité azoture et l’autre avec une extrémité alcyne conduisant à des produits de cycloadditions variés. La réaction nécessite l’emploi d’un catalyseur à base de cuivre. Le rendement est quantitatif si on rigidifie l’alcyne dans une structure cyclique (cyclo-octyne) (ii).
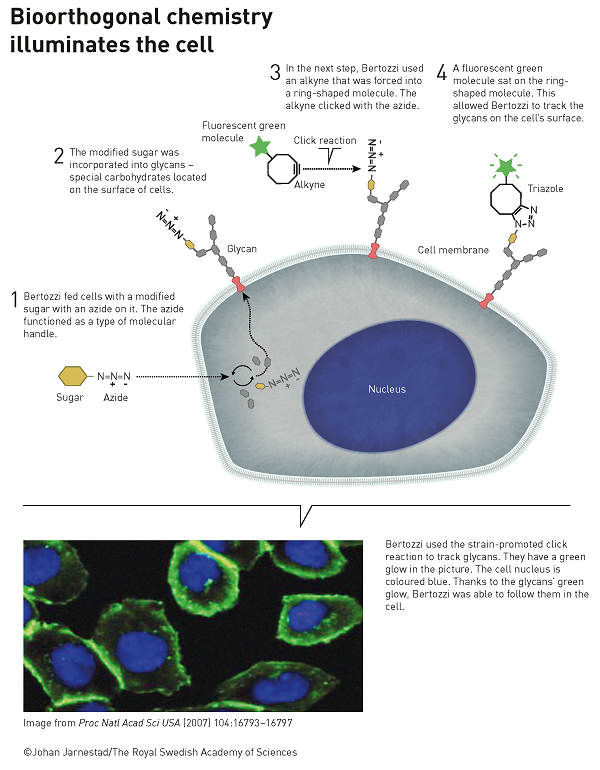
Mais l’élément cuivre n’est pas très compatible avec des réactions dans les milieux biologiques in vivo et c’est là que C. Berzotti proposa en 2003 de fixer sur une molécule polymère de polysaccharide la partie azoture ce qui conduit à la réaction de cyclisation sans nécessité d’employer le catalyseur au cuivre !
Ce sont des réactions quantitatives (100% de rendement), rapides, très sélectives et surtout sans sous-produit ce qui correspond bien aux douze commandements de la chimie verte ! Elles sont souvent réalisées dans l’eau (donc pas de problème de toxicité ici !) et à température ambiante ou jusqu’à 37°C (température des êtres humains bien sûr !).
Qu’entend-on par chimie bio-orthogonale ?
C’est Carolyn Berzotti qui a introduit ce concept en 2003 et il faut comprendre par là qu’il s’agit de l’ensemble des réactions conduisant à la formation ou la rupture de liaisons au sein des milieux biologiques sans interagir (c’est le sens particulier du mot orthogonal ici !) avec les fonctions chimiques présentes dans des milieux complexes : intracellulaire, le sang ou même jusqu’à l’organisme tout entier. C. Bertozzi avec son équipe a généralisé la réaction entre des azotures et des alcynes greffés sur toutes les molécules type sucres d’un organisme vivant tels que les modèles du poisson-zèbre ou la souris en ajoutant sur les molécules des groupes fluorescents permettant de suivre l’évolution réactionnelle.
Cependant peu de réactions synthétiques sont vraiment bio-orthogonales et peuvent être réalisées dans un animal. Les réactions les plus courantes sont justement les cycloadditions entre les azotures et les cyclo-octynes !
La chimie bio-orthogonale peut alors conduire par ces réactions click à i) fonctionnaliser des matériaux tels que les NTC (nanotubes de carbone) ou des polymères pour créer des propriétés adhésives par exemple ii) des nouvelles stratégies thérapeutiques en construisant des médicaments in vivo et en contrôlant leur vitesse de libération dans des organes malades bien ciblés telles que des cellules cancéreuses.
Jean-Pierre Foulon
8 octobre 2022
(i) L’azoture a pour formule globale N3- et pour représentation
 (Wikimedia, domain public)
(Wikimedia, domain public)
 (Wikimedia, domain public)
(Wikimedia, domain public)
Illustrations et schémas disponibles sur http://nobelprize.org/
© Johan Jarnestad/The Royal Swedish Academy of Sciences

Pour en savoir plus
(1) Deux articles du numéro spécial de chemiobiologie de l’Actualité Chimique n° 468 de décembre 2021 :
- De la chimie bioorthogonale au développement de nouvelles stratégies thérapeutiques, S. Papot et F. Taran, p. 13
- Les rapporteurs chimiques bioorthogonaux : une approche au cœur de la chémobiologie, C.Biot et B. Vauzeilles, p. 16
(2) Reprogrammation de la réactivité du fer dans le cancer, R. Rodriguez, article et conférence, colloque Chimie et Nouvelles thérapies du (13 novembre 2019)
Illustrations :
Portraits Carolyn R. Bertozzi, Morten Meldal, K. Barry Marshall © Nobel Prize Outreach. Ill. Niklas Elmehed.
Autres illustrations © Johan Jarnestad/The Royal Swedish Academy of Sciences
La Fête de la science 2022 se tiendra en France métropolitaine du 7 au 17 octobre et en Outre-mer et à l'international du 10 au 27 novembre sur la thématique du « Réveil climatique ». Mediachimie.org accompagne cette fête et vous propose une sélection de ressources en relation avec cette thématique.
Découvrez les vidéos de la série « Des Idées plein la Tech » qui vous invitent dans des laboratoires de centres de recherche et d'entreprises innovantes :
- Vive le CO2 ! menace ou ressource ?
- Déchets plastiques : les enzymes font le ménage
- Hydrogène, la roue libre
- La peinture qui dépollue
- Air pur et catalyse
Amusez-vous en testant vos connaissances avec nos QUIZ :
- Les éoliennes
- Le bois, ressource durable
- L’hydrogène, un gaz au secours de la planète ?
- Énergie du futur et préservation des ressources
- Les éléments chimiques dans les énergies renouvelables d’origines éolienne et photovoltaïque
- La voiture à hydrogène
- Les éléments chimiques dans l'éclairage
- Les éléments chimiques dans les piles et les batteries
- Une chimie de la mer pour l’avenir de la Terre
Vous vous posez la question : « Comment la chimie et ses métiers peuvent-ils contribuer à la lutte contre le changement climatique » ? Vous trouverez des réponses dans l’espace métiers :
- Les chimistes dans : La protection de l'environnement
- Les chimistes dans : Les énergies nouvelles face au développement durable
- Les chimistes dans : l'économie circulaire
- Les chimistes dans : La chimie du végétal comme substitut du pétrole
Découvrez aussi des fiches Grand oral pour le Bac, issues du partenariat Nathan / Mediachimie qui abordent ce sujet :
- Le dihydrogène est-il une solution d’avenir pour lutter contre le réchauffement climatique ?
- Les sources d'énergie renouvelables, une réponse à la pauvreté énergétique ?
- Que faire du CO2 ?
- La chimie est-elle une des clés de l’agriculture durable ?
La Fête de la science, ce sont également des milliers d'animations gratuites, partout en France. Les activités proposées par chaque région de France et d’Outre-mer sont consultables sur le site https://www.fetedelascience.fr/
Illustration : Capture écran. Twitter @FeteScience
La sécheresse qui a sévi en 2022 et les vagues de chaleur estivales ont entrainé cet été des évènements extrêmes et des manifestations « hypohydriques » que nous n’avions pas souvent connus. La plus spectaculaire a été les nombreux départs de feux de forêts ou de broussailles facilités par une végétation asséchée mais aussi la faible croissance des cultures vivrières et le jaunissement des prairies que broutent les animaux, les coupures d’eau potables dans certains villages ruraux et les fissures apparues dans de nombreuses maisons individuelles bâties sur terrain argileux.
Tout ceci montre une fois de plus l’importance d’une molécule ; l’eau H2O indispensable à la vie quotidienne et à la vie tout court.
H2O l’indispensable
Notre corps est composé en moyenne à 65% d’eau (pour un adulte) (1). En cas de canicule il est indispensable de boire car si la teneur baisse de quelques % des troubles apparaissent. On peut être privé de nourriture pendant plusieurs jours mais pas d’eau. Toute activité physique nécessite une énergie chimique stockée dans notre corps sous forme d’une précieuse molécule l’ATP (2) qui se transforme en ADP en libérant de l’énergie PI utilisée par nos muscles. L’équation simplifiée dans un effort d’endurance (3) qui consomme du dioxygène est :
Glucose + O2 + ATP = PI +ADP + CO2 + H2O.
Lors d’un effort sportif on libère donc du CO2 mais aussi de l’eau. C’est pourquoi lors par exemple du tour de France les coureurs doivent boire beaucoup de litres d’eau car ils en perdent beaucoup sous forme de vapeur ou de sueur.
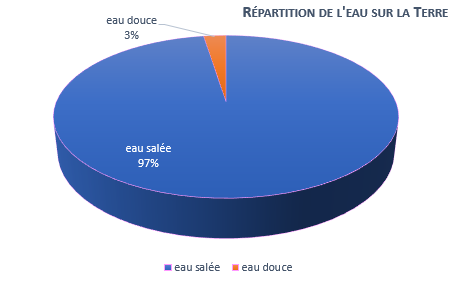
Cette eau essentielle à la vie combien en dispose-t-on ? Sur notre planète Terre, l’eau est essentiellement sous forme d’eau salée (97,5 %) et 70% de l’eau douce est sous forme de glace ou de neige. Pour l’humanité c’est bien sûr la ressource en eau douce qui est importante elle est de l’ordre de 35 millions de km3 dont la moitié est normalement accessible (4).
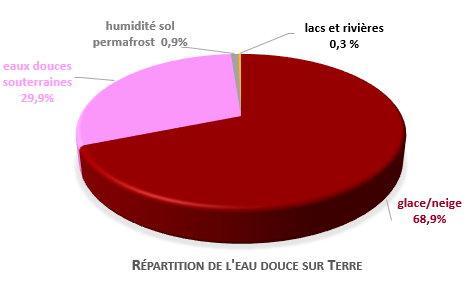
Peut-on craindre une pénurie ? Les experts de la FAO estiment les besoins à 14 000 km3/an soit moins de la moitié des ressources en eaux souterraines qui paraissent suffisantes surtout si on y ajoute une bonne fraction récupérable des 70 000 km3 eaux pluviales annuelles. Encore faut-il différencier la consommation de l’eau et son prélèvement. Pour faire tourner une turbine produisant de l’électricité l’eau prélevée à la rivière y retourne instantanément. En agriculture l’eau nécessaire à l’irrigation est consommée car elle passe dans la plante ou est évaporée.
Une végétation sans H2O
La photosynthèse utilisée par les plantes est une réaction d’oxydo-réduction utilisant l’eau et le dioxyde de carbone CO2 de l’atmosphère qui, sous l’action des photons venant du soleil, fabrique les réserves de la plante sous forme de molécules hydrocarbonées (ici le glucose).
La réaction globale peut s’écrire : 6 CO2 + 6 H2O + photons = C6H12O6 + 6 O2
La chlorophylle est le pigment de couleur verte des feuilles qui permet l’absorption des photons.
Lorsque l’eau vient à manquer les arbres avertis par leurs capteurs sécrètent de l’éthylène à partir d’un de leur acide aminé la méthionine et ne synthétisent plus la chlorophylle responsable de la couleur verte (5). D’où en cette période de sécheresse les couleurs jaunes des prairies et l’amoncellement de feuilles rouges ou marrons dans nos rues en pleine été plutôt qu’en automne.
Le manque d’eau limite également le rendement de la photosynthèse en diminuant les réserves de la biomasse en molécules hydrocarbonées sucres ou amidons d’où la maigreur des épis de blé et de maïs appauvrissant les récoltes de 2022.
H2O au secours des feux de forêts
Les végétaux asséchés sont des cibles choisies pour s’enflammer le plus souvent accidentellement. L’augmentation de la température et la pyrolyse des végétations entrainent l’émission de nombreux composés volatils. Sont présents des composés benzéniques et phénoliques et beaucoup de terpènes pour les pins sans compter l’émission forte d’éthylène en situation de stress hydrique et thermique qui transforme l’arbre en une torche enflammée (6).
Une fois de plus l’eau vient au secours de ces incendies. Lorsqu’on arrose les flammes avec de l’eau, celle-ci se vaporise en puisant des calories au foyer et grâce à sa chaleur latente de vaporisation élevée fait baisser la température de 750°C à 400°C. De plus la vapeur d’eau prive la combustion des composés carbonés de l’oxygène de l’air. Les célèbres Canadair© larguent sur le front de flammes 7 m3 d’eau avec des agents retardateurs tels que les polyphosphates ou argiles, des agents mouillants ou moussants comme l’hexylène glycol (ou 2-méthyl-2,4-pentanediol) qui isolent le végétal de l’air brulant environnant. La couleur rouge des largages est apportée par l’oxyde de fer (Fe2O3) en suspension pour que les avions suivants voient la trace de l’intervention précédente. Notons bien qu’une bonne pluie de 10 mm venue du ciel a bien plus d’efficacité car à elle seule elle représente 100 m3 d’eau par hectare.
Des conséquences du manque de H2O
Plus insidieux sont les effets de la sécheresse sur les réserves souterraines et les bâtiments. Lorsque les terrains souvent argileux sont très secs, ils deviennent durs et peu perméables car leur porosité diminue. En cas de pluie l’eau ruisselle et ne pénètre pas en profondeur pour rejoindre les nappes phréatiques et réserves souterraines qui s’épuisent ce qui entraine des coupures d’eau potable (7). Et comme souvent après les vagues de chaleurs surviennent des orages libérant des volumes de pluie importants en quelques heures qui provoquent par ruissellement des inondations en milieu rural comparables à celles des zones urbaines cimentées et bitumées. Plus grave aussi est la fissuration des habitations dont on dit que potentiellement 10 millions de foyers pourraient être touchés. Ceci est dû aux variations de volume de roches naturelles les argiles ou phyllosilicates lamellaires (8). L’exemple type est la montmorillonite Si4Al2O10(OH)2 où Al peut être partiellement substitué par Mg. La structure en feuillets s’équilibre électriquement alors avec des cations séparant les feuillets. Ces cations plus ou moins hydratés peuvent en fonction de l’hydratation faire varier les inter-distances entre 10 nm et 1000 nm. D’où une aptitude au gonflement et inversement au retrait lors d’une déshydratation qui peut provoquer des déplacements de terrain importants au gré des variations d’humidité. C’est ce qui arrive à nombre de maisons individuelles bâties sur des terres argileuses majoritaires en France.
Ces inconvénients et tracas ne sont rien comparés à ceux que subissent un milliard d’individus qui sur terre manquent d’eau potable et les 2 milliards qui en plus ne disposent pas d’installations de traitement des eaux usées… La chimie a encore beaucoup à faire !
Jean-Claude Bernier
Août 2022
Pour en savoir plus :
(1) Chez un nourrisson, l’eau représente 75 % de son poids total, chez l’adulte, elle descend à 65 % (soit par exemple 45 litres d’eau pour un homme de 70 kg).
(2) Optimisation des performances, complexité des systèmes et confrontation aux limites, in La chimie et le sport, collection Chimie et… junior (EDP Sciences) 2015
(3) Quelle chimie dans le sport ? Épisode 1 : le métabolisme énergétique aérobie , vidéo Blareaureau au labo - Mediachimie
(4) L’eau, un nouvel « or bleu », de J.-C. Bernier, L’actualité chimique n° 381 (janvier 2014) p. 4-5
(5) Pourquoi et comment les feuilles se colorent en automne et tombent en hiver ? de C. Agouridas et F. Brénon, Question du mois, Mediachimie.org
(6) La chimie des feux de forêts, de J.-C. Bernier, éditorial, Mediachimie.org
(7) L’eau, une ressource indispensable pour la ville, de A. Charles, A. Harari et J.-C. Bernier, série « Chimie et… en fiches », Mediachimie.org
(8) Cristaux, cristallographie et cristallochimie. Des symétries aux propriétés : fiche 4 - les systèmes monoclinique et triclinique, de A.Harari et N. Baffier, année de la cristallographie (2014), Mediachimie.org
Crédits :
Figures : DR Mediachimie.org
Illustration : Pxhere / licence CC0 Domaine public Lien
À cette question je sens que nombreux vous répondrez : « mais oui bien sûr j’ai plusieurs bouteilles de bière qui sont de couleur verte ». Et vous aurez raison. Car en effet, du point de vue chimique, il se trouve que dans les sables utilisés pour faire ces bouteilles en verre, il y a des impuretés de fer et notamment l’oxyde FeO qui contient du fer à l’état d’oxydation Fe2+. C’est lui qui donne cette coloration verte car il absorbe les rayonnements rouges. Par contre si on oxyde le fer en Fe3+ on obtient alors une coloration brune due à l’absorption des rayonnements bleus (1). La plupart des verres utilisés pour l’agroalimentaire, notamment les boissons, sont de ces couleurs et ils méritent en plus le « label vert » car ils sont majoritairement recyclés.
Fabrication
Revenons un peu sur la fabrication du verre (2). Il s’agit d’une réaction à haute température entre 3 composants : la silice SiO2 (sable), le carbonate de sodium Na2CO3 et le carbonate de calcium ou calcaire CaCO3. On forme alors à 1600°C un verre composé de SiO2, Na2O et CaO) à l’état liquide. Il y a simultanément un avec dégagement de CO2 issu de la décomposition des carbonates. Cette fabrication initiale dans des fours verriers exige une forte énergie fournie majoritairement par des carburants fossiles gaz ou fioul et des matières premières minérales . En France, on fabrique environ 5 millions de tonnes de verre par an sur 60 sites verriers qui consomment 3% de l’énergie totale et émettent aussi 3% du CO2 (3) émis par l’industrie.
Comment alors « décarboner » l’industrie verrière et « verdir » notre verre ?
Recyclage
Depuis les années 70, l’habitude de recycler le verre a été prise et de nombreux points de collectes des bouteilles, flacons et bocaux en verre ont été établis, ce qui permet de recycler près de 80% des verres creux. Sur le territoire plus de 3 bouteilles sur quatre sont recyclées, plus de 2 Mt sont collectées et sont à 100% recyclées.
Pour être efficace et renouvelable à l’infini, le recyclage (4) doit commencer par un tri très strict, et tout d’abord pour les particuliers, lorsqu’on dépose les bouteilles dans les containers. Après les collectes s’opère un tri mécanique qui permet d’éliminer les papiers et objets métalliques puis un tri optique automatique permettant d’éliminer les objets céramiques non fusibles et enfin un tri infra rouge qui permet de séparer les verres colorés des verres blancs transparents. Après ce tri sévère, les verres sont broyés et transformés en calcin, poudre qui peut alors être refondue à environ 1500°C puis à nouveau moulé et façonné en de nouvelles bouteilles.
Cette re-fusion est économique, peut se faire à température plus basse et économise de l’énergie ; elle évite aussi l’émission du CO2 issu de la décomposition des carbonates observé lors de la première fabrication. On estime que la fusion d’une tonne de calcin évite entre 400 kg et 700 kg de CO2 et permet l’économie de 1,300 t de matière première dont plus de 800 kg de sable.
Certaines verreries expérimentent l’oxycombustion qui consiste à remplacer l’air d’alimentation des brûleurs qui chauffent le four par de l’oxygène pur ce qui évite de réchauffer l’azote de l’air, et ainsi d’économiser 25% de gaz, et de réduire d’environ 15% les émissions de CO2 et surtout de diviser par 10 celles des oxydes d’azote (NOx.).
Le verre plat
Le recyclage du verre creux est plutôt bon. Il n’en est pas de même pour le verre plat et la laine de verre qui sont des déchets issus du BTP. La modernisation d’une ligne de production de verre feuilleté à Aniche dans le Nord a permis l’expérience d’une production bas carbone.
Dans le cas général, après la fusion, le verre fondu passe sur un bain d’étain fondu selon le procédé float, et se refroidit de 1100°C à 600°C. Après refroidissement les plaques sont découpées puis après stockage passent dans une ligne où elles sont lavées puis chauffées en salle blanche dans une machine hermétique où elles sont collées deux par deux avec une couche interne de polybutyral de vinyle (PBV)(i) qui améliore les performances acoustiques, d’isolation et anti-effraction des vitrages.
Une expérience en mai 2022 a constitué à produire 2000 t de verre plat zéro carbone avec une alimentation exclusive en électricité verte et biogaz et en recourant au calcin seul, évitant ainsi l’émission de 1000 t de CO2 et le recours à 2300 t de matières premières (sable et carbonates).
Cette expérience préfigure une évolution de la production du verre plat où l’introduction de calcin de verres plats doit progressivement augmenter. Le gisement en France de vitrages issus de la déconstruction ou du remplacement des fenêtres est de 200 000 t et seulement 5% sont utilisés. Cela tient aux difficultés de collectes lors des chantiers et de la qualité nécessaire à obtenir un calcin avec moins de 0,5% d’impuretés.
Il en est de même pour la laine de verre (5). Seule une usine à Orange pour l’instant collecte et recycle les panneaux et rouleaux fibreux qui souvent trainent sur les chantiers de déconstruction ou de rénovation avant d’être enfouis. Seules moins de 1000 t sont recyclées après tris et dissolution du polymère d’imprégnation sur un gisement national estimé 120 000 t. Ici encore la constitution d’un réseau regroupant les sociétés du BTP et les nombreuses entreprises artisanales de la construction parait nécessaire.
Ne soyons pas trop pessimistes ; même si les productions de verre ne sont pas encore « décarbonées », les vitrages isolants et intelligents (6) permettent d’économiser de l’énergie puisqu’ils sont 5 à 8 fois plus efficaces qu’une simple vitre et de nous préserver aussi des températures externes. De même les panneaux en laine de verre avec un coefficient de conduction de la chaleur λ très faible permettent de supprimer les passoires énergétiques et donc d’économiser des kWh et d’éviter l’émission de millions de tonnes de CO2.
Voilà des productions verrières « vertes » ?
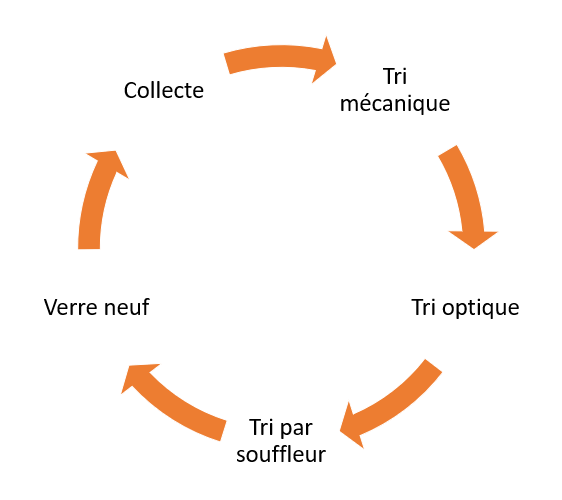
Recyclage du verre
Jean-Claude Bernier
Juillet 2022
(i) PBV : le motif répétitif de ce polymère synthétique a pour formule :
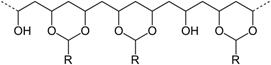 avec R = C3H7
avec R = C3H7
Pour en savoir plus
(1) La couleur des verres, de Jacques Livage, colloque Chimie et lumière (20 février 2020)
(2) Comment faire des vitrages avec du sable ? La réaction de fusion du verre, de Jean-Claude Bernier, série Une Réaction en un clin d’œil, Mediachimie.org
(3) Le CO2, matière première de la vie, in La chimie, l’énergie et le climat, collection Chimie et… junior (EDP Sciences) 2017
(4) Recyclage et valorisation des déchets, Revue Chimie Paris (2013)
(5) Isolation dans l’habitat : la chimie pour ne pas gaspiller de calories !, de Jean-Claude Bernier, in La chimie et l’habitat (EDP Sciences) 2011
(6) Vers des vitrages intelligents et connectés pour des bâtiments durables et confortables, de Stéphane Auvray, colloque Chimie et lumière (20 février 2020)
Crédits :
Recyclage du verre : DR Mediachimie.org
Molécule PVB :CC BY-SA 4.0, Lien
Illustration : Nordseher /Pixabay Lien
La médaille d’or du CNRS est l’une des plus prestigieuses distinctions scientifiques françaises. Elle est attribuée cette année au professeur Jean-Marie Tarascon, aujourd’hui professeur au collège de France, mais sa carrière s’est déroulée dans plusieurs lieux scientifiques et pas exclusivement dans l’hexagone.
Jeune diplômé de l’Ecole Nationale Supérieure de Chimie de Bordeaux il fait sa thèse au laboratoire de Chimie du solide de P. Hagenmuller avec J. Etourneau sur la synthèse et l’étude des borures de terres rares. Après sa thèse il part à l’université de Cornell aux États-Unis pour un stage post doc, mais il est repéré par la Bell Telephone Company qui l’engage dans son laboratoire de recherche où il continue à travailler sur les chalcogénures et siliciures aux propriétés supraconductrices. C’est après 1985 qu’il est rattrapé par la folie des supra YBaCuO et à la Bell, nuit et jour il enchaine les synthèses et substituants dans la pérovskite pour élever la température de transition au-delà de 91K.
C’est le tremblement de terre en Californie qui coupe le courant au labo et montre la faiblesse des batteries au plomb de secours qui l’oriente vers l’électrochimie.
Il travaille d’abord sur un spinelle qu’il connait bien LiMn2O4 qui par substitutions l’amène progressivement aux LiMnCoO4 puis au LiCoO2. Les bases cathodiques des batteries lithium–ion étaient posées et il réalise avec l’équipe de la Bell la première batterie tout plastique largement brevetée.
C’est en 1995 à la suite du décès du professeur M. Figlarz qu’à la demande de plusieurs scientifiques il revient en France à l’université d’Amiens et prend la direction du Laboratoire de réactivité et chimie du solide. Il lui donne une orientation marquée vers les matériaux pour le stockage de l’énergie. Il développe une plateforme d’essais et de tests de batteries « boutons » prototypes en mettant à profit ses connaissances cristallographiques et l’apport d’équipements de diffraction RX et de microscopie électronique avec l’association au CNRS. Très vite le laboratoire picard devient un centre d’attractivité. Il réussit dans les années 2000 à fédérer un bon nombre de laboratoires sous le nom d’ALISTORE (i), qui réunit avec des crédits européens les meilleurs laboratoires d’électrochimie en Europe, académiques et industriels. En 2010 il obtient la création du réseau français RS2E (ii) qui permet à plusieurs unités du CNRS, des universités, du CEA et des industriels de mettre en commun leurs réflexions et leurs innovations sur le plan national. Il continue les innovations et avec son complice de la première heure Mathieu Morcrette, conscient que les quantités de lithium, de cobalt ou de nickel ne sont pas éternelles, il imagine la batterie au sodium qui est bien moins couteuses et plus respectueuse des ressources naturelles. Progressivement il augmente avec son équipe sa capacité de stockage et crée la société picarde TIAMAT energy (iii) qui produit et commercialise les nouvelles batteries ion–sodium. Nommé professeur au Collège de France en 2014, il se préoccupe maintenant plus particulièrement de la fiabilité des batteries en imaginant d’y mettre des capteurs et des éléments autoréparables pour prolonger leur durée de vie et améliorer leur longévité.
Jean-Marie Tarascon avec encore son bon accent du Sud-Ouest chère aux rugbymen est non seulement un chercheur remarquable et un entraineur d’hommes et de femmes innovants, c’est aussi un bon pédagogue qui a la passion de convaincre son auditoire ; voir par exemple les conférences sur les batteries et le stockage de l’énergie (iv) au collège de France. Il sait aussi avec des mots simples expliciter la chimie à l’intérieur d’une batterie pour les jeunes lycéens.
Lors d’une dernière conférence qu’il donnait sur une vision du stockage de l’énergie pour un développement durable, il jetait un regard lucide sur le développement des batteries et leur conditions d’usage : utiliser de l’énergie renouvelable pour charger les batteries, développer des matériaux d’électrodes à plus haute capacité et avec des métaux abondants, développer des batteries plus éco-compatibles, injecter de l’intelligence artificielle dans les batteries pour autoriser une longue voire une seconde vie, lancer une politique de recyclage massive incluant des circuits courts et des procédés de récupération avec des normes strictes.
Cela ressemble furieusement à une feuille de route R&D pour le futur du stockage électrochimique.
Merci Jean-Marie !
Jean-Claude Bernier
Juillet 2022
(i) https://alistore.eu/
(ii) https://www.energie-rs2e.com/fr
(iii) http://www.tiamat-energy.com/
(iv) Sélection de conférences et cours de M. Tarascon au Collège de de France
Illustration : capture Entretien avec Jean-Marie Tarascon, Collège de France, 2015, licence CC by-nc-sa 3.0
Peut-être avez-vous été tenté, en vous croyant plus efficace, de mettre simultanément de l’eau de Javel et du détartrant dans la cuvette des WC afin de la désinfecter et de la rendre plus blanche.
Surtout ne faites pas cela ! Pour en être convaincu, découvrez la composition de ces produits et leurs rôles respectifs.
Le tartre ou calcaire
Ces deux termes sont synonymes. De formule chimique CaCO3, il s’agit du carbonate de calcium.
Le calcaire qui se dépose provient des eaux dites dures (car riches en ions calcium et magnésium mais aussi en ions bicarbonate (i)). En effet les eaux de pluie qui s’infiltrent, s’enrichissent en ions présents dans les couches géologiques traversées. Ainsi les régions calcaires vont conduire à des eaux dures dans les nappes phréatiques (ii).
La réaction de déposition du calcaire sur les canalisations et dans la cuvette des WC est la suivante :
Ca2+ + 2 HCO3- → CaCO3 (solide) + CO2 (gaz) + H2O
Le détartrant
Comme son nom l’indique il a pour rôle de retirer le tartre.
Or l’ion carbonate présent dans le calcaire est une base (composé capable de capter des ions H+ (iii) ) et le détartrant est un acide (composé capable de libérer des ions H+). Ils peuvent donc réagir l’un sur l’autre selon
CaCO3 + 2 H+aq → Ca2+ + CO2 (g) + H2O
Les bulles que vous observez sont donc des bulles de dioxyde de carbone et le dépôt de calcaire est éliminé. Le dégazage du dioxyde de carbone rend la réaction totale (iv).
L’acide présent dans un détartrant de WC varie selon les marques (v). On rencontre essentiellement des mélanges sous forme de gels ou poudres contenant de l’acide chlorhydrique, de formule HCl ou de l’acide phosphorique H3PO4 ou de l’acide sulfurique H2SO4. Sur une échelle de pH allant de 0 à 14 dans l’eau, la solution acide d’un détartrant pour WC a un pH proche de 1 ou 2 selon les produits. Le vinaigre ne convient pas (vi).
L’eau de javel
L’eau de Javel est une solution basique contenant aussi des ions hypochlorite ClO- et des ions chlorure Cl-.
La solution basique est due à de la soude ou hydroxyde de sodium NaOH dissoute dans l’eau. Ainsi l’eau de Javel a un pH voisin de 12 ou 13 selon sa concentration.
Quand vous utilisez l’eau de Javel vous recherchez à utiliser les propriétés des ions hypochlorite. En effet leur propriété essentielle est d’être un oxydant puissant ce qui a pour effet de détruire pratiquement tous les composés comme les virus, les bactéries et autres microorganismes ainsi que les produits issus de la décomposition de la matière organique. Les colorants et les odeurs disparaissent aussi.
Que se passe-t-il donc lors d’un mélange de détartrant et d’eau de Javel ?
L’acide du détartrant va consommer les ions hydroxyde de la soude présente dans l’eau de Javel selon la réaction, H+aq + OH- → H2O. Donc le pH va diminuer. Si on se retrouve en excès de détartrant le milieu devient acide et les ions hypochlorite deviennent alors instables en présence des ions chlorures.
Il se forme un dégagement de dichlore, gaz très dangereux pour la santé selon
ClO- + Cl- + 2 H+ → Cl2(g) + H2O
Alors n’hésitez pas à avertir vos connaissances et les enfants qu’il ne faut pas réaliser un tel mélange.
N’oubliez jamais de lire la notice des produits ménagers que vous utilisez. Dans le cas du détartrant il expressément écrit : « ATTENTION : Ne pas mélanger avec du chlore ou de la Javel ». Dans le cas de l’eau de Javel, l’information est la suivante : « Attention ! Ne pas utiliser en combinaison avec d'autres produits. Peut libérer des gaz dangereux (chlore) ».
La bonne marche à suivre
Dans un premier temps éliminer le calcaire en laissant agir le détartrant. Une fois le calcaire éliminé, rincer abondamment la cuvette en tirant successivement 2 à 3 chasses d’eau.
Puis ajouter de l’eau de Javel et laisser agir. Enfin, rincer abondamment.
Dans la mesure du possible aérez la pièce.
Et prenez toujours des précautions quand vous manipulez de l’eau de Javel : portez des lunettes et des gants de ménage.
Françoise Brénon et l’équipe question du mois
(i) Le bicarbonate a pour autre nom hydrogénocarbonate et pour formule chimique HCO3-. L’eau naturelle ayant un pH voisin de 6 à 7 les ions carbonate passent sous la forme hydrogénocarbonate, en raison de la stabilité de ces espèces en fonction du pH.

(ii) Les régions de France où l’eau est dure sont celles où les terres sont calcaires (Ile-de-France, Champagne crayeuse, Nord, Alpes…). Les régions où l’eau est douce c’est-à-dire qu’elles contiennent peu d’ions calcium et magnésium sont les régions de la Bretagne et du Massif Central…).
(iii) L’ion H+ est aussi appelé ion hydrogène. On le note pour simplifier H+aq, notation que l’on lit « ion hydrogène aqueux ».
(iv) Vous avez déjà rencontré cette réaction dans la question du mois : Pourquoi le champagne, le vin ou du Coca-Cola® peuvent-ils abimer le marbre ?
(v) Pour en savoir plus on peut consulter les fiches techniques des produits commerciaux en cherchant "fiche technique" + nom du produit sur un moteur de recherche.
(vi) Le vinaigre blanc contient de l’acide acétique (avec un pH voisin de 3,5) ce qui n’est pas assez efficace pour détartrer les WC. On l’utilise plutôt par exemple pour détartrer les cafetières. La composition des détartrants commerciaux tout prêts pour cafetières sont plutôt les acides citrique, lactique, sulfamique… (gamme de pH 2 à 4).
Crédits illustration : DR. Mediachimie
Le cycle des Colloques “Chimie &…” s'enrichit d'un nouvel opus :
Chimie et Matériaux Stratégiques
Mercredi 9 novembre 2022
Maison de la Chimie, 28 bis rue Saint-Dominique, 75007 Paris
Les métaux et matériaux stratégiques sont le plus souvent relativement rares ou difficilement accessibles, inégalement répartis sur la planète, mais mondialement indispensables dans des utilisations industrielles stratégiques, notamment la décarbonation de l’Énergie dans toutes ses applications industrielles et environnementales.
Les conflits géopolitiques actuels ne font qu’amplifier l’importance de ce thème, car ces matériaux sont indispensables à la vie d’un État et leur manque entraine des impacts industriels et économiques négatifs importants, liés à un approvisionnement ou à une exploitation difficile.
Dans le cadre de notre mission de formation des jeunes et d’information des citoyens, il nous est apparu important de faire un point scientifique objectif sur les différentes facettes de ce thème transdisciplinaire au cœur de l’actualité, dans lequel la chimie joue et jouera un rôle important. Les conférenciers ont été choisis parmi les meilleurs experts de la recherche, de l’industrie, de la politique et de l’économie, dans les différents domaines concernés.
Ce colloque est ouvert sur inscription à un large public avec une attention particulière aux jeunes et à leurs enseignants. Pour que ce colloque puisse être accessible au plus grand nombre, il sera diffusé en direct sur la chaine YouTube de Mediachimie. Le niveau se veut accessible à tous pour permettre un large débat.
Danièle OLIVIER | Vice-Présidente de la Fondation internationale de la Maison de la Chimie
Voir le direct sur Mediachimie ou sur Youtube.
Inscription gratuite et obligatoire : INSCRIPTIONS
Depuis plusieurs semaines on entend parler de la crise du gaz, le conflit avec la Russie mettant les nations européennes dans une situation énergétique délicate du fait d’une dépendance non maîtrisée aux importations du gaz russe. Il s’agit bien évidemment du méthane CH4 (1) utilisé comme combustible et aussi matière première pour l’industrie chimique. Il y a un autre gaz dont on parle peu mais qui est tout aussi indispensable, non dans le domaine de l’énergie, mais dans celui de la santé, de la soudure, de l’électronique, de la recherche et de la défense, c’est l’hélium.
Un gaz rare très curieux
L’hélium (symbole He) de numéro atomique 2 et de masse molaire 4 g/mol est un gaz plus léger que l’air (0,138 g/L), très bon conducteur de la chaleur. Il a une température de liquéfaction très basse – 269°C (4K). C’est, après l’hydrogène, l’élément le plus répandu dans la croute terrestre provenant des particules α (He2+) issues de la désintégration d’éléments radioactifs (2). L’hélium liquide est incolore et subit un changement de phase à son point lambda à – 271°C où il devient « superfluide » c’est-à-dire qu’il n’a pas de viscosité mesurable, qu’il passe à travers des capillaires quasi nanométriques et rampe le long des surfaces. 1000 fois plus conducteur thermique que le cuivre, ses propriétés sont expliquées en le classant comme un fluide quantique. Curiosité de laboratoire, il est très utile pour l’exploration du domaine proche du zéro absolu, des propriétés des « atomes froids » et bientôt des nouveaux calculateurs quantiques.
Un gaz industriel
L’hélium est un sous-produit de l’extraction du gaz naturel qui peut en contenir de 0,3% à 7%. C’est en 1927 que l’un des premiers gisements d’Hugoton Basin fut exploité aux États-Unis. D’autres réserves gazières naturelles comme celui du CO2 dans le Wyoming sont exploités depuis 1986.
Toute une série d’opérations est effectuée pour obtenir un gaz pur. On le débarrasse d’abord des impuretés comme l’eau, le mercure et le sulfure d’hydrogène (H2S) par adsorption sur du charbon actif puis on sépare le méthane par cryogénie. On refroidit ensuite à – 196°C pour éliminer l’azote et les restes de méthane. Enfin on brûle le gaz avec de l’oxygène sur catalyseur pour éliminer l’hydrogène (3). Enfin on brûle l’hydrogène restant en présence de l’hélium avec de l’oxygène sur catalyseur (4).
Une dernière purification donne un gaz hélium pur à 99,99% qui peut être stocké.
Les États-Unis sont les principaux producteurs, viennent ensuite le Qatar, l’Algérie, l’Australie, la Russie et la Pologne. La production mondiale est de l’ordre de 160 millions de m3 dont 50% aux États-Unis.
La saga de la production d’hélium est assez intéressante. Dans les années 1970 les États-Unis sont en situation de quasi-monopole. Le gouvernement fédéral a financé avec un partenariat privé un pipe-line de 600 km reliant les installations de production aux cavités de stockage texanes. Les volumes extraits de l’ordre de 4000 tonnes sont multipliés par 5 pour atteindre 20 000 t en 1970. Le gouvernement juge que les stocks sont suffisamment importants et la production diminue largement.
Le processus est accéléré avec la fin de la guerre froide dans les années 90 et compte tenu de la dette des sociétés fédérales de maintenance des infrastructures et de stockage, la loi de privatisation de l’hélium en 1996 précipite l’écoulement du milliard de m3 stockés mais fait baisser les prix qui n’encouragent pas les nouveaux investissements US. La forte demande internationale qui s’accélère pour l’électronique et la fibre optique en Europe et en Asie va multiplier le prix au m3 qui passe de 2 $ à plus de 6 $, l’hélium devenant un produit critique. La production va alors s’internationaliser d’abord en Algérie où une alliance Air Products – Air liquide – Sonatrach va mieux exploiter l’extraction à partir des ressources gazières. Puis c’est le Qatar, avec les entreprises allemande Linde et française Air liquide, qui voit sa production sera multipliée par trois. Le tableau indique la production mondiale internationalisée actuelle maintenant en millions de m3 :
| pays | US | Qatar | Algérie | Russie | Australie | Pologne |
| M m3 | 83 | 51 | 14 | 5 | 4 | 1 |
Un gaz très utile
Sa faible température d’ébullition (4K) le fait abondamment utiliser en cryogénie. Les bobines des aimants en NbTi (nobium, titane) ou NbSn (nobium, étain) des supraconducteurs des IRM en contiennent chacun plusieurs dizaines de litres, le grand collisionneur de Hadrons (LHC, Large Hadron Collider) du CERN en contient 120 t et les bobines des aimants du projet ITER en contiendront des milliers de litres (5); dans nos laboratoires les spectromètres RMN sont également refroidis à l’hélium liquide (6).
Gaz inerte et ininflammable il est utilisé pour purger les réservoirs d’hydrogène liquide et aussi pour pressuriser les réservoirs d’oxygène liquide utilisé comme propergol (7) pour les moteurs Vulcain des fusées Ariane. La NASA pour sa part utilise plusieurs millions de m3 par an. Son inertie le fait utiliser dans la soudure à l’arc pour l’inox, le cuivre et l’aluminium ; il protège les métaux de l’oxydation et il est moins couteux que l’argon. Il protège sous pression le tirage des monocristaux de silicium ou germanium et celui des fibres optiques. Plus léger que l’air il sert à gonfler les ballons et dirigeables, à la place de l’hydrogène ; rien que pour les ballons sondes la météo en utilise près de 4 millions de m3 annuellement.
Du fait de sa moindre solubilité dans les solutions aqueuses et notamment dans le sang il remplace l’azote dans les bouteilles servant à la respiration des plongeurs et évite ainsi les embolies gazeuses par dégagement d’azote dans les artères lors de la décompression.
Bien plus fluide que l’air il est utilisé dans les disques durs scellés des serveurs du « cloud » : on peut ainsi empiler plus de disques durs et l’hélium favorise la vitesse de lecture des données. Il peut les garder en température à 4 ou 5°C améliorant leur longévité.
Enfin il permet de faire la fête : on gonfle facilement les ballons multicolores (8) des anniversaires et en inspirant l’hélium à la place de l’air sa faible densité change la voix vers les aigus pour amuser l’assistance.
Plus sérieusement, l’Europe avait déclaré en 1994 l’hélium produit critique et stratégique compte tenu de sa production géographiquement centrée et de son utilisation indispensable pour certaines industries. En 2020 sa criticité a été annulée. En France il y a une capacité faible de production au Blanc-Mesnil et une société 48-Energy a déposé un permis de recherche dans la Nièvre.
Jean-Claude Bernier
Juin 2022
Pour en savoir plus
(1) Le biogaz, une énergie d’avenir ? de Jean-Claude Bernier, éditorial Mediachimie.org
(2) Les réactions nucléaires dans les étoiles, par Lucien Ransinangue, dossier pédagogique Nathan / Mediachimie.org
(3) Gaz de schistes : pour aujourd’hui ou pour demain ? de Julien Lefebvre, Noël Baffier et Jean-Claude Bernier, une fiche Chimie et…en fiches, cycle 4, Mediachimie.org
(4) Zoom sur les derniers résultats de la production d’hydrogène « décarboné » de Jean-Pierre Foulon et Françoise Brénon, Zoom sur…, Mediachimie.org
(5) Quelle échéance dans la disponibilité pour l’option « fusion de l’hydrogène » ?, de Bernard Bigot, Colloque Chimie et énergies nouvelles (10 février 2021)
(6) La résonance magnétique nucléaire au service de la biologie structurale, de Nicolas Birlirakis et al., L’Actualité Chimique n°353-354 (juin-juillet-août 2011) p. 100-109
(7) La propulsion des fusées et des futurs avions chez Air Liquide, de Pierre Crespi, Colloque Chimie, aéronautique et espace (8 novembre 2017)
(8) Pourquoi mon ballon s’envole ? Question du mois, Mediachimie.org
La corrosion présente un enjeu économique considérable, avec un coût de l’ordre de 3 % du produit intérieur brut mondial ; on peut dire que la corrosion coûte 1 euro par jour à chaque Français ! Des organisations internationales s’occupent exclusivement de ce phénomène : signalons le CEFRACOR pour la France. Le CEBELCOR en Belgique a été dirigé pendant longtemps par Marcel Pourbaix, le père des diagrammes potentiel-pH bien connus ! […]
Accédez au Zoom sur Quelques aspects de la corrosion des ouvrages d'art
Bernard Bigot, directeur général du programme ITER, est décédé la semaine dernière. Les milliers de chercheurs, d’ingénieurs, d’ouvriers des centaines d’entreprises qui travaillaient sur ce projet mondial « le réacteur thermonucléaire expérimental international » de Saint-Paul-lez-Durance sont bouleversés. Bernard Bigot avait pris la direction d’ITER en 2015 alors en pleine crise existentielle et en avait relevé le défi en lui donnant un nouvel élan.
Mais Bernard n’était pas qu’un super manager, c’était aussi un vrai chimiste, élève de l’École Normale Supérieure de Saint-Cloud et agrégé de sciences physiques option chimie. Il prépare une thèse en chimie théorique à l’Université d’Orsay dans l’équipe brillante dirigée par Lionel Salem au milieu des années 70. Docteur d’État ès sciences physiques, c’est en 1985 qu’il participe à la création de l’École normale supérieure de Lyon où il occupera diverses fonctions de directeur des études (1986-1993) tout en dirigeant un laboratoire de recherche en chimie théorique. Lyon et l’École Normale Supérieure resteront toujours privilégiés dans son cœur. On se rappelle avec quelle fierté et amour il conduisait un soir d’été en 1998 une délégation scientifique venue de Chine sur les hauteurs de Fourvière.
Hélas pour Lyon ses qualités le font remarquer à Paris et il est nommé en 1993 au Ministère de l’Enseignement supérieur et de la recherche à la Mission scientifique et technique (MST) puis directeur général de la recherche et de la technologie (DGRST) jusqu’en 1997. Il montre là sa vision de la recherche internationale et active l’évolution des équipements et des laboratoires des grands organismes de recherche pour faire face à la concurrence internationale. C’est lui qui impulse notamment la dotation en spectromètres de RMN à haut champ en biochimie, à Grenoble et Gif-sur-Yvette, équipements dont la France était sous-dotée. Il montre aussi sa puissance étonnante de travail. Il n’était pas rare de le rencontrer lors d’une réunion à 22 h rue Descartes et d’en trouver ses conclusions dans la boite mail à 7 h du matin.
En 1998 il accepte la direction de l’Institut de recherche sur la catalyse du CNRS à Lyon où il avait déjà plusieurs années auparavant encouragé l’implantation d’une équipe de théoriciens brillants, puis en 2000 la direction de l’ENS de Lyon qui lui était restée chère. Il y montre encore là ses capacités d’organisation aidé par un travail remarquable des enseignants et aussi sa préoccupation constante d’attirer vers la science les jeunes collégiens et lycéens en favorisant les contacts des chercheurs avec les lycées et collèges.
Il doit à nouveau quitter Lyon en 2002 comme directeur du cabinet du ministre Claudie Haigneré jusqu’en 2003, date où il est nommé Haut-commissaire à l’énergie atomique puis en 2009 administrateur général du Commissariat à l’énergie atomique jusqu’en 2013. Sous sa direction le CEA change de nom en y ajoutant à l’énergie nucléaire les énergies alternatives. Il y imprime sa marque en mettant l’accent sur la chimie nucléaire, les procédés bas carbone et les futures bases de l’énergie nucléaire. Cette préoccupation de l’énergie future va le conduire à prendre en 2015 la direction générale du projet international de « fusion nucléaire » alors en plein doute. Comment gérer et animer cette entreprise de coopération internationale sans équivalent au monde. Dans les conseils siège l’Europe mais aussi la Chine, l’Inde, le Japon, la Corée, la fédération de Russie, le Japon et les Ėtats-Unis. Il réforme les processus de décisions, les chaines de fabrication, le management. Sept ans après, plus de 75% du génie civil est réalisé et en ordre de marche. Des pièces de très haute technologie acheminées par voie maritime ou terrestre venant des partenaires du bout du monde sont montées en Provence. Il fallait voir son enthousiasme lorsque dernièrement les super aimants de plusieurs centaines de tonnes avaient rejoint leur logement au 1/10 de mm près. Il avançait avec optimisme sûr que le premier plasma serait produit en 2025 !
Pour nous à la Maison de la chimie il a accepté en 2006 d’être président du conseil d’administration de la Fondation (internationale). C’est sous son impulsion que se sont développées les actions en direction des jeunes et du grand public visant à mieux faire connaître la chimie. Citons les colloques « Chimie et … » qui ont connu à presque chaque fois (hors pandémie) plus de 1000 à 1200 participants dont 1/3 de lycéens et dont il a présidé le 18e « Chimie et Notre-Dame » en février dernier.
Citons aussi le site « Mediachimie.org » qui contient plus de 1800 références sur la chimie à destination des professeurs de lycées et de collèges mais aussi des élèves, des étudiants et de tout public s’intéressant à la science et à la chimie. C’est avec l’approbation de Bernard Bigot que des coopérations avec Nathan et la Fondation La main à la pâte, création de l’Académie des sciences, ont été réalisées élargissant le champ visé à un nombre encore plus grand d’internautes et d’élèves.
Oui nous sommes tristes, nous avons perdu un collègue chimiste, un professeur, un président internationalement respecté, un entraineur d’hommes et de femmes, mettant toute son énergie au service de la nation et à œuvrer pour un monde meilleur en participant activement au sein d’ITER, à la réalisation d’une source d’énergie propre et inépuisable telle que la fusion nucléaire comparable à celle qui alimente le Soleil et les étoiles.
Sa grande préoccupation des générations futures nous a tous poussé à diffuser largement la science et la technique, nous lui devons tous de nous avoir entrainés dans cette belle aventure collective… Merci Bernard.
Nos pensées vont à sa famille et les équipes de Mediachimie s’associent à leur profond chagrin.
Mai 2022
les équipes de Mediachimie.org
Voir aussi la page d'hommage à Bernard Bigot sur le site de la Fondation de la Maison de la chimie
Crédit photo : ITER Organisation iter.org.
Le comité de pilotage de Mediachimie et les membres des équipes pédagogiques ont la tristesse de vous faire part du décès, le 14 mai 2022, de Bernard Bigot, Président de la Fondation de la Maison de la Chimie et Directeur Géneral de ITER international.
Bernard Bigot a soutenu Mediachimie, depuis sa création en 2012, comme un programme prioritaire des actions de la Fondation de la Maison de la Chimie.
Mediachimie présente ses condoléances à sa famille.
Adresse email dédiée aux messages de condoléances à l'attention de la famille : hommage.bernard.bigot@maisondelachimie.com





















