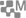Les entreprises de la chimie et des sciences de la nature et de la vie emploient plus de 200 000 chimistes et il y en a environ 300 000 autres dans diverses industries allant de l’automobile à la pharmacie en passant par les cosmétiques et la métallurgie. C’est dire que plus de 20 000 embauches de chimistes par an sont nécessaires pour les entreprises industrielles. De plus en plus, ce sont les techniciens, agents de maîtrises et ingénieurs ou cadres qui représentent près des 2/3 des embauches. D’où l’importance pour les jeunes et leurs parents de découvrir et être informés sur ces métiers et carrières scientifiques au :
Village de la chimie et des sciences de la nature et de la vie
Les 24 et 25 février 2017 au Parc Floral de Vincennes
http://www.villagedelachimie.org
L’édition 2017 du village de la chimie et des sciences de la nature et de la vie est particulièrement riche cette année ; elle met à disposition des jeunes, de leurs professeurs et de leurs parents :
- Un pôle « entreprises » où une cinquantaine d’entreprises industrielles et établissements présentent leur activité et leurs besoins en compétences de chimistes, avec des salariés qui parleront de leurs métiers.
- Un pôle « orientation » avec la présence de l’ONISEP, de l’observatoire de la branche chimie et de Mediachimie.org, première médiathèque sur la chimie, ses innovations et ses métiers, balisant les métiers de l’opérateur à l’ingénieur en passant par le commercial.
- Un pôle « formation » où seront présents une trentaine d’établissements de formation aux métiers de chimistes situés en Ile-de-France. Toutes les informations sur les parcours conduisant aux métiers de la Chimie et des sciences de la nature et de la vie seront disponibles ; CAP, BEP, Bac Pro, Bac Techno, BTS, DUT, Licences pro, écoles d’ingénieurs, sans oublier l’apprentissage, avec des interlocuteurs performants.
- Un pôle « insertion professionnelle » disposant de stands où des ingénieurs et des responsables des ressources humaines vous conseilleront sur l’écriture des CV et pourront vous préparer à un entretien d’embauche.
- Enfin des stands de démonstration et d’expériences en « live » pour montrer l’apport de la chimie à votre vie quotidienne.
Venir les 24 et 25 février à Vincennes, c’est découvrir les métiers et les formations. C’est s’orienter en écoutant les témoignages des professionnels et voir les secteurs d’activité qui embauchent. C’est s’insérer dans la vie professionnelle en rédigeant un beau CV et en connaissant les fautes à ne pas faire lors d’un entretien d’embauche. C’est aussi trouver la possibilité de votre stage ou futur emploi.
Tout un cycle de conférences le 24 et le 25 février vous ouvrira de nouveaux horizons sur la chimie dans la police scientifique, sur les parcours de chimistes expérimentés, sur le biomimétisme… Le 25 février, en complément aux conférences, une table ronde sur les Métiers et Filières de Formation et quatre ateliers vous permettront d’échanger sur ce qu’attendent les recruteurs, le métier de chercheur, l’entretien d’embauche, la création d’entreprise.
Vous avez la possibilité au village de la chimie et des sciences de la nature et de la vie, le 24 et 25 février de choisir votre voie pour connaître et réussir une vie professionnelle intéressante et connaître les évolutions des métiers du futur, ne laissez pas passer votre chance !
Jean-Claude Bernier
Février 2017
Alors c’est fait ! Armel le Cléac’h, skipper de Banque Populaire VIII, après sa 2e place en 2013 remporte la version 2016-2017 du Vendée Globe. Après 74 jours de mer et 45 000 km en milieu marin (1), il pulvérise le record de François Gabart, le premier à être descendu en dessous des 80 jours (78 jours).
Sur les 29 monocoques qui ont pris le départ le 6 novembre 2016, 7 étaient de la nouvelle génération, pourvus de « foils », ces appendices en forme de moustaches qui dépassent du haut de la coque quand ils sont relevés. Six de ces bateaux de la classe 60 pieds IMOCA ont été conçu par le cabinet d’architecture navale de G. Verdier en collaboration avec le cabinet VPLP. Sur le papier ces monocoques se ressemblaient beaucoup : mêmes tailles, mâts à peu près de même hauteur, coque et quille standardisées grâce à la chimie des composites et à la maîtrise des alliages métalliques. Seul le poids de l’ordre de 3 tonnes pouvait différencier ces coursiers de la mer :
- la coque est presque entièrement en matériau composite carbone, obtenu par moulage de couches de fibres de carbone pré-imprégnées de polyester (2) (3) ;
- la quille comporte à sa base un bulbe de forme aérodynamique en métal lourd, relié à la coque par un voile de quille de plusieurs mètres en acier ou en titane forgé en lame de couteau en tôle ployée ou soudée (4) ou encore en fibres de carbone (5) ;
- les voiles sont tissées en fibres artificielles comme le Kevlar (6) ou le polyéthylène téréphtalate (PET) ou même encore en fibres de carbone, tissées sur mesure en fonction de la modélisation des forces appliquées sur le mât (7).
Mais ce qui fait l’originalité de cette nouvelle génération ce sont les « foils »qui de part et d’autre de la coque remplacent la dérive. Leur forme donne un appui latéral et avec la vitesse, ils déjaugent le navire. Une fois acquise une vitesse de 13 à 17 noeuds, le foil accroche et toute augmentation de la vitesse du vent se traduit en vitesse pure. Leur action soulage la coque qui se lève doucement pour réduire la trainée et surtout diminue la gîte afin de porter plus de voile et d’augmenter la vitesse.
Les foils, après modélisation et essais, ont été fabriqués par une entreprise bretonne du Morbihan. Ils sont en fibres de carbone entremêlées en 3D, technique dérivée de l’aéronautique et de la fabrication des aubes des réacteurs, conçues pour éviter le délaminage du composite lors d’une collision avec un oiseau. Dans le cas des foils, il n’y a pas de garantie de casse en cas de collision en pleine vitesse avec un cétacé ou un « ofni » (objet flottant non identifié). C’est la prise de risque de ces navigateurs aventuriers qui ne cessent de faire avancer la technologie marine.
Jean-Claude Bernier
Janvier 2017
Quelques ressources pour en savoir plus :
(1) Les grandes questions en sciences chimiques de l’environnement marin
(2) Les matériaux composites dans le sport
(3) Les polymères ce qu’il faut savoir (vidéo, 4:25)
(4) Chimie et construction navale
(5) Les composites carbone/carbone
(6) La grande aventure des polyamides
(7) Le textile, un matériau multifonctionnel
Nous avons vu en décembre que le champagne contenait du gaz carbonique sous pression qui ne demandait qu’à se libérer sous forme de bulles qui remontent doucement à la surface du vin et participent à l’effervescence joyeuse, synonyme de fête. Le verre dans lequel on boit le champagne doit répondre par son élégance à l’image de prestige de ce breuvage mais aussi permettre d’en apprécier toutes les qualités.
Éviter le métal
Il existe pour boire le champagne des récipients en métal précieux, argent ou métal doré, mais ils ne conviennent pas car on ne peut ni observer la couleur du vin, ni la finesse du dégagement des bulles.
Les arômes tant appréciés
Les analyses ont montré que l’éclatement des bulles de gaz carbonique jouait un rôle majeur dans la libération des arômes. Ceux-ci sont des molécules organiques amphiphiles qui comportent soit une partie hydrophile qui les font rester majoritairement dans le vin, soit une partie hydrophobe qui les fixe de préférence à l’interface gaz–liquide de la bulle. Les analyses par IR-FT et SM (1) des aérosols de surface, comparées aux analyses du liquide in situ, ont montré des concentrations plus élevées d’acides gras ou de dérivés estérifiés tels que l’acide palmitoléique (2), l’acide tétradécanoïque (3) et d’autres, qui apportent les notes métalliques, fruitées, herbacées… Ces concentrations organoleptiques participent au plaisir olfactif puis gustatif du champagne.
D’où l’attention particulière à porter sur la nature du verre et à son nettoyage qui ont une grande influence sur la formation et la persistance des bulles qui sont de vrais ascenseurs à arômes.
Flûte ou coupe ?
La forme du verre à champagne doit être fonctionnelle. Les verres à fond rond ou les verres à fond pointu ne dégagent ni les mêmes mousses ni les mêmes lignes de bulles.
La flûte à champagne par sa hauteur de la colonne de liquide permet le bel examen visuel du vin et à la condition d’y laisser quelques microfibres, d’admirer la formation progressive de fines bulles. Si la flûte est suffisamment ouverte, le dégustateur peut y approcher le nez et goûter tous les arômes qui se dégagent de l’aérosol.
La coupe à champagne plus populaire dans les pays du sud est pourtant indéfendable. La mousse s’y forme mal et le bouquet se disperse. On y boit avec le nez qui trempe dans le breuvage et la surface liquide–air y est trop vaste, l’effervescence se calme trop vite.
C’est maintenant le verre « tulipe » à forme d’œuf tronqué sur une jambe pleine allongée qui a la côte. Il permet de jouir d’une mousse réduite et de la montée des fines bulles tout en permettant de respirer les arômes qui se dégagent en surface.
Fuyez la coupe ou flûte en plastique !
Faut-il rappeler le scandale qui est de boire le champagne dans une coupe en plastique ! Le PET (4) a une énergie de surface bien plus faible que celle du verre, la tension de surface liquide/solide y est très différente et sa surface est classée comme hydrophobe. Le liquide n’a pas tendance à s’y accrocher et ce sont les bulles qui le remplacent et grossissent sur les parois en cachant malheureusement la douce ascension des fines bulles.
Pour votre plaisir olfactif ou gustatif, choisissez bien votre matériel, mais dans tous les cas ne l’utilisez qu’avec modération !
Jean-Claude Bernier
(1) IR-FT : analyse par infrarouge à transformée de Fourier ; SM : spectrométrie de masse
(2) acide palmitoléïque acide (Z)-hexadéc-9-énoïque : CH3 –(CH2)5-CH=CH-(CH2)7-COOH
(3) acide tétradécanoïque CH3–(CH2)12–COOH
(4) PET : poly(éthylène-téréphtalate) polymère de motif répétitif -[O-(CH2)2-O-CO-paraPh-CO]n-
Si vous avez regardé la carte d’épidémiologie fin 2016 et début 2017 vous avez sûrement constaté que « le rouge est mis » pour les épidémies saisonnières : rhumes, grippes, etc. Heureusement la chimie et même la phytochimie sont là pour vous soulager (ou essayer).
Contre la fièvre vous auriez pu comme nos lointains ancêtres sucer de l’écorce de saule connue pour ses propriétés fébrifuges depuis l’antiquité (1). Ce n’est cependant qu’en 1838 qu’un chimiste, Piria, du laboratoire de Jean-Baptiste Dumas en a extrait l’acide salicylique (2) et il fallut attendre 1853 pour que Charles Gerhardt fasse la synthèse chimique de son dérivé acétylé moins agressif pour l’estomac. La société Bayer mis au point la synthèse industrielle et pris un brevet en 1899 sous le nom « aspirin ». C’est sous ce nom qu’est commercialisé le médicament fabriqué aussi en France par la société chimique des usines du Rhône à partir de 1910 (3). On en consomme environ encore 40 000 t en France. Son action antalgique, anti-inflammatoire et antipyrétique en a fait sous différentes marques le top des antigrippaux. Son action d’anti-agrégat des plaquettes du sang a conduit à rechercher un substitut qui est le paracétamol (4). Celui-ci a été découvert un peu par hasard par deux médecins strasbourgeois qui s’intéressaient à la parasitose intestinale et qui s’étaient fait livrer par erreur de l’acétanilide à la place du naphtalène. C’est le dérivé hydroxylé NHCOCH3 – φ – OH qui révéla des activités antipyrétiques sans action sur l’agrégation plaquétaire encore appelé acétaminophène. Le paracétamol fut largement produit et commercialisé après 1950. Avec peu de réactions secondaires sauf surdosage, il s’en consomme 260 millions de doses en France.
La chimie a aussi d’autres molécules (5) à son arc : la pseudoéphédrine comme vasoconstricteur local pour le nez, l’ibuprofène pour les douleurs musculaires, les extraits de dérivés terpéniques (6), mais leur efficacité reste à démontrer (7).
In fine, en cas d’attaque virale, à part les deux antalgiques et les pulvérisations de sérum physiologique proche de l’eau de mer (8) riche en chlorure de sodium pour dégager le nez, il faut faire preuve de patience : « un rhume non traité dure une semaine, un rhume traité dure sept jours ».
Jean-Claude Bernier
janvier 2017
Quelques ressources pour en savoir plus :
(1) Du saule à l’aspirine
(2) L’aspirine, une origine végétale
(3) Aspirine (produit du jour de la SCF)
(4) Paracétamol (produit du jour SCF)
(5) De la conception du médicament à son développement : l’indispensable chimie
(6) La nature au labo : la phytochimie (vidéo 9:08)
(7) La neuropharmacologie : un triomphe dans l’exploration du cerveau, un échec à dépasser dans la création de thérapeutiques innovantes
(8) La nature pour inspirer le chimiste : substances naturelles, phytochimie et chimie médicinale
Le champagne est une boisson alcoolisée effervescente, elle est faite à partir de jus de raisins sucré. Sous l’influence de levures qui sont des champignons microscopiques, le sucre se transforme en alcool avec formation de dioxyde de carbone et dégagement de chaleur. Après assemblage de vins « tranquilles » on fait la dernière fermentation à l’intérieur même de la bouteille. Après diverses opérations qui se terminent par la fermeture avec le fameux bouchon en forme de champignon, c’est la bouteille de champagne classique que nous connaissons et qui va être stockée 2 à 4 ans dans des caves immenses.
Réaction de transformation du sucre en présence des levures :
C6H12O6 → 2 C2H5OH +2 CO2 + Q (chaleur)
Pourquoi les bulles apparaissent-elles dans le verre ?
Dans la bouteille, le dioxyde de carbone se trouve en partie dissous dans le vin et en partie à l’état gazeux. Un équilibre s’établit et la pression du gaz est alors proportionnelle à la concentration en gaz dissous. Ainsi pour une pression de 5 à 6 bars, il y a environ 12 grammes de CO2 dissous, ce qui représente environ 6 litres susceptibles de s’échapper à l’état gazeux à pression et température normales.
Ainsi, quand on ouvre la bouteille, la pression diminue brutalement à 1 bar. Les 6 litres de CO2 dissous veulent s’échapper : c’est ce qui produit le bruit du bouchon qui saute et l’effervescence du vin. Quand on le verse dans le verre, les bulles de gaz carbonique naissent et montent dans le champagne.
Naissance des bulles
Le processus de formation des bulles qui contribuent au plaisir de ce vin de fête est intéressant. On estime qu’il y a par bouteille un potentiel de 11 millions de bulles ! Il y a nucléation, c’est-à-dire naissance d’une petite bulle microscopique, autour d’une petite poche d’air ou d’une microfibre. Elle grossit de quelques microns (millième de mm) à un millimètre et monte vers la surface à la vitesse de 15 cm par seconde. On recommande de servir le champagne à 7/8°C dans des verres assez hauts (des flûtes) qui ne viennent pas directement du lave-vaisselle mais qui ont été préalablement essuyés avec un torchon textile pour y laisser quelques fibres. Ces fibres serviront de germes pour la nucléation et permettront un dégagement harmonieux des bulles.
J’entends déjà les critiques qui disent que ces dégagements de gaz carbonique vont nuire au changement climatique !! Rassurons-nous ; chaque année 330 millions de bouteilles contenant chacune 12 g de CO2 sont ouvertes de par le monde. Au total cela représente le dégagement d’environ 3600 tonnes de CO2. Devant les émissions totales mondiales de 39 milliards de tonnes, ce n’est même pas le dix millionième de cette quantité !
Mais que cela ne vous empêche pas de boire le champagne avec modération !
Jean-Claude Bernier
Remarque : le dioxyde de carbone est aussi appelé gaz carbonique et a pour formule chimique CO2.
Prochaine question du mois : Dans quel verre faut-il boire le champagne ? (s’il en reste !)
Un nouvel épisode de pollution a frappé les grandes villes comme Paris, Lyon ou Grenoble la seconde semaine de décembre. Lorsque la capitale suffoque, c’est toute la province qui s’enrhume ! C’est la persistance d’un anticyclone centré sur la France et de faibles vents d’est qui ont entrainé ces pics de pollution. Ils ont été caractérisés par des concentrations en particules fines PM10 (≤ 10 μm) mais surtout PM2,5 (≤2,5 μm) parfois 10 fois au-dessus du seuil d’alerte et donc très nocives pour les voies respiratoires (1).
D’après un rapport de pneumologues la pollution aux particules fines provoquerait l’équivalent de 48 000 décès prématurés. De même, un rapport européen « Europe’s Dark Cloud » vient de dénoncer l’usage des centrales thermiques au charbon (2) qui entrainerait aussi en Europe 22 000 décès prématurés dont 2 900 en Allemagne et 4600 en Pologne. Mais ces nuages portés par les vents amèneraient aussi la pollution particulaire et en métaux lourds chez les voisins, responsable par exemple en France de 1 380 décès prématurés (3).
Les causes de ces pics de pollution sont diverses. Dans Paris, les experts estiment que c’est le trafic routier qui est responsable des 2/3 des émissions d’oxyde d’azote et de 55 % des émissions de particules fines. Autres sources : le chauffage dont les foyers ouverts (4) et l’industrie.
Des progrès ont cependant été faits depuis 10 ans ; la chimie a fait de bons efforts pour limiter la pollution automobile (5) les pots catalytiquesont progressés et les filtres de particules équipent maintenant tous les véhicules de moins de 10 ans (6). La chimie atmosphérique permet de mieux comprendre les processus de pollution (7). L’électrochimie permet d’année en année de gagner sur les possibilités de stockage en énergie des batteries des véhicules électriques. L’industrie notamment chimique a réduit de façon importante ses émissions polluantes notamment de SO2 (8).
Le gouvernement vient d’annoncer de nouvelles mesures pour lutter contre ces pollutions urbaines : des facilités d’achat pour les véhicules électriques (9), l’instauration des vignettes autorisant ou non les automobiles en ville ; malheureusement il n’a pas la maitrise de la météo. Une initiative intéressante menée par une équipe de chercheurs de l’INRIA (10) est d’inciter les habitants à être leur propre agent anti-pollution avec la mise au point d’une application sur smartphone et un site Citylab@inria qui donne l’accès à tous les citoyens aux centaines de capteurs de pollution urbains.
Jean-Claude Bernier
décembre 2016
Quelques ressources pour en savoir plus :
(1) - La qualité de l’air en question
(2) - Faudra-t-il retourner au charbon ?
(3) - Les défis de la santé et du bien-être en ville (conférence - vidéo)
(4) - Pollution et feux de cheminées
(5) - Un exemple de matériau spécifique : pots catalytiques et dépollution automobile
(6) - Améliorer les pots catalytiques (vidéo 3:00)
(7) - La chimie atmosphérique : contexte, récents développements et applications
(8) - La chimie face aux défis de la transformation du système énergétique
(9) - Stockage de l’électricité : élément clé pour le déploiement des énergies renouvelables et du véhicule électrique
(10) - Exposition individuelle et collective aux pollutions urbaines (conférence - vidéo)
La 5e édition du Chemical World Tour a pour thème les innovations qui vont dessiner le futur de l’industrie et révolutionner nos usages. Les cinq binômes ont été sélectionnés et présentés aux cinq entreprises participantes : Arkema, BASF, Bayer, Chimex et Solvay. Les tournages devront être terminés pour le 9 décembre 2016.
Lancé en 2010 par l’Union des Industries Chimiques (UIC) et la Fondation de la Maison de la Chimie, The Chemical World Tour a pour but de faire découvrir l’industrie chimique et ses innovations à des étudiants. À la suite d’une sélection, des binômes d’étudiants – l’un en chimie et l’autre en journalisme – partent tourner des reportages, avec l’aide d’une équipe de l’agence CAPA.
Pour plus de renseignements : http://www.chemicalworldtour.fr/
L'ouvrage La chimie dans les TIC (collection Chimie et ... Junior), écrit par une équipe Mediachimie composée de Constantin Agouridas, Jean-Claude Bernier, Danièle Olivier et Paul Rigny, a été retenu parmi les finalistes du 29e Prix Roberval, catégorie Jeunesse. Félicitations !
Ouvrage :
La chimie dans les TIC (Technologies de l'Information et de la Communication)
Editeur : EDP Sciences
ISBN : 978-2-7598-1675-0
Prix Roberval
Soutenu par la Délégation générale à la langue française et aux langues de France, le Conseil départemental de l'Oise, la ville de Compiègne, Sorbonne Universités, l’Université de Technologie de Compiègne (UTC), l’Agence Universitaire de la Francophonie et la Délégation Générale du Québec en France, le Prix ROBERVAL, organisé par le service des Cultures Scientifique, Technique et Industrielle de l’UTC, dirigé par Élisabeth Brunier, récompense chaque année des œuvres en langue française expliquant la technologie.
Ces œuvres récompensées sont destinées au grand public, à la jeunesse ou à l'enseignement supérieur et peuvent prendre la forme de livres ou de productions audiovisuelles.
Le prix est un hommage rendu à Gilles Personne de ROBERVAL, natif de l'Oise, génial inventeur de la balance qui porte son nom. C'est un bel exemple de technologie au service de tous.
Avez-vous fait provision de bois pour votre cheminée ? Car le Réseau de Transport de l’Électricité (RTE) vient de nous annoncer début novembre que la sécurité d’approvisionnement cet hiver 2016-2017 s’annonce délicat. Ce sont en effet 21 réacteurs nucléaires (1) qui étaient arrêtés dans l’hexagone au lieu de la dizaine habituellement stoppés pour maintenance ou rechargement de combustible (2). Dix-huit le sont à la demande de l’Autorité de la Sûreté Nucléaire (ASN) suite à la découverte d’anomalies de concentration de carbone dans les aciers (3) des parties basses des générateurs de vapeur.
Il faut d’abord dire que c’est suite à l’analyse des fonds de cuve et couvercle du réacteur EPR de Flamanville qu’ont été découvertes des ségrégations de carbone sur cet acier faiblement allié 16 MND5 (C≤0,2 % et Mn, Ni, Mo). Par la suite des contrôles sur les viroles basses des générateurs de vapeur notamment à Fessenheim, ont été aussi trouvées des concentrations supérieures de carbone sur des aciers faiblement alliés à peu près de même type. Au lieu de valeurs de l’ordre de 0,2 % des teneurs de 0,30 à 0,39 % ont été relevées au-delà de la valeur limite réglementaire de 0,32 %.
Il faut alors rappeler quelques souvenirs de métallurgie sur le diagramme Fe-C (4) et notamment les courbes TTT (Température, Temps, taux de Transformation) qui donnent les taux de ferrie, austénite et bainite liés aux valeurs de carbone stables en fonction des températures de traitement et vitesses de refroidissement. On conçoit qu’au cours du forgeage de lingots de plus de 100 tonnes les parties externes n’ont pas forcément la même courbe de refroidissement que celles du cœur. Celles-ci, plus lentes, peuvent donner lieu à transformation et donner une structure aciculaire avec peut-être de la cémentite (Fe3C) et donner une fragilité plus grande au choc mécanique ou thermique (5). Dans ces générateurs de vapeur, dans la virole basse, le choc thermique est possible car se rencontrent le circuit primaire (eau à 350°C) du réacteur et le circuit secondaire (eau 120 °C) de l’échangeur. Les tests de résilience dans ces parties basses ont donné des valeurs comprises entre 34 et 64 joules avec une moyenne de 52 J relativement satisfaisante, mais compte tenu des niveaux élevés de sécurité dans le nucléaire, des vérifications complémentaires sont en cours.
Déjà plusieurs réacteurs ont pu redémarrer ; RTE pour faire face aux pics de consommation cet hiver a plusieurs solutions : les échanges avec nos voisins grâce à l’interconnexion, les appels à l’effacement de gros consommateurs industriels, et d’autres mesures exceptionnelles pour éviter le « black-out » (6). Rassurons-nous et peut-être que l’hiver ne sera pas très rigoureux si on en croit le changement climatique (7).
Jean-Claude Bernier
novembre 2016
Quelques ressources pour en savoir plus :
(1) – La chimie et sa R et D dans l’industrie nucléaire
(2) – L’uranium (produit du jour la SCF)
(3) – Les enjeux de la chimie dans la production d’électricité
(4) – Site PhaseDiagram-Web
(5) – Chimie et construction navale
(6) – La chimie face aux défis de la transformation du système électrique
(7) – Chimie et changement climatique
Le colloque " Chimie et les Grandes Villes " a eu lieu mercredi 9 novembre 2016.
Retrouvez la captation vidéo des conférences sur le site des Actions de la Fondation de la Maison de la Chimie pour les visionner et les télécharger.
Soutenue par la Fondation de la Maison de la chimie et organisée par la Société Chimique de France, la journée "Histoires et Philosophies de la Chimie - quels apports pour son enseignement ? " aura le 18 janvier 2017 de 9h à 18h à l’ENCPB-Paris.
Pour connaître le programme et vous inscrire, suivez ce lien.
Créé par l’Union des Industries Chimiques (UIC) et la Fondation de la Maison de la Chimie, le concours The Chemical World Tour a pour but de faire découvrir l’industrie chimique et ses innovations à des étudiants. A la suite d’une sélection, 4 binômes d’étudiants – l’un en chimie et l’autre en journalisme- partent tourner des reportages, avec l’aide d’une équipe de l’agence Capa.
Cette année, le Chemical World Tour revient pour une 5ème édition Made in France consacrée à l’Industrie du Futur !
Le lancement de la sélection a eu lieu via la page Facebook de l’opération.
Cette année, le casting de type Nouvelle Star va laisser place à une sélection basée sur des candidatures vidéos et une annonce des lauréats via les réseaux sociaux.
Pour participer à la sélection et être parmi les reporters, les étudiants doivent envoyer une candidature vidéo (« Racontez-vous en 1 minute et dites-nous pourquoi vous rêvez de devenir journaliste ou chimiste ») accompagnée d’un CV et d’une fiche d’inscription dûment remplie et signée à l’adresse communication@uic.fr avant le 11 novembre 2016.
En savoir plus :
Vidéo de présentation de cette nouvelle saison
Deux annonces ont fait « la une » des journaux en octobre. La première plutôt mauvaise, la teneur en CO2 (1) de l’atmosphère avait atteint la valeur symbolique de 400 ppm (0,04%) ; la seconde plutôt bonne, un accord international signé à Kigali allait interdire l’usage des hydrofluorocarbone (HFC) comme gaz frigorigène.
Dans l’annonce sur la concentration de CO2, vous remarquerez que rien n’a été dit sur le méthane CH4 et les oxydes d’azote pourtant 20 fois et 120 fois plus actifs comme gaz à effet de serre que le CO2, sans parler des HFC 1400 fois plus actifs et dont l’utilisation croît de 10 à 15% chaque année comme fluide pour les installations industrielles et climatisations domestiques ou automobiles. L’accord de Kigali n’est finalement qu’un additif au protocole de Montréal de 1987 qui supprimait les chlorofluorocarbones (CFC), responsables du trou d’ozone. Depuis le trou d’ozone va mieux, mais pas la planète, car on ne connaissait pas à l’époque le pouvoir radiatif d’effet de serre de ses remplaçants, les HFC. Les scientifiques n’ont hélas pas encore trouvé le magique aspirateur à gaz carbonique. Par contre, les chimistes ont progressivement permis de comprendre le fonctionnement de la machine atmosphérique (2) et son influence sur le climat (3). Le CO2 n’est pas un polluant, car avec le rayonnement solaire et l’eau par photosynthèse il permet la croissance des plantes et la transformation de C et H en sucres. En se basant sur ce schéma naturel, le CO2 est une source de nouvelles molécules (4). C’est une nouvelle chimie qui se développe (5) ; avec des progrès sur la séparation, la purification et la catalyse, ces nouveaux défis énergétiques et industriels peuvent être vaincus (6). Ce n’est pas la seule contribution de la chimie à l’abaissement de la concentration en gaz à effet de serre et à l’assainissement de l’atmosphère, ne serait-ce que pour les oxydes d’azote (7) et sur la qualité de l’air à l’intérieur des maisons, parfois plus pollué qu’à l’extérieur (8). Après l’accord de Kigali, il faudra encore progresser dans la recherche de fluides frigorigènes, l’isobutane, l’ammoniac, les polyolesters et même le CO2, pour que leur utilisation ne rencontre pas les mêmes inconvénients et dangers que lors du remplacement des CFC.
Jean-Claude Bernier
novembre 2016
Quelques ressources pour en savoir plus :
(1) Le dioxyde de carbone (produit du jour de la SCF)
(2) La chimie atmosphérique : contexte, récents développements et applications
(3) Chimie atmosphérique et climat
(4) Que faire du CO2 ? De la chimie !
(5) Le dioxyde de carbone, la molécule-clé de la chimie du développement durable
(6) Le dioxyde de carbone : enjeux énergétiques et industriels
(7) La catalyse au service de l’automobile
(8) La qualité de l’air intérieur : enjeu de santé publique
Le salon Mondial de l’Automobile vient de se terminer à Paris. Il a marqué un tournant dans l’industrie automobile qui retrouve ses couleurs après quelques années noires. Les tendances et nouveautés qui ont illustré cette édition 2016 sont :
- l’innovation dans les véhicules électriques (1) qui gagnent en autonomie grâce aux progrès sur le stockage électrique ;
- le désamour pour les véhicules Diesel atteints par le « VWgate » et la difficulté pour les constructeurs de satisfaire les normes Euro 6 ;
- les préoccupations de plus en plus fortes des habitants des grandes villes qu’illustre la maire de Paris agissant pour limiter la pollution atmosphérique ;
- enfin la percée encore timide de l’automobile autonome et connectée.
Sur tous ces points l’innovation et les avancées ne seraient pas possibles sans la chimie. Les véhicules électriques ont atteint une maturité industrielle et une crédibilité commerciale grâce à l’allègement des structures (2) et une autonomie convenable grâce au stockage électrochimique et les nouvelles batteries (3). Si les véhicules Diesel veulent devenir « propres » et satisfaire d’ici quelques années aux normes drastiques d’émissions (4), ils en seront redevables aux chimistes catalystes qui développeront les nouveaux catalyseurs, filtres et systèmes de dépollution éliminant les particules et les oxydes d’azote (5) (6). Si demain vous conduirez votre auto avec votre smartphone, ce sera grâce à la miniaturisation des circuits électroniques et à la photogravure où la chimie est omniprésente (7) (8). L’air des villes que nous respirons est le résultat d’une chimie atmosphérique complexe (9) où les composés organiques volatiles, le CO2, les NOx et l’ozone jouent un rôle essentiel.
L’industrie automobile n’est plus seulement mécanique, elle est de plus en plus multi-matériaux, chimique et électronique. Elle embauche surtout des cadres et ingénieurs spécialistes de ces domaines (10) (11).
Jean-Claude Bernier
octobre 2016
Quelques ressources pour en savoir plus :
(1) La voiture électrique : virage ou mirage ?
(2) Les alliages d’aluminium pour l’allègement des structures de l’aéronautique et la carrosserie automobile
(3) Stockage de l’électricité : élément clé pour le déploiement des énergies renouvelables et du véhicule électrique
(4) Ach… VW Das Auto ?
(5) La catalyse au service de l’automobile
(6) Un exemple de matériau spécifique : pots catalytiques et dépollution automobile
(7) Chimie et nanolithographie (vidéo, 8:20)
(8) Les multiples contributions de la chimie dans la conception des tablettes et des smartphones (conférence, vidéo + texte)
(9) Chimie atmosphérique et climat (conférence, vidéo + texte)
(10) Ingénieur chimie des matériaux un métier de l’automobile (vidéo, 2:10)
(11) Assistant ingénieur (fiche métier)
À l’occasion de la Fête de la Science, l’Onisep, en partenariat avec la Fédération Française de Sociétés Scientifiques (F2S) et Médiachimie, lancent le site Pro2science. Ce site propose d’explorer une série d’objets de la vie quotidienne, porteurs d’innovation, pour établir des liens entre disciplines et découverte du monde économique et professionnel dans le cadre du parcours Avenir. Il vise aussi à promouvoir les métiers scientifiques.
http://www.onisep.fr/pro2science
Télécharger le communiqué de presse (PDF)

Après plusieurs années où la chimie n’était vue qu’à travers la physique ou la biologie, le prix Nobel 2016 récompense des chercheurs chimistes au cœur de la chimie moléculaire. Le français Jean-Pierre Sauvage, l’écossais James Fraser Stoddart et le néerlandais Bernard L. Feringa ont réalisé tous trois d’étonnantes percées en topologie chimique, ouvrant le champ à la dynamique moléculaire. C’est dire qu’ils ont fabriqués des objets moléculaires de la taille du nanomètre (5000 fois plus petits que l’épaisseur d’un cheveu) (1), capables de se déformer sous une influence externe comme la lumière, un stimulus chimique ou électrique, de tourner sur eux même, d’avancer… On parle alors de machines ou moteurs moléculaires.
L’aventure commence pour Jean-Pierre Sauvage et son équipe en 1983, où ils réussissent à synthétiser le [2]caténane en 2 ou 3 étapes (2). L’astuce est en chimie moléculaire d’utiliser un métal, le cuivre, pour courber deux fils moléculaires et les faire s’enchevêtrer en deux anneaux qui s’interpénètrent. Plusieurs grammes sont ainsi préparés qui permettent l’étude de la structure et des propriétés. Ayant ouverts la voie de synthèses, plusieurs équipes se lancent dans ce domaine nouveau. L’équipe de Stoddart utilise les interactions π-π et les liaisons hydrogène pour les assemblages et fabrique un rotaxane (anneau autour d’un axe moléculaire), d’autres, les liaisons Pd – N dans les organométalliques.
En 1994, Jean-Pierre Sauvage arrive à créer un mouvement de « pirouette » sur un caténane en jouant sur l’état de valence du cuivre Cu+ et Cu++ qui fait que les anneaux basculent dans deux positions stables en fonction de l’apport ou du départ d’un électron sur le métal. C’est le premier moteur moléculaire. Les équipes de J. F. Stoddart et de B. Feringa montrèrent par la suite comment faire tourner puis se déplacer un anneau sur un axe, et même lui assigner deux positions distinctes (labélisées 0 et 1) ouvrant la voie à « l’ordinateur moléculaire ».
Jean-Pierre Sauvage rappelle souvent que ces objets artificiels miment des molécules du vivant (3). L’ATP synthase a un moteur rotatif qui synthétise l’ADP à partir des phosphates dans tous les organismes vivants (4). C’est dans l’ADN qu’on retrouve les nœuds entrelacés et les « trèfles » fabriqués par synthèse chimique. Les molécules créées, capables de se contracter et de s’étirer, simulent les mêmes mouvements que les molécules des fibres de nos muscles. Certaines machines moléculaires pourront peut-être à l’avenir transporter des agents thérapeutiques actifs jusqu’aux cibles tumorales. L’imagination des chimistes va jusqu’à fabriquer des roues pour des voitures de courses à l’échelle nanométrique (5).
Rappelons que ces travaux de pionnier ont valu à Jean-Pierre Sauvage de nombreuses distinctions : médaille d’argent du CNRS en 1988, prix Pierre Sue de la SCF en 2004, membre de l’Académie des Sciences et en 2014 Grand Prix de la Fondation de la Maison de la Chimie. Directeur de recherche émérite depuis 2014 et professeur émérite de l’université de Strasbourg, il travaille toujours au sein de l’ISIS (Institut de Science et d’Ingénierie Supramoléculaires).
Jean-Claude Bernier
7 octobre 2016
Quelques ressources pour en savoir plus :
(1) Les nano-objets : un avenir prometteur sous contrôle
(2) Les machines moléculaires (vidéo, 6:15)
(3) Conférence de Jean-Pierre Sauvage - Grand Prix de la Maison de la Chimie 2014 (vidéo)
(4) La fabrique des champions
(5) Nanocar Race : la course des plus petits bolides du monde
Le prix Nobel de chimie 2016 est attribué à Jean-Pierre Sauvage, J. Fraser Stoddart et Bernard L. Feringa.
Jean-Pierre Sauvage, 71 ans, professeur émérite à l'Université de Strasbourg (Institut des Sciences et Ingénierie Moléculaire), lauréat du grand prix de la Maison de la Chimie 2014, est le premier à avoir créé ces molécules extraordinaires aux anneaux entrelacés que l'on peut mettre en mouvement sous l'action d'un signal chimique, photo chimique ou électronique.
Dès 2015, la Fondation de la Maison de la Chimie pour Mediachimie et Univers Science TV ont décidé de coproduire une vidéo sur les machines moléculaires animée par Jean-Pierre Sauvage pour expliquer à tous les publics, y compris les plus jeunes, la chimie futuriste de toutes ces sortes de machines moléculaires, des plus simples aux plus complexes, aujourd'hui récompensée au plus haut niveau mondial.
C'est donc une immense joie et une grande fierté pour toute notre équipe de voir aujourd'hui récompensés non seulement la maîtrise de la synthèse, l'imagination, la créativité, l'intelligence du futur, mais aussi le charisme et les qualités pédagogiques de ce grand chercheur.
Pour ceux qui veulent en savoir plus, voir la vidéo de la conférence de Jean Pierre Sauvage, résumant ses recherches, lors de la remise du Grand Prix de la Maison de la Chimie 2014.
Les nouveaux programmes des collèges donnent aux enseignants et aux élèves de la 6e à la 3e quelques inquiétudes, mais aussi de nouvelles formes d’approches des connaissances. Au-delà des répartitions d’horaires suivant les matières qui peuvent se discuter, s’introduisent les EPI (Enseignements Pratiques Interdisciplinaires) qui seront traités par une équipe de professeurs de plusieurs disciplines sous forme de travaux et rédactions de rapports collectifs pour une classe.
Mediachimie.org est une source riche de données et documents pluridisciplinaires qui conviennent bien à ce genre d’enseignement. Pour vous en convaincre, je voudrais vous donner deux exemples qui s’inspirent des suggestions de croisement entre enseignements qui figurent dans les programmes.
- Corps, santé, bien-être et sécurité
Dans Médiathèque > Qualité de vie, santé et bien-être > Sport, vous trouvez de nombreuses facettes pour traiter du sujet avec les professeurs de physique-chimie, de SVT, de technologie, de mathématiques et de sport. Par exemple, dans La fabrique des champions (issue de la collection Chimie &… junior) (1) on trouve la molécule d’ATP, les réactions biologiques du corps humain, la mécanique de fonctionnement des muscles, l’analyse mathématique de la progression des records et la saison où ils ont été battus (un clin d’œil à l’histoire ?). Pour travailler autour du thème vous pouvez même aller plus loin avec les matériaux composites (2), les nouveaux tissus (3), et même le dopage (4).
- Transition écologique et développement durable, sujet d’actualité s’il en est un !
Dans la médiathèque, vous trouvez Nature, agriculture et environnement > Énergies et économie des ressources. Faites visionner à la classe la vidéo (5) « l’hydrogène qui valorise les énergies renouvelables ». On y suit le périple de deux jeunes étudiants qui vont d’abord en Angleterre visiter l’installation de stockage d’énergie d’une maison, puis on les retrouve en France au labo et dans l’usine qui fabrique le package électrolyseur-stockage-pile. Avec le professeur de langue (anglais), de physique-chimie, de technologie et d’économie vous initierez la classe à découvrir l’hydrogène (6), la pile à combustible (7), la batterie (8), et les données économiques du stockage de l’énergie (9).
Ce ne sont que deux exemples qui peuvent structurer deux thèmes d’EPI, mais il y en a des dizaines d’autres que vous pouvez découvrir en équipe pédagogique avec des données d’actualité et des media modernes et parfois ludiques. Lancez-vous dans cette nouvelle aventure, pariez sur l’EPI.
Jean-Claude Bernier
Septembre 2016
Quelques ressources pour en savoir plus :
1) La fabrique des champions
2) Les matériaux de la performance
3) Les textiles et les vêtements pour le sport
4) Le dopage
5) L’hydrogène qui valorise les énergies renouvelables (vidéo 7 :36)
6) Et revoilà l’hydrogène
7) La pile à combustible, un convertisseur d’énergie d’avenir
8) Piles à combustible et batteries au lithium
9) Stockage de l’électricité : élément clé pour le déploiement des énergies renouvelables et du véhicule électrique
Avec la rentrée, professeurs, élèves, lycéens et étudiants, vous renouez ou découvrez avec les programmes, de nouvelles matières à traiter ou à étudier en chimie, matériaux et physique. Vous aurez à créer des fiches, à écrire des rapports, trouver des références.
Vous avez maintenant un outil entièrement rénové : naviguez et consultez le site Mediachimie.org (donner matière à votre avenir). Vous y trouverez, grâce à une navigation claire, une mine très riche en documents et vidéos sélectionnés et validés par des experts scientifiques. Ces références, écrites ou animées, illustrent les points traités dans les nouveaux programmes officiels et vous seront utiles pour mieux comprendre un point difficile, traiter vos travaux personnels encadrés ou les Enseignements Pratiques Interdisciplinaires, mais aussi voir les débouchés en emplois dans le secteur de la chimie.
Plus de 1000 articles et vidéos constituent le plus grand site français de références en chimie avec de nombreux liens. Dans la médiathèque, six grands thèmes pour vous orienter : Nature, agriculture, environnement – Énergie et économie des ressources – Qualité de vie – Santé et bien-être – Analyse et imagerie – Histoire de la chimie. À côté, deux espaces : dans l’espace enseignants, les enseignants trouvent leur actualité et tous les documents classés par niveaux - collège, lycée, enseignement supérieur-, et dans l’espace métiers, parents, élèves, lycéens peuvent trouver toute l’actualité des emplois et découvrir les métiers de la chimie et des matériaux par niveaux de formation et domaines d’activité.
En cette rentrée 2016, alors que les jeux olympiques de Rio sont à peine refermés et que commencent les jeux paralympiques, ne soyons pas trop nostalgiques, même si certains athlètes français n’ont pas eu trop de réussite, la chimie française était bien présente grâce à quelques entreprises nationales. C’est tout d’abord Aqua Lung, société fondée il y a 70 ans par Cousteau, leader de la plongée de loisirs (1) et basée à Carros (06) qui fournit le nageur vedette Michael Phelps en maillots de bain en deux tissus « exo-foil » et « aqua core » (2), ce dernier en fibres de polyuréthane apportant la compression, notamment le long de l’artère fémorale, ce qui fait venir plus de sang aux muscles (3). De plus, les lunettes (4) aux côtés déformés permettent au compétiteur de mieux surveiller les nageurs concurrents sans tourner la tête. C’est une toute nouvelle entreprise Erpro & Sprint, située à Saint-Leu-La-Forêt (95), qui a fourni aux cyclistes français sur piste des guidons ultra-légers sur mesure et aérodynamiques, fabriqués par technique 3D ou synthèse additive par couches successives d’aluminium (5) fondues par laser. Enfin Gerflor, société basée en région lyonnaise, a installé tous les revêtements des sols de compétition de handball et de basket-ball ainsi que ceux de tennis et de badminton. Ces revêtements sont en général composés de trois couches sur une mousse de polyéthylène souple (6) et un revêtement PVC (7) doté d’un plastifiant d’origine végétale, la décoration et les lignes sont marquées par peinture acrylate aqueuse sans solvant qui donne une qualité de l’air sans COV (composé organique volatil) (8).
Après le rêve de médailles, les réalités de la rentrée sont là : rendez-vous sur Mediachimie.org, c’est le plus grand site pédagogique de la chimie.
Jean-Claude Bernier
Septembre 2016
Quelques ressources pour en savoir plus :
1) Comprendre la physico-chimie par la plongée sous- marine. Comprendre la plongée sous-marine par la physico-chimie
2) Les textiles et les vêtements pour le sport
3) Des textiles pour sportifs. Apport de la chimie pour améliorer confort et performances
4) Polyméthacrylate de méthyle / Altuglas ® / Plexiglas ® (produits du jour de la SCF)
5) Les alliages d’aluminium pour l’allègement des structures dans l’aéronautique et la carrosserie automobile
6) Matériaux polymères et développement durable
7) Polyuréthanes (produits du jour SCF)
8) La qualité de l’air intérieur : enjeu de la santé publique
Vous profitez de la mer, de la montagne, de l’air pur et… du soleil. Vous allez vous exposer avec précaution car une publication fin juin mettait en garde les consommateurs. C’était en réalité les crèmes et laits solaires destinés aux enfants qui étaient visés, certaines compositions n’assurant pas une protection suffisante aux UVA.
Le soleil nous envoie bien la lumière caractérisée par un spectre des longueurs d’onde du visible (1), mais aussi des rayonnements de courte longueur d’onde, les ultraviolets (UV). Les plus dangereux sont arrêtés dès la stratosphère par l’ozone (2), les UVB sont absorbés par la peau et sont responsables des coups de soleil mais ils contribuent à la synthèse de la vitamine D, et les UVA pénètrent le derme et peuvent accélérer le vieillissement de la peau et provoquer des stress oxydants aigus (3), voire des cancers de la peau.
Avant de vous exposer, voyez donc les moyens de vous protéger grâce à l’utilisation de crèmes solaires (4). Consultez les indicateurs figurant sur le tube ou le flacon. Le FPS (Facteur de Protection Solaire, parfois noté IP indice de protection ou SPF en anglais Sunburn Protection Factor) va de 6/10 pour une faible protection à 15/25 pour une protection moyenne, et 30/50 pour une protection forte ou 50+ très forte, en sachant bien qu’on ne peut arrêter tout le rayonnement. Ainsi pour l’indice 10 c’est 1/10 qui sont pourtant transmis, soit 10%, pour 50 c’est 1/50 soit 2%, ceci pour les UVB. Pour les UVA la réglementation européenne demande que la protection soit le 1/3 de celle des UVB ; c’est-à-dire que pour l’indice 30, 10% des UVA sont encore transmis.
On recommande d’appliquer généreusement les crèmes qui comportent des filtres solaires organiques, molécules qui se transforment en absorbant les UVB ou A telles que les methoxidibenzomethane, les methoxiphenylntriazine, ou des filtres minéraux comme les fines particules de TiO2 ou ZnO qui laissent parfois des traces blanches sur la peau et réfléchissent le rayonnement.
De grands progrès ont été faits en dermo-cosmétique pour protéger et soigner la peau (5). Suivant les individus, le taux de mélanine et la pigmentation varient. Une carnation claire, des yeux bleus et cheveux blonds donnent une sensibilité au soleil bien plus forte que pour une peau mate yeux marrons et cheveux noirs (6). Les contrôles en cosmétique sont stricts. L’ingénierie tissulaire permet de mener des essais in vivo sur tous les types de peau (7) et de voir leurs modifications sous UV. La polémique vient des tests in vitro, qui ne mesurent que la quantité d’UV passant à travers une plaque de polymère revêtue de produit solaire.
Quoiqu’il en soit, pour éviter le vieillissement de votre peau, les maîtres-mots sont protection et réparation (8). De plus profitez des vacances pour privilégier une alimentation saine et vitaminée qui aura aussi une influence sur votre beauté (9).
Jean-Claude Bernier
Juillet 2016
Quelques ressources pour en savoir plus :
1) Spectre et composition chimique du soleil (animation)
2) Chimie atmosphère et climat
3) L’homéostasie redox de la peau et sa modulation par l’environnement
4) Un exemple de composé chimique bénéfique à la santé de la peau : la crème solaire
5) Soleil, soleil
6) Les enjeux de la cosmétologie
7) Diversité des peaux du monde : de la clinique à la chimie et aux peaux reconstruites
8) L’approche pionnière de la sécurité en cosmétique : contexte, recherche, méthodes, évolution, réglementation et défis
9) La toxicologie alimentaire et la compréhension des effets alimentaires sur l’organisme
C’est un exploit historique. L'avion solaire Solar Impulse 2 a atterri ce mardi à Abou Dhabi, où cet avion capable de voler jour et nuit avec l’énergie solaire comme unique carburant a bouclé un tour du monde sans précédent, défi technologique autant qu’humain. (AFP)
Dans la traversée du Pacifique les batteries avaient surchauffées d'où l'atterrissage à Hawaï (on eût pu trouver pire endroit). Pendant six mois les ingénieurs ont remplacé les batteries et amélioré le système de refroidissement et de chauffage de certaines parties de l'avion pour pallier les montées et descentes rapides dans des atmosphères tropicales avec de fortes différences de température.
Bertrand Piccard et son compatriote André Borschberg, avec lequel il s’est relayé aux commandes du monoplace tout au long du périple, ont annoncé le lancement d'un comité international de technologies propres pour continuer à pousser pour une utilisation plus efficace de la technologie et de fournir des conseils aux entreprises et aux gouvernements.
En savoir plus sur les Solar Impulse 2 et la chimie
Image : Solar Impulse 2 undertakes a maintenance flight in Hawaii. Solar Impulse (Licence CC BY-NC-SA 2.0)
Juillet et août 2016 vont être très durs pour les sportifs sur canapé ! L’Euro 2016 pour les fans de football, le Tour de France pour les amoureux du vélo, Wimbledon et ses carrés de gazon et les Jeux de Rio pour les passionnés d’athlétisme. Plus de minutes à perdre, le burn-out est proche face aux écrans, mais que de belles occasions de faire de la CHIMIE !
Nous avons déjà montré (1) combien le ballon Beau Jeu était une petite merveille de mathématique et de chimie. Sa surface composée de 6 carrés à côtés courbes en polyuréthane finement quadrillé est propice à faire déferler des milliers de Hourras ! ou de Hooo ! lorsqu’il arrive dans la lucarne des buts adverses ou amis. Il en va de même pour les raquettes des tennismen (2) aux cadres composites et tamis en fibres synthétiques. Les vélos de course du Tour de France bénéficient également des progrès de la chimie des matériaux composites (3). Les « forçats de la route » ne roulent plus comme en 1904 sur des machines de 25 kg en acier mais sur des coursiers de 6 kg hypersophistiqués en fibres de carbone et polyester, avec des pneumatiques fins en polymère (4) et des jantes profilées aux formes issues de la technologie des voiliers de compétition (5). Même en athlétisme, les compétiteurs bénéficient des progrès de la chimie. Les records du saut à la perche ont suivi les matériaux utilisés pour la perche : bambou, aluminium et maintenant résine et fibres de verre ou de carbone (6) qui permettent de culminer à plus de 6 mètres.
Malheureusement, quand on parle chimie et sport, on pense souvent aux molécules dopantes (7). La chimie analytique a beau faire d’immenses progrès, il y va souvent du manque de volonté de certaines fédérations sportives pour lutter contre les tricheurs. Pour le vélo, sur le Tour de France 2016 on lutte contre le « dopage mécanique ». On avait eu des doutes l’an dernier sur la possibilité de dissimuler des micromoteurs électriques (8) dans les tubes et tiges de selles. De nouvelles caméras thermiques très sensibles fournies par le CEA permettent de déceler en course tout moteur en action et complètent les tablettes magnétiques testant les vélos au repos pour détecter éventuellement les aimants de moteurs dissimulés. Mais heureusement la majorité des athlètes comptent d’abord sur l’entraînement qui permet de sécréter la dopamine et la sérotonine (9) pour être en forme physique et mentale (10).
Jean-Claude Bernier
Juillet 2016
Quelques ressources pour en savoir plus :
1) Beau Jeu, un ballon chimique ?
2) Technologie et performance sportive
3) Les matériaux composites dans le sport
4) Les matériaux de la performance
(5) Moins de 80 jours grâce à la chimie ?
(6) De la transformation des matériaux (vidéo, 8:00)
(7) La traque aux molécules dopantes
(8) Un maillot jaune électrique ou chimique ?
(9) Optimisation des performances, complexité des systèmes et confrontation aux limites
(10) La fabrique des champions
Le Grand Prix les Jeunes Journalistes de la Chimie récompense un concours ouvert aux étudiants journalistes, dont la Fondation de la Maison de la Chimie a confié l’organisation à MCE, Ma Chaîne Étudiante.
Onze écoles de journalisme, avec au total quinze équipes, ont participé à ce concours dont le but est de récompenser le meilleur reportage (article et interview filmée) sur un thème d’actualité lié à la science, et pour une part à la chimie, et ainsi donner une notoriété méritée au binôme le plus prometteur de la nouvelle génération de journalistes.
Pour réaliser ce reportage, quatre binômes ont été présélectionnés sur dossier parmi 45 projets par un jury de professionnels composé de :
- Madame Carole Chatelain, rédactrice en chef de Sciences et Avenir
- Monsieur Tristan Vey, grand reporter au service Sciences/Médecine du Figaro
- Monsieur Ludovic Place, directeur général de Ma Chaîne Étudiante
- Madame Danièle Olivier, vice-présidente de la Fondation de la Maison de la Chimie
Deux binômes ex-aequo ont été récompensé le 20 juin 2016 à la Fondation de la Maison de la Chimie par la remise à chacun d’eux d’un chèque de 5000 €. Les articles des binôme gagnants seront publiés par les partenaires de la presse écrite.
Découvrez tous les épisodes web et tv sur la page dédiée : http://mcetv.fr/grand-prix-jeunes-journalistes-chimie/
Vous pourrez aussi voir cette remise le mardi 28 juin à 20h25 sur MCE : http://mcetv.fr/mce-direct
Dimanche 19 juin un match décevant par son score, mais pas par ses surprises « chimiques ». Ça commence avec la pelouse, puis les maillots et enfin le ballon Beau Jeu.
La pelouse du stade Maurois de Lille n’est pas suffisamment belle selon l’UEFA, donc il faut la verdir. Repeindre son gazon c’est une mode qui nous vient des États-Unis depuis que la Californie a subi des étés très secs. C’est une société américaine qui commercialise un « law paint concentrate » qui, mélangé à de l’eau, est pulvérisé sur l’herbe jaunie. La composition est confidentielle, on sait seulement qu’elle est à base d’extraits d’algues et de tourbe, auxquels on ajoute des pigments organiques. C’est rapide, non toxique et écologique, puisque en période de sécheresse cela évite les arrosages et le gaspillage de l’eau. En France et en Europe, on utilise plutôt un chélate de fer (EDDHA, un sel de l'acide éthylènediamine dihydroxy phényl acétique) qui demande cependant plusieurs jours pour agir.
Plusieurs joueurs suisses ont dû changer de maillots, ceux–ci se déchirant avec entrain, l’avant-centre subissant trois changements. L’équipementier Puma explique qu’un lot fourni et fabriqué par un sous-traitant en Turquie est à incriminer. Il invoque lors de la fabrication des fibres, un problème de température, de pression et d’humidité. Les internautes de médiachimie.org ne sont pas étonnés car on sait grâce à « Chimie et Sport » qu’ils sont probablement en élasthanne–polyester avec l’avantage d’être élastique et doux comme « une seconde peau ». Mais certains polymères sont très sensibles à l’absorption d’eau et il faut les protéger de l’humidité lors de la fabrication.
Enfin cerise sur le gâteau, Beau Jeu notre « ballon chimique » explose lors d’un contact entre deux joueurs Griezmann et Behrami. Nous avons exposé récemment combien à lui seul il représentait une somme d’innovations. Les six pièces en polyuréthane (impranil) à la surface finement quadrillée, assemblées par soudure thermique, n’ont pas résistées aux crampons en composite carbone de notre joueur français. Une soudure a été déchirée et Beau Jeu s’est dégonflé comme une vulgaire baudruche.
Finalement n’est-il pas réconfortant que dans une compétition où tous les détails et la technologie doivent être réglés, l’incertitude du sport et l’influence humaine ont encore leurs places.
Jean-Claude Bernier
22 juin 2016
La Maison du Soleil à Saint-Véran est ouverte au public à partir du mardi 14 juin 2016.
Un spectacle unique d’observation du soleil et des expériences inédites autour du soleil : soleil et santé, soleil et physique, soleil et chimie, soleil et biologie.
Visites guidées à 14h30 et 16h ; sur réservation pour les groupes
Portes ouvertes jusqu’à fin juin 2016
Vous pouvez aussi réserver une nuit inoubliable à l’observatoire de Chateaurenard, le plus haut d’Europe.
Tel. : 06 64 93 54 11
Mail : contact@saintveran-maisondusoleil.com



437 grammes, 69 cm de circonférence, c’est « Beau Jeu » le ballon de l’Euro 2016. C’est le petit frère de « Brazuca », le ballon de la Coupe du monde 2014 au Brésil et de « Albert » à Londres en 2012 (1). Il est composé de six pièces de polyuréthane de type Impranil mais avec des nouveautés ;sur les cinq couches successives, l’une est faite d’une mousse avec des millions de sphères apportant une superbe élasticité (2).
Les ingénieurs et techniciens ont réussi à faire un ballon parfaitement rond en juxtaposant par thermosoudure six faces carrées à arêtes courbes en retrouvant le théorème mathématique d’Alexandrov-Pogorelov. C’est pourquoi on parle parfois du « ballon cubique » mais parfaitement sphérique. Cependant, pour avoir des trajectoires maîtrisées, la couche externe du ballon est faite de minuscules croisillons en polyuréthane sur un substrat spécial de polyester-coton (3). Un ballon de football n’adopte pas en général une trajectoire parabolique, mais triangulaire, dite « tartaglia », du nom d’un mathématicien italien Niccolò Fontana, dit Tartaglia (« Le Bègue »), car la frappe moyenne des joueurs internationaux implique une vitesse initiale du ballon de 80 à 90 km/h supérieure à la vitesse de lévitation. Pour éviter que le ballon ne « plane », les minuscules aspérités perturbent la trainée dans l’air et permettent aux joueurs adroits de faire tourner le ballon sur lui-même et d’atteindre la lucarne des buts en trompant les gardiens.
Il n’y a pas que le ballon qui mobilise la chimie (4), les chaussures des joueurs en sont un concentré. Elles doivent être légères et solides. La semelle est en fibre de carbone (5) sur laquelle les crampons sont directement moulés (6). La chaussure elle-même est en fibres de polyisocyanate ou de polyester tissées, montant parfois pour protéger la cheville (7), douce à l’intérieur, légèrement rugueuse à l’extérieur pour pouvoir imprimer au ballon l’effet de rotation voulu par le joueur. Les maillots et short eux-mêmes sont en fibres thermorégulées, certains comportent des parties élastiques qui mettent les muscles en micro-compression (8) en assurant un léger massage anti-fatigue (9). Les prochaines avancées informatiques dont sont déjà munies certaines équipes sont les exploitations de données. Le petit GPS dans le col du maillot et les microcapteurs physiologiques connectés (10) enregistrent en ligne des données (11) sur chaque joueur : déplacements, vitesse, rythme cardiaque, fatigue…
Vive l’euro 2016, chimique et électronique, mais in fine c’est le talent des joueurs qui nous régale.
Jean-Claude Bernier
Juin 2016
Quelques ressources pour en savoir plus :
(1) L’histoire d’Albert, le ballon de foot des jeux olympiques (vidéo, 8:14)
(2) Le plastique qui recycle le CO2 (vidéo, 6:11)
(3) Les matériaux composites dans le sport
(4) La chimie et le sport autour du monde
(5) Les allotropes du carbone : une grande famille
(6) Technologie et performance sportive
(7) Des textiles pour sportifs. Apport de la chimie pour améliorer confort et performances
(8) L’intelligence textile (vidéo, 7:14)
(9) Un tissu anti- courbature (vidéo, 7:18)
(10) Les polymères se réveillent pour l’électronique ! (vidéo, 31:44)
(11) Chemical World Tour 3 : nos tablettes un condensé de chimie !
L’inauguration de la Maison du Soleil aura lieu à Saint Véran le jeudi 9 juin par Monsieur Thierry Mandon, Secrétaire d'État en charge de l'Enseignement supérieur et de la Recherche.
La Fondation internationale de la Maison de la Chimie et Mediachimie sont partenaires de ce musée et participent à l’animation du secteur « chimie du soleil et photochimie ».
Pour les usines chimiques, le pétrole n’est pas seulement source d’énergie, c’est à 90 % une matière première. Les raffineries situées à proximité les alimentent en naphta, éthylène, propylène… qui arrivent par pipeline en flux tendus. Avec les blocages à répétition des raffineries et des dépôts pétroliers les approvisionnements sont menacés. Le 27 mai, près de 40 usines étaient à l’arrêt, soit 15 % des sites de chimie de base en France. « Le manque à gagner en termes de production est évalué à 15 millions d’euros par jour. Pour la chimie, la facture s’élève déjà au minimum à 100 millions d’euros » estime Jean Pelin, directeur général de l’UIC.
Les groupes les plus fragiles risquent gros, comme le fabricant de PVC Kem One qui s’est engagé sur de gros investissements pour retrouver de la rentabilité. Total est très touché : sur ses cinq raffineries, seule l’une produit en débit réduit, les autres sont paralysées. Dans l’hexagone, seules trois raffineries fonctionnent, appartenant à Exxon.
Si la chimie de base ne produit plus, la situation se complique en aval dans l’industrie plastique ou automobile. Les usines chimiques proposent de plus en plus pour leurs clients des produits sur mesure pour les bouteilles, l’électroménager, les carrosseries, les tableaux de bord, les plastiques d’usage… Tous les acteurs de la chaine sont très dépendants les uns des autres.
Selon l’UIC, alors que la chimie occupe le premier rang des secteurs industriels exportateurs et alors que l’activité repartait bien, ces pertes de production ne se rattraperont pas. Il faudra revoir à la baisse le chiffre prévu de hausse de 1,9 % en 2016.
Jean-Claude Bernier
28 mai 2016
NdlR : voir les contributions des présidents de l’UIC sur mediachimie.org
- Les défis d’avenir posés aux chimistes pour la protection de la santé et de l’environnement : le point de vue indutriel (Pascal Juery)
- Les entreprises de la chimie : des innovateurs au service de la lutte contre le changement climatique (Philippe Goebel)
Alors que les grands opérateurs d’électricité veulent arrêter les centrales thermiques au charbon et que les États jurent de ne plus les subventionner, le charbon (1) s’ouvre à une nouvelle carrière. Il ne s’agit évidemment pas du même charbon, mais du charbon actif (2).
Le charbon actif est un carbone presque pur obtenu par carbonisation à haute température de 600 à 800 °C de produits végétaux, comme des coques de noix ou des bambous, et par, une seconde opération, pour ouvrir des pores par oxydation ménagée à la vapeur d’eau ou au CO2.
On trouve le charbon actif sous forme de poudre ou en grains, avec une propriété essentielle : la surface spécifique est très grande de 500 à 1500 m2 par gramme ! Cela lui donne un pouvoir d’absorption étonnant, largement utilisé pour la dépollution et la purification de l’eau (3). Les cartouches de certaines carafes en sont faites ; elles absorbent les ions clhorure Cl- et donnent un meilleur goût à l’eau potable (4).
On connaît aussi son utilisation en pharmacie (5) : le charbon médicinal est du charbon actif en granulés qui fait merveille contre les problèmes intestinaux, maux de ventre, ballonnements et diarrhée. C’est l’une des spécialités pharmaceutiques les plus anciennes (6). Mais aux États-Unis, et bientôt en France, on vante les mérites des cures au charbon. La « charcoal limonade » et les cocktails à la poudre noire font un malheur. Pour détoxifier l’organisme, nettoyer à fond les substances indésirables dans le sang et même éviter la gueule de bois après une soirée trop arrosée, les jus de fruits au charbon et les crèmes de légumes noircies sont très mode. Le pouvoir absorbant et son origine naturelle (7) font débarquer le charbon actif dans la cosmétique (8), il absorbe le sebum et impuretés de la peau. Le gommage au charbon est primeur chez les ados, les savons « charcoal » débarquent en France, préparez-vous en 2016 aux beautés charbonneuses !
Pr Jean-Claude Bernier
Mai 2016
Quelques ressources pour en savoir plus :
1) Charbon (le produit du jour de la SCF)
2) L’obtention de charbons actifs
3) L’eau, sa purification et les micropolluants
4) L’eau du robinet est–elle polluée ?
5) L’utilisation du charbon médicinal
6) Quelques spécialités pharmaceutiques centenaires
7) La nature pour inspirer le chimiste : substances naturelles, phytochimie et chimie médicinale
8) Chimie dermocosmétique et beauté
Pour une fois qu’une course automobile se déroulait au pied de la Maison de la Chimie, j’ai réagi trop tard. Quinze jours avant le 23 avril, la billetterie des 20 000 places était fermée ! Le circuit dessiné en plein Paris autour des Invalides fait un peu moins de 2 km avec quatorze virages et devait être parcouru 45 fois pour une course de 87 km.
C’est la première fois que la très sérieuse FIA (Fédération Internationale de l’Automobile) organisait à Paris une course automobile qui compte pour le championnat du monde de F E (avec E comme électrique). Elle a rassemblé 18 monoplaces électriques capables de tourner à 225 km/h et qui atteignent 100 km/h en moins de 3 secondes. Plusieurs jours avant, un bitume (1) provisoire avait recouvert les plaques d’égouts et les pavés, et des vibreurs avaient été placés dans les virages. L’an passé, les bolides étaient semblables et fabriqués par une entreprise française : Spark Racing Technology. Cette année, seuls les châssis en aluminium et fibres de carbone (2) de chez Spark étaient communs. Les carrosseries, très profilées en composites classiques (3) et carbone-carbone (4), étaient au choix des écuries. Les moteurs électriques (5) d’une puissance de 230 à 270 cv étaient majoritairement fabriqués par McLaren Applied Technologies mais les motopropulseurs qui peuvent délivrer 150 kW en mode course et 180 kW en cours de « Fan Boost » étaient d’origines diverses. Le pack de batteries performantes (6) capable de stocker de l’ordre de 30 kWh est encore insuffisant pour la totalité du parcours ; aussi, à mi-course, les pilotes changent de monture. Les pneus de 18 pouces sont spécifiques (7), c’est Michelin qui les fournit.
Quatre écuries principales sont en compétitions : deux françaises, Renault et DS, et Venturi (Monaco), Audi Sport (Allemagne). De jeunes coureurs parfois aux noms célèbres conduisent ces bolides. Le podium du grand prix de Paris est :
- 1er - Lucas di Grassi sur Schaeffler Audi Sport
- 2e - Jean-Éric Vergne sur DS Virgin Racing
- 3e - Sébastien Buemi sur Renault
Toutes ces nouvelles voitures de course sont bourrées d’innovation grâce à la chimie (8) et soyons sûrs que nous les retrouverons d’ici quelques année sur nos véhicules électriques.
Pr Jean-Claude Bernier
Mai 2016
Quelques ressources pour en savoir plus :
1) Les infrastructures des transports : les apports de la chimie dans les projets d’avenir
2) Les alliages d’aluminium pour l’allègement des structures dans l’aéronautique et la carrosserie automobile
3) Les matériaux composites dans le sport
4) Les composites carbone/carbone
5) Le moteur électrique comparés aux moteur thermique : enjeux et contraintes
6) Stockage de l’électricité : élément clé pour le déploiement des énergies renouvelables et du véhicule électrique
7) Le pneumatique : innovation et haute technologie pour faire progresser la mobilité
8) L’industrie chimique au service de l’automobile