Vous trouverez ci-dessous une liste vers quelques ressources présentant des vidéos de présentations d’expériences, de techniques d’analyse ou de techniques expérimentales.
Le mystère de la cristallisation
Identification d’une molécule organique par IR et RMN
Présentation d’expériences
- Le mystère de la cristallisation
- La teinture d’un jeans
- La synthèse de l’indigo
- La couleur incolore
- Les insectes voient rouge
Techniques d’analyse
- Quelques vidéos en anglais (source Royal Society of Chemistry)
Techniques expérimentales
- Hydrodistillation
- Fusion d'un solide ? Banc Köfler
- Eliminer l'eau d'un milieu réactionnel : Tube décanteur de Dean-Stark
- Quelques vidéos en anglais (source MIT)
À la fois ludique et pédagogique, cette vidéo permet d’observer les phénomènes lors de mélanges de liquides. Sont-ils miscibles ou non ? Comment se répartissent-ils dans le récipient et pourquoi ? Quels sont les interactions à l’échelle moléculaire ?
Fort(e)s de ces découvertes, à vous de réaliser un cocktail multicolore ou de reproduire l’expérience de Marie Curie. Toutes les expériences sont reproductibles dans une cuisine.
Organisation de la vidéo :
- 0:50 : Miscibilité, non miscibilité et densité
- 4:45 : Cocktail 3 étages consommable
- 6:00 : Cocktail 5 étages non consommable
- 7:15 : Manip de Marie Curie pour ses filles
- 9:30 : Interactions intermoléculaires
- 11:30 : Conclusion et remerciements
En 1856, le jeune William Perkin âgé de 18 ans étudie la chimie au Royal College of Chemistry de Londres sous la direction d’August Wilhelm von Hofmann (1818-1892), chimiste organicien expert en goudron de houille. Von Hofmann, élève de Justus Liebig (1803-1873) à Giessen, avait été recruté en 1845 comme directeur d’une nouvelle école de chimie pratique à Londres sous l’égide du Royal College of Chemistry. Ses recherches sur le goudron de houille, puis sur le gaz de ville (ou naphta) l’avaient conduit à découvrir l’aniline.
Dans ses mémoires, William Perkin explique que, en réponse à un concours lancé par Hofmann, il a effectué des recherches pendant les vacances de Pâques, dans son petit laboratoire personnel. Son projet était de réaliser la synthèse de la quinine dont la structure moléculaire n’était pas alors connue, avec pour objectif de « combattre le paludisme qui touchait les troupes qui défendaient aux Indes l’honneur britannique ». Perkin précise : « Après plusieurs essais j’en arrivais à oxyder un dérivé de l’aniline, la N-allyl-toluidine ». Car pour obtenir la quinine, il pensait qu’on pouvait y arriver par l’oxydation de deux molécules de N-allyl-toluidine. C’est ce qui pouvait être imaginé, sur la base des formules brutes, en comptant le nombre des atomes des molécules avant et après l’oxydation prévue. Les formules développées n’étaient pas alors connues, mais les formules brutes l’étaient. Pour le jeune Perkin, l’oxydation de la N-allyl-toluidine (C10H13N) était supposée former la quinine (C20H24N2O2) selon l’équation :
2 C10H13N + 3O -> C20H24N2O2 +H2O
Mais les structures développées du produit obtenu et de la quinine n’ont aucun rapport.
Cependant, lorsque Perkin a fait cette réaction avec du dichromate de potassium, il n’a obtenu qu’une boue brunâtre irrécupérable qu’il dut mettre à l’évier. C’est alors qu’il refait la réaction en oxydant par du bichromate de potassium de l’aniline contenant comme impuretés des α- et β-toluidines. Il décrit ainsi sa découverte : « J’obtins vite un splendide précipité rouge brun. Bien sûr, ce composé n’avait rien à voir avec la quinine artificielle que je recherchais, mais il éveilla ma curiosité de chimiste, car ayant renversé une petite éprouvette, je vis qu’il produisait sur le parquet et sur ma blouse des tâches certes de belle couleur, mais surtout indélébiles. Sans le savoir je venais d’inventer ce colorant de bonne tenue dont l’industrie textile avait tant besoin ».
De la pâte goudronneuse obtenue, il extrait par de l’éthanol une solution violette colorée par une substance qu’il nomme mauvéine.
De nos jours nous connaissons les formules développées de tous ces composés.
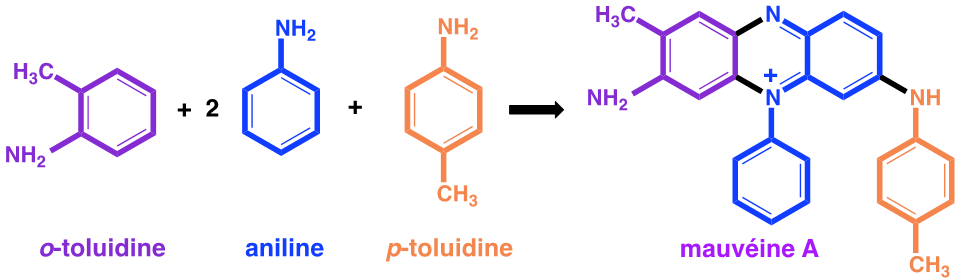
Figure 1 : Synthèse de la mauvéine A
On constate que la structure de la mauvéine ne ressemble pas du tout à celle de la quinine dont la formule est :
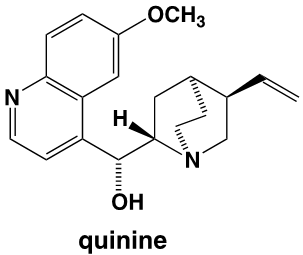
Les colorants naturels étaient très coûteux et difficiles à obtenir. C’est sur le conseil de sa femme qu’il donnera le nom de mauvéine à cette couleur en référence à la fleur « mauve (Malva sylvestris) ». Perkin dépose un brevet le 26 août 1856, démissionne de la Royal Society of Chemistry contre l’avis d’Hofmann et mobilise sa famille pour fonder avec son père et son frère une entreprise à Greenford dans la banlieue de Londres pour développer son invention. Elle a marqué la naissance de l’industrie chimique organique. Il lui faudra perfectionner sa fabrication, stabiliser la fixation du colorant sur les tissus et rendre le prix attractif. La concurrence des teinturiers étrangers dont les lyonnais qui apprennent en 1857 l’arrivée de ce nouveau produit sera rude, et surtout va susciter de nombreuses contrefaçons en Europe où le brevet anglais ne s’appliquait pas. Pour Perkin, qui a une longueur d’avance sur les autres chimistes, le succès sera éclatant. Par ailleurs, à partir des années 1860-1870, les chimistes allemands créeront une puissante industrie de matières colorantes, en particulier la Badische Anilin und Soda Fabrik (BASF).
Très rapidement la couleur mauve devient à la mode dans toute l’Europe et une véritable fureur va en effet s’en emparer. En 1862, la reine Victoria apparut à l’Exposition internationale de Londres dans une robe en soie teinte en mauve par le colorant de Perkin et porte cette couleur dans toutes les grandes occasions. À Paris l’impératrice Eugénie s’en entiche et porte aussi des robes mauves. Ce sera la couleur du timbre anglais de 2 pence en 1882.
Perkin se retire des affaires en 1874 à 36 ans. Il continue ensuite des recherches en chimie organique, découvre la « réaction de Perkin » qui lui permet de réaliser la synthèse de coumarines, à la base de l’industrie des parfums synthétiques. Il publie environ 60 articles, principalement dans le Journal of the Chemical Society, devenu « JCS Perkin ». Il meurt en 1907 d’une pneumonie à Arrow dans la banlieue de Londres. Cette découverte est un exemple type de sérendipité* en chimie.

L'usine de Greenford en 1858. Credit: Wellcome Collection. Licence CC BY 4.0
* La sérendipité est la science des découvertes imprévues. Les Trois Princes de Serendip est un conte oriental décrivant les nombreuses aventures de ces princes au cours desquelles ils utilisent de ténus indices pour remonter logiquement à des faits dont ils ne pouvaient avoir connaissance. (Sérendip est le nom en persan de Ceylan, aujourd’hui Sri Lanka). L’exemple type de cette démarche est Christophe Colomb qui cherche la route des Indes et trouve l'Amérique. C’est aussi ce que Pasteur nommera « le hasard dans un esprit préparé ».
Pour en savoir plus
- What did W. H. Perkin actually make when he oxidised aniline to obtain mauveine?, Otto Meth-Cohn and Mandy Smith, J. Chem. Soc. Perkin Trans. 1 (1994) 5-7
- La Royal Society of Chemistry commémore la découverte de la mauvéine, Dr Anne Prost (2008)
- William Henry Perkin (1838-1907) et la mauvéine, Camille Nerestan, Colorants et textiles de 1850 à nos jours, Carnet de recherche de l'Institut national d'histoire de l'art (INHA) 18 avril 2018
- Mauve Mania, Sophie Waring, site du Science Museum
- Reconstructing the historical synthesis of mauveine from Perkin and Caro: procedure and details, Tânia F. G. G. Cova, Alberto A. C. C. Pais & J. Sérgio Seixas de Melo, Scientific reports 7 (2017) 6806
Vidéo : Réalisation : François Demerliac ; Auteur scientifique : Bernard Bodo ; Production : Fondation de la Maison de la Chimie / Virtuel
Le principe actif du remède, la quinine, a été extraite des écorces du quinquina jaune en juin 1820 par deux pharmaciens-chimistes français, Pelletier et Caventou. Cette découverte, très importante à l’époque, est toujours d’actualité en 2020, où nous célèbrerons son bicentenaire. La quinine reste un médicament majeur pour le traitement du paludisme, qui est toujours, avec 219 millions de personnes malades et 435 000 décès en 2017, la parasitose la plus importante. De plus elle concerne majoritairement les enfants de moins de cinq ans.
Le remède a été introduit en Europe dès le début du XVIIe siècle, mais il a fait l’objet de multiples discussions et controverses sur la façon de le préparer et de l’utiliser. C’est une éternelle histoire qui n’est pas sans rappeler l’actualité de 2020.
Il y a maintenant plus de cinq siècles que Christophe Colomb et les conquistadors ont introduit le paludisme dans le Nouveau Monde, les Amériques. Mais le Pérou avait le remède, une substance issue de l’écorce de quinquina utilisée par les amérindiens comme tonique et pour lutter contre des fièvres. Les débuts de cette histoire ont fait l’objet de nombreux récits ou légendes contradictoires.
Pourquoi les accumulateurs lithium-ion sont-ils à l’origine de la révolution technologique des objets électroniques portables que sont smartphones, tablettes, ordinateurs portables… ? Vous trouverez les réponses dans cette vidéo.
En premier lieu vous découvrirez le fonctionnement de toute cellule électrochimique et les grandeurs associées, dont l’énergie massique, puis l’intérêt du lithium pour augmenter tout particulièrement ce paramètre.
Cette première partie très pédagogique, avec visualisation par animation des phénomènes ayant lieu dans la cellule, peut être utilisée dès le lycée en classe (durée 9 minutes).
Puis M. Patrice Simon, professeur à l’Université Paul Sabatier (Toulouse) et membre de l’Académie des sciences, nous accueille dans son laboratoire et nous explique les découvertes ayant permis la création d’accumulateurs utilisant le lithium. Ces découvertes concernent tout particulièrement les matériaux constituant les électrodes.
Les travaux de John B. Goodenough, M. Stanley Whittingham, Akira Yoshino dans ce domaine ont été reconnus et récompensés par l’attribution du prix Nobel à leurs auteurs en 2019. La composition d’un accumulateur Li-Ion actuel utilisé dans les smartphones est présentée.
Les problèmes liés aux ressources en lithium et cobalt sont abordées à partir de 12’38.
La vidéo se termine par un message personnel du professeur P. Simon.
Pour ceux qui souhaitent aller plus loin sur cette thématique, l'interview complète du professeur Simon est disponible ici (vidéo YouTube). Un sommaire avec les codes temporels vous permettant d’aller à la partie souhaitée est disponible dans le descriptif de la vidéo.
On consultera aussi avec intérêt sur Mediachimie.org l’éditorial du 10/10/2019 Un Nobel de chimie populaire et la question du mois Pourquoi ne faut-il pas jeter les piles ?
Sandrine Roussel est ingénieure brevets chez Solvay. Elle nous fait découvrir son parcours, son métier à double compétences et ses missions essentielles pour protéger les innovations de l’entreprise.
Lionel Augee est technicien de formulation chez Solvay. Il participe à la mise au point de solutions pour protéger les métaux contre la corrosion et faciliter l’adhérence des peintures. Il nous décrit ses diverses activités au sein du laboratoire, ses collaborations avec d’autres services de l’entreprise ainsi que son parcours.
Anne-Laure Pinault est responsable d’équipe de recherche chez Solvay. Elle nous fait découvrir son parcours, ses missions et ce qui contribue à leurs réussites et nous fait partager son enthousiasme.
