Économie circulaire : peut-on faire mieux avec moins de ressources naturelles ? Définitions, causes de l’accumulation des déchets et exemples d’amélioration sont présentées très clairement dans cette vidéo.
Source : Youtube / Licence de paternité Creative Commons (réutilisation autorisée)
La passionnante histoire des diatomées, ces microalgues unicellulaires qui font de la photosynthèse et sont à l’origine de 50% de l’oxygène que l’on respire, montre comment le vivant, avec un matériau donné très simple, la silice, imagine des nanostructures originales permettant de répondre aux diverses exigences de la vie.
Ces verres biologiques créés à température ambiante inspirent le chimiste car ces nanostructures biologiques permettent au vivant d’obtenir des propriétés variées ayant déjà des applications dans de nombreux domaines tels que la filtration industrielle ou la filtration solaire.
Au début du XVIIIe siècle, la seule teinte bleue stable est le bleu outremer obtenu à partir d’une pierre précieuse, le lapis-lazuli. Cette couleur bleu est donc très chère. Entre 1704 et 1709, selon les sources, à Berlin, Heinrich Diesbach et Johann Conrad Dippel (1673-1734) veulent préparer un colorant rouge mais ils obtiennent accidentellement une nouvelle couleur bleue. Ce bleu fut obtenu par l’action du sulfate de fer (II), (FeSO4) sur un carbonate de potassium (K2CO3) qui contenait malencontreusement un cyanure jaune.
Diesbach et Dippel commercialisent ce nouveau pigment en gardant le secret de fabrication afin d’en conserver le monopole. Ce bleu porte alors le nom de Bleu de Prusse ou Bleu de Berlin. Le procédé de fabrication est dévoilé seulement en 1724 par John Woodward (1655-1728).
Tout au long du XVIIIe siècle, les chimistes vont s’intéresser à ce bleu. En 1756, Pierre Joseph Macquer (1718-1784) publie « Examen chymique du bleu de Prusse » (écriture de l’époque). Puis Carl Wilhelm Scheele (1742-1786) fait réagir du bleu de Prusse avec de l’acide sulfurique à chaud et obtient le cyanure d’hydrogène. Joseph Louis Proust (1754-1826) expose ses « Recherches sur le bleu de Prusse » en 1799 et c’est Louis Joseph Gay-Lussac (1778-1850) qui détermine sa composition en 1811. Le bleu de Prusse est au final un ferrocyanure de fer (III), hydraté : [Fe(III)]4[Fe(II)(CN)6]3 ,(H2O)x.
Ce pigment est le premier créé artificiellement. Les peintres européens l’utilisent dès 1710. Comme il a un pouvoir colorant élevé, il sert aussi en teinture. Lors de lessives de linges blancs jaunis, il est ajouté à l’eau de lavage afin d’obtenir à nouveau des linges blancs. De nos jours, il a de nombreuses applications. En mécanique, on vérifie l’ajustage de pièces plates au marbre. En chaudronnerie, il est utilisé comme couche de marquage car il résiste à l’eau et aux solvants. En chimie analytique, il sert à l’identification des ions cyanures. En médecine, il est très efficace pour éliminer le césium 137 et le thallium du corps humain et utilisé en cas d’irradiation.

T. Grison, La Teinture du Dix Neuvième Siècle en ce qui concerne la laine et les tissus, Paris, 1884 (Collections SEIN). Cliché G. E.
Pour en savoir plus
Fer : curiosités ; Bleu de Prusse, bleu de Turnbull, sur le site de l’UdPPC (Union des professeurs de physique et de chimie)
De la teinture des laines au moyen du Bleu de Prusse, de P. Raymond fils, Annales de chimie et de physique (Paris), 1828, t.39, pp. 44-77
De la teinture du bleu de Prusse, de Homassel, in Cours théorique et pratique sur l'art de la teinture en laine, soie, fil-coton, fabrique d'indienne en grand et petit teint, (1807), Edit. Courcier, Paris, pp. 277-278
Mémoire sur la composition de la matière colorante du bleu de Prusse, de J.-F. Clouet, Annales de chimie (Paris), (1791/10) t.11, pp.30-35
Vidéo : Réalisation : François Demerliac ; Auteur scientifique : Catherine Marchal et Françoise Brénon ; Production : Fondation de la Maison de la Chimie / Virtuel
Une pile : quel nom étrange ? Quelles sont donc les « choses empilées » dans cet objet ? Pour cela, il faut remonter à la fin du 18e siècle et aux observations de Galvani sur ce qu’il appelait alors « l’électricité animale ».
Luigi Galvani (1737 - 1798) était professeur d’anatomie à l’université de Bologne en Italie, ville pionnière pour l’enseignement de cette science. Au cours de la dissection d’une grenouille dans un laboratoire où étaient présentes des machines électrostatiques, l’un des assistants de Galvani, en touchant avec son scalpel le nerf crural de la grenouille, constata la contraction du muscle de la cuisse, en même temps qu’une étincelle éclatait dans une machine électrostatique à proximité.
Très intrigué par cette découverte, et après de nombreux autres essais, Galvani s’aperçu que cette contraction pouvait aussi être obtenue lorsque l’on mettait en contact deux fils constitués de deux métaux différents, reliés l’un au nerf crural et l’autre au muscle de la cuisse (l’« arc galvanique »). Il en tira la conclusion que les contractions seraient dues à une « électricité animale » qui proviendrait de l’animal et se déchargerait lorsque nerf et muscle seraient reliés par les métaux.
Alessandro Volta (1745-1827) était, lui, professeur de physique à l’université de Pavie. Très intéressé par les expériences de Galvani, il les reproduisit mais eut rapidement des doutes sur l’origine animale de l’électricité. Il lui est venu l’idée, pour amplifier l’effet, d’empiler alternativement des disques de métaux différents, d’abord du zinc et de l’argent, puis du zinc et du cuivre, séparés par des rondelles de carton imprégnées d’une solution saline, par analogie avec les « humeurs » au sein des organismes animaux. Il observa que cette pile pouvait le « frapper » quand il touchait les deux extrémités avec les mains nues, de façon analogue à une bouteille de Leyde (1). Mais, contrairement à cette dernière, déchargée après le premier contact, et à sa surprise, le « choc » était renouvelé à chaque fois qu’il touchait la pile. La pile électrique était donc née.
Les chimistes vont s’approprier cette invention, présentée par Volta, en 1800, à Paris, à l’Académie des Sciences devant Bonaparte, puis à Londres. Davy, à Londres, l’utilise pour isoler le sodium et le potassium, en 1807. Ensuite Gay Lussac et Thenard, isoleront en 1810, à leur tour, ces deux métaux, en utilisant « la grande pile », installée à l’école Polytechnique et construite grâce à un financement de l’empereur Napoléon. C’est la naissance de l’électrochimie.
(1) La bouteille de Leyde, connue depuis 1745, est constituée par une bouteille en verre d’où sort par le goulot une tige métallique, remplie de feuilles d’étain chiffonnées et entourée d’une feuille métallique. Elle était utilisée comme curiosité dans les foires pour donner des chocs électrostatiques.
Pour en savoir plus
Ressources issues du site Histoire de l’électricité et du magnétisme (CNRS) :
- À propos de la bouteille de Leyde :
L'énigme de la bouteille de Leyde et la vidéo La terrible secousse... - Galvani et l’électricité animale
- Des expériences de Galvani à la pile Volta : reproduction de l’expérience de Galvani à l’Université de Rennes, unité de physiologie animale - Vidéo CNRS
- La controverse Galvani Volta

Gravure de U. Parent, extraite de L. Figuier, Les Merveilles de la science, 1867, p. 669 (collection privée)
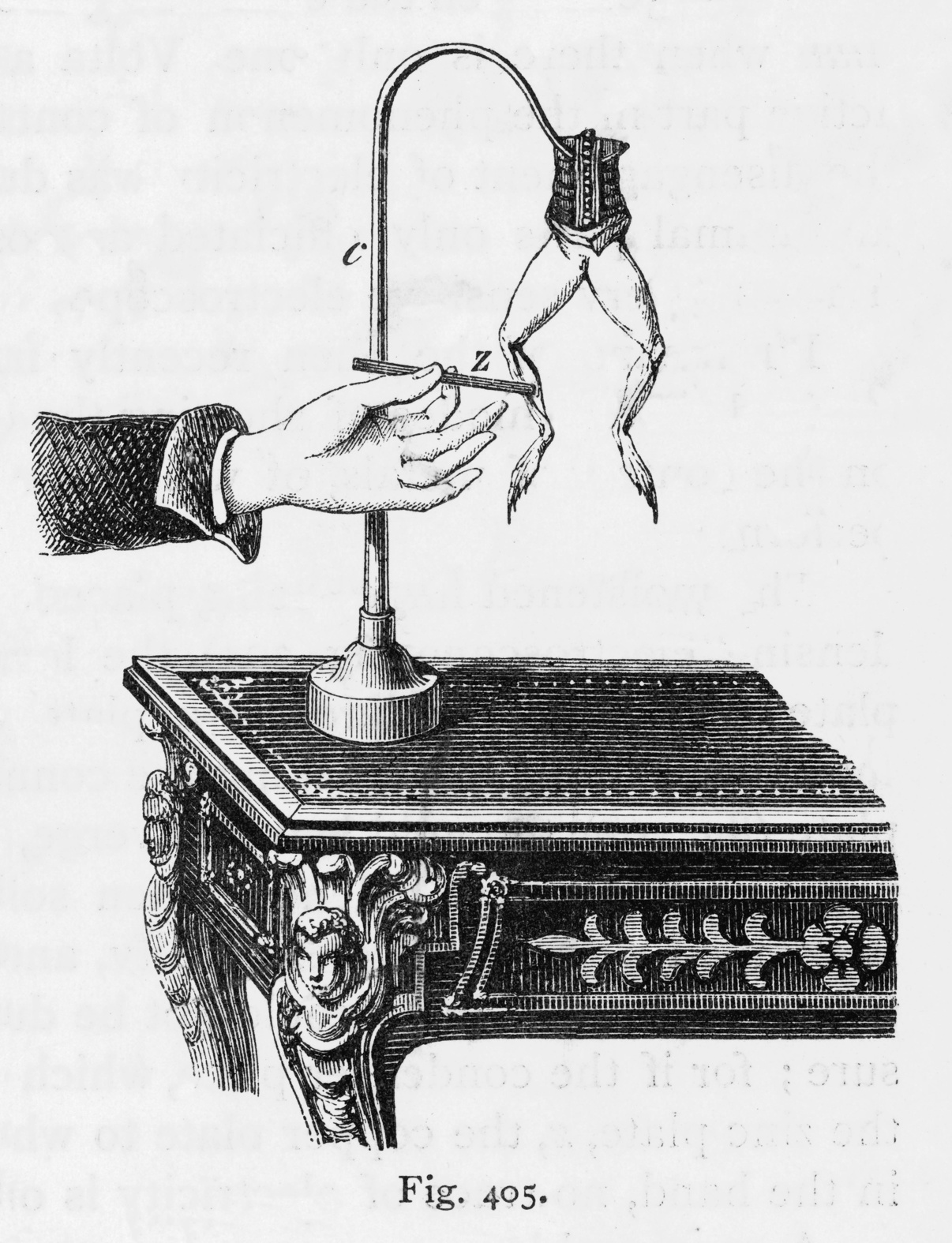
Expérience de Galvani sur une grenouille (image : Archivist Adobe Stock)
Vidéo : Réalisation : François Demerliac ; Auteur scientifique : François Nief et Françoise Brénon ; Production : Fondation de la Maison de la Chimie / Virtuel
Dans ce second épisode les efforts sportifs s’intensifient, voire deviennent brefs et très intenses. Il faut toujours fournir de l’ATP mais les processus de régénération changent et ne font plus appel à l’oxygène.
Si l’effort est intense le métabolisme énergétique utilise toujours du glucose, comme carburant, mais celui-ci évolue selon une voie anaérobie lactique.
Si l’effort est bref et très intense, ce n’est plus le glucose le carburant, mais la phosphorylcréatine et l’évolution est de type anaérobie alactique.
Découvrez « en live » ces différents processus.
Cette vidéo allie les explications à la pratique sportive ! Vous y découvrirez comment l’hydrolyse de l’ATP permet, dans tous les cas, de fournir l’énergie nécessaire à l’effort sportif. Mais, comment le régénérer, lorsqu’on pratique un sport de faible intensité ou d’endurance ? Découvrez pour cela le processus aérobie.
Cette vidéo « lumineuse » nous fait découvrir et comprendre les phénomènes d’émission de lumière accompagnant certaines réactions chimiques. La détection des traces de sang dans les enquêtes policières n’auront plus de secret pour vous !
Comment un composé, soumis à des UV, est-il capable d’émettre de la lumière visible ? Cette vidéo nous en montre de toutes les couleurs et nous fait découvrir des applications dans notre quotidien.
Cette vidéo ludique nous fait découvrir et comprendre comment certains composés, appelés photochromes, sont capables de changer de couleur sous l’effet de la lumière UV ou bleue. C’est par exemple ce phénomène qui est utilisé dans les verres photochromiques.
Avant la soupe, Liebig désignait un chimiste allemand, célèbre réformateur de la chimie organique moderne et fondateur de la chimie agricole. Il promut notamment les qualités de l’extrait de viande, bien plus réparateur que la gélatine extraite des os que l’on donnait en bouillons dans les hospices.
