La dynastie des Becquerel et leur intérêt pour la phosphorescence
Antoine César Becquerel (1788-1878), fondateur de la dynastie des Becquerel au Muséum, a été nommé professeur titulaire de la chaire de Physique appliquée aux sciences naturelles, à sa création en 1838 à l’initiative de Joseph Gay-Lussac. Au cours d’un voyage à Venise, Antoine César avait observé que la nuit, la mer devenait phosphorescente et il a commencé à s’intéresser à ce phénomène.
Son fils Edmond Becquerel (1820-1891) a succédé à son père comme professeur en 1878. On lui doit la découverte de l’effet photovoltaïque (1839) et la réalisation de la première photographie en couleur représentant le spectre solaire sur plaque argentée (1848). Mais ses recherches ont principalement porté sur les différentes formes de luminescence (*), fluorescence et particulièrement la phosphorescence des sels d’uranium. Pour mesurer la durée de phosphorescence, il a inventé le phosphoroscope (1857), appareil permettant de mesurer le temps qu'il faut à un matériau phosphorescent pour cesser de briller après avoir été excité par de la lumière.
Enfin, Henri Becquerel (1852-1908), fils d’Edmond qui lui a succédé comme professeur en 1892, a porté un intérêt scientifique, entre autres sujets, à la phosphorescence de sels d’uranium. Tous ont été polytechniciens, sauf Edmond reçu à cette Ecole, mais qui a préféré travailler dans le laboratoire de son père. Tous ont été membres de l’Académie des sciences.
La découverte des rayons X par Röntgen et sa présentation par Henri Poincaré à l’Académie
En novembre 1895 Wilhelm Conrad Röntgen, professeur à l’université de Würzburg, découvrit les rayons X alors qu’il faisait fonctionner un tube de Crookes dans l'obscurité. Ayant placé ce tube dans l’obscurité, il observa une fluorescence sur un écran en papier recouvert de platinocyanure de baryum. Il a noté que cette fluorescence accompagne la production des rayons X et que si les rayons X ne sont pas visibles par l’œil, ils impressionnent les plaques photographiques, même protégées par du papier noir.
Peu de temps après, le 20 janvier 1896, Henri Poincaré présenta devant ses collègues de l’Académie des sciences, la découverte de Röntgen et attira l’attention d’Henri Becquerel dont il connaissait l’intérêt pour la phosphorescence des sels d’uranium, lui suggérant de voir si elle ne s’accompagnait pas de l’émission de rayons X.
La découverte des rayons uraniques d’Henri Becquerel
Après plusieurs expériences négatives avec différents corps phosphorescents, Becquerel a utilisé des cristaux de sulfate double d’uranyle et de potassium « qu’il avait préparé une quinzaine d’années avant ». Il les déposa sur une plaque photographique « Lumière » soigneusement enveloppée dans du papier noir pour la protéger de la lumière, puis exposa le dispositif plusieurs heures au soleil.
Ensuite, il développa la plaque et observa qu’elle est impressionnée, malgré sa protection par le papier noir. Il en déduisit que les sels d’uranium émettaient des rayons X après excitation par la lumière du soleil et présenta ce résultat à l’Académie dans une note le 24 février 1896 (1).
Puis, il voulut recommencer l’expérience, mais, pendant plusieurs jours, le soleil ne se montra pas. Dans l’attente de son retour, il rangea le dispositif expérimental dans un tiroir à l’obscurité. Quand le 28 février le soleil revint, il reprit son expérience et prépara un nouveau dispositif. Mais il ne jeta pas le dispositif préparé auparavant, pensant que faute de soleil et donc de phosphorescence, la plaque ne serait pratiquement pas impressionnée. Il la développa normalement, et à sa grande surprise l’impression de la plaque restée dans le noir fut beaucoup plus intense que celle de la première expérience. Il en conclut que le sel d’uranium émettait donc spontanément des rayons pénétrants, qu’il ait été ou non exposé à la lumière du soleil et nomma ce rayonnement « rayons uraniques ». Il présenta ce nouveau résultat à l’Académie le 1er mars 1896 (2). C’était là, la découverte capitale d’Henri Becquerel, celle des « rayons uraniques », fruit du hasard dans un esprit préparé d’un expérimentateur rigoureux.
Pierre Curie et son frère Jacques (**), un autre élève de l’Ecole de Chimie d’Edmond Frémy au Muséum, réalisèrent un appareil (quartz-piézzo électrique) qui permettra de faire des recherches quantitatives sur les substances radioactives, les travaux de Becquerel étant purement qualitatifs. Cette possibilité a permis à Marie Curie de découvrir en 1898 dans la pechblende des substances plus radioactives que l’uranium : le polonium et le radium (3) (4). Le nom de « radioactivité » a été donné au phénomène par Marie Curie.
Pour leurs travaux sur la découverte de la radioactivité, le prix Nobel de physique de 1903 a été décerné à Henri Becquerel, Pierre Curie et Marie Curie.

Pierre et Marie Curie dans leur laboratoire parisien, avant 1907
Notes
* Les phénomènes de luminescence, fluorescence ou phosphorescence, apparaissent lorsqu’un corps absorbe la lumière visible ou ultraviolette, puis la réémet à une longueur d’onde plus grande (décalée vers la partie rouge du spectre). Les deux phénomènes de phosphorescence et fluorescence sont quasiment identiques. La différence est que le matériau phosphorescent continue d'émettre de la lumière dans le noir même si on arrête de l'éclairer. Après exposition à la lumière un matériau phosphorescent diffuse la lumière dans le noir alors qu’un matériau fluorescent n'émet pas de lumière dans l'obscurité, mais produit une couleur vive si on l'éclaire.
** Pierre Curie et Jacques, âgés de 21 et 25 ans, découvrent en 1880, la piézoélectricité. L’effet piézoélectrique est une propriété de certains cristaux, comme le quartz, d’émettre de petites quantités d’électricité lorsqu’ils sont comprimés ou étirés. En 1885, ils font construire un instrument pour leur laboratoire, qu’ils appellent tout simplement “quartz piézoélectrique”. Cet instrument, permet de faire des mesures quantitatives de la radioactivité d’échantillons. Cet instrument est introduit par Marie et Pierre Curie dès 1898 dans leur méthode de mesure de la radioactivité, appelée aujourd’hui « méthode Curie ». Lors de cette mesure, les deux scientifiques compensent la charge électrique inconnue produite par l’échantillon radioactif, avec la charge électrique connue générée par le quartz. La méthode de compensation leur permet de mesurer, en utilisant un électromètre à quadrant, des courants très faibles, de l’ordre de 10-13 ampères. Ces mesures, très précises, leur permettent de détecter dès 1898, dans les minerais d’uranium, la présence de quantités infimes de deux nouveaux éléments chimiques radioactifs : le polonium et le radium. « Pour mesurer les courants très faibles que l’on peut faire passer dans l’air ionisé par les rayons de l’uranium, j’avais à ma disposition une méthode excellente étudiée et appliquée par Pierre et Jacques Curie. » Marie Curie, Pierre Curie, 1923.
Bibliographie
1 - Henri Becquerel. Sur les radiations émises par phosphorescence. C.R. Acad. Sci. 122 (1896) p. 420-421.
2 - Henri Becquerel. Sur les radiations invisibles émises par les corps phosphorescents. C.R. Acad. Sci. 122 (1896) p. 501-503.
3 - Pierre Curie et Marie Curie, Sur une substance nouvelle radio-active (polonium), contenue dans la pechblende. C.R. Acad. Sci. 127 (1898) p.175-178.
4 - Pierre Curie, Marie Curie et Gustave Bémont, Sur une nouvelle substance fortement radio-active (radium), contenue dans la pechblende. C.R. Acad. Sci. 127 (1898) p. 1215-1217.
Illustration : Pierre et Marie Curie dans leur laboratoire parisien, avant 1907. Source : Wikimedia commons
La découverte de la radioactivité par Henri Becquerel, Pierre et Marie Curie remonte à plus d’un siècle (1896-1898) et a conduit à leur décerner le prix Nobel de physique en 1903. Toutefois, des énigmes marquent le début de cette découverte.
Quand des élèves de Frémy discutent entre eux
Gabriel Bertrand dans un article publié en 1946 aux Comptes Rendus de l’Académie des Sciences, rapporte une histoire intrigante « Sur l’origine de la découverte de la Radioactivité » lorsqu’il travaillait encore au Muséum (1).
Mais qui était Gabriel Bertrand (1867-1962) ? Après avoir suivi les cours de l’École de chimie d’Edmond Frémy au Muséum, il s'inscrit à l'École supérieure de pharmacie et devient pharmacien en 1894. Il reste au Muséum, d'abord comme préparateur de Léon Maquenne (1889), au laboratoire de Physiologie végétale appliquée à l’agriculture de P.P. Dehérain, et ensuite, à 23 ans il est nommé préparateur à la chaire de Chimie appliquée aux corps organiques dirigée par le professeur Albert Arnaud successeur de Chevreul au Muséum. Puis en 1897, Émile Duclaux, qui avait succédé à Pasteur à la direction de l'Institut Pasteur, l'appelle au poste de chef de service. Gabriel Bertrand soutient sa thèse de doctorat en 1904, sur la biochimie de la bactérie du sorbose, ce qui lui vaut d'être nommé chargé de cours à la Sorbonne en 1905. Titulaire de la chaire de chimie biologique de cette l'université, il restera simultanément chef de service à l'Institut Pasteur.
Dans cet article de 1946 mentionné en préambule, Gabriel Bertrand rapporte un échange qu’il a eu avec Henri Becquerel en 1893 (1) (2). Rappelons que ce dernier a découvert et publié les propriétés des rayons uraniques trois ans plus tard, au début de 1896. Bertrand écrit : « Notre illustre Confrère vint un jour me voir au laboratoire que j’occupais dans la rotonde de l’amphithéâtre du Muséum, à quelques pas de la maison qu’il habitait et du laboratoire où il travaillait (maison de Cuvier). Il me présenta un petit bloc noir que je reconnus immédiatement à son aspect et à sa densité pour de la pechblende. Il avait enfermé dans un tiroir une plaque photographique, enveloppée dans du papier à aiguilles, après avoir posé dessus le morceau de pechblende. Lorsque, après quelques jours, il se servit de la plaque, une grande tache apparut au développement, tache qu’il reconnut de la grandeur et de la forme du morceau de pechblende. Pouvez-vous, ajouta-t-il en terminant, me donner comme chimiste une explication de ce phénomène ?
J’avais eu l’occasion d’étudier la pechblende quelques années avant dans le laboratoire de Frémy et d’en faire une analyse aussi complète que possible. Je répondis à Henri Becquerel que ce minerai était ordinairement très complexe, pouvait contenir des sulfures, que sous l’influence de l’air humide son échantillon avait peut-être dégagé des traces d’hydrogène sulfuré, imperceptibles à l’odorat, mais auquel la couche de gélatino-bromure d’agent était très sensible. Etant donnée la compacité de la pechblende, je ne tenais pas cette explication pour très probable, mais elle n’était pas impossible.
Quelques jours plus tard, H. Becquerel revint me voir et m’informa que mon explication n’était pas exacte mais, ajouta-t-il, j’en ai trouvé une. Je n’eus pas l’indiscrétion de lui demander en quoi elle consistait…. C’est la première observation qui fut faite par Becquerel de la radioactivité (rayons uraniques). L’impression fortuite d’une tache provoquée par la pechblende sur une plaque photographique. A quelle date se situe cette observation mémorable ? Elle est très notablement et même curieusement antérieure aux publications de 1896. Alors Becquerel n’était plus mon voisin. La chaire de chimie avait quitté le grand amphithéâtre et s’était installée au 63 rue Buffon (dans les locaux de l’école de Frémy, puis fermée en 1894). Ce devait être avant la fin de 1893. Mais on ne saura avec certitude ce qui s’est passé dans le laboratoire de physique du Muséum, entre 1893 et 1896 ».
Niépce de Saint-Victor : de la photographie aux rayons invisibles émis par les sels d’uranium ou une énigme peut en cacher une autre
De quelles informations H. Becquerel avait-il connaissance en 1893 ? Connaissait-il les travaux de Niépce de Saint-Victor, cousin de Nicéphore Niépce l’inventeur de la photographie. Ses expériences dans les années 1857-1867 utilisaient la photographie et recherchaient si la lumière pouvait se stocker dans des corps, autrement que par la phosphorescence ou la fluorescence (*). Niépce de Saint-Victor avait observé, par ce qu’il nommait une « photographie de l’invisible », qu’il ne s’agissait pas d’une phosphorescence, mais d’un rayonnement invisible ne traversant pas le verre. Niépce exposait à la lumière solaire une feuille de carton imprégnée d’une solution de sel d’urane formant un dessin, après insolation il l’appliquait sur une feuille de papier sensible et disposait le tout dans un tube métallique bouché, à l’obscurité. Le dessin se reproduisait en impressionnant le papier sensible. Bref, il avait observé un rayonnement particulier de l’uranium et ses observations avaient été transmises à l’Académie des Sciences par Eugène Chevreul.
En 1861, Niépce avait remarqué que le carton conservé à l’obscurité est encore actif six mois après son insolation. Une substance très efficace pour ces expériences était une solution aqueuse d’acétate d’uranium dont il imprégnait la feuille de papier. Cette activité à distance n’était donc pas due à la phosphorescence. Les travaux décrits dans les mémoires de Niépce de Saint-Victor sur la lumière, ses causes et ses effets étaient connus d’Edmond Becquerel. Il avait également remarqué que ce ne pouvait être dû à un phénomène de phosphorescence, dont la durée n’est pas aussi longue.
Niépce de Saint-Victor avait-il découvert l’activité des rayons uraniques avant Henri Becquerel ? Ce n’est pas clair, mais les Becquerel connaissaient très vraisemblablement les travaux de Niépce. Paul et Josette Fournier (3) ont bien mis en évidence la complexité des filiations pour aboutir à la découverte de la radioactivité, en particulier dans les recherches sur la photographie et la luminescence* qui préoccupaient physiciens et chimistes dans la deuxième moitié du XIXe siècle.

Photographie de Henri Becquerel par Paul Nadar
Note
* Les phénomènes de luminescence, fluorescence ou phosphorescence, apparaissent lorsqu’un corps absorbe la lumière visible ou ultraviolette, puis la réémet à une longueur d’onde plus grande (décalée vers la partie rouge du spectre). Les deux phénomènes de phosphorescence et fluorescence sont quasiment identiques. La différence est que le matériau phosphorescent continue d'émettre de la lumière dans le noir même si on arrête de l'éclairer. Après exposition à la lumière un matériau phosphorescent diffuse la lumière dans le noir alors qu’un matériau fluorescent n'émet pas de lumière dans l'obscurité, mais produit une couleur vive si on l'éclaire.
Bibliographie
1 - Gabriel Bertrand. Sur l’origine de la découverte de la Radioactivité. C.R. Acad. Sci., 223 (1946) p. 698-700.
2 - Michel Genet. La découverte des rayons uraniques : un petit pas pour Henri Becquerel, mais un grand pas pour la science. L’Actualité chimique, n° 220 (1998) p. 34-41.
3 - Paul Fournier et Josette Fournier. Hasard ou mémoire dans la découverte de la radioactivité. Rev. Hist. Sci., 52 (1999) p. 51-79. - Paul Fournier et Josette Fournier. Découverte de la radioactivité. Mediachimie.org. Petites histoires de la chimie.
Illustration : Photographie de Henri Becquerel par Paul Nadar / Adam Cuerden, Wikimedia Commons. Source de l'image : gallica.bnf.fr / BnF
 |
Expériences : vidéos et protocoles
|
Expériences : vidéos et protocoles
Rubrique(s) : Événements
Mediachimie.org vous propose un ensemble de ressources liées à l’enseignement des sciences expérimentales. Parcourez cette page listant des vidéos de présentations d’expériences, de techniques d’analyse ou de techniques expérimentales. Découvrez des protocoles testés et validés d’expériences de fluorescence et de chimiluminescence.
Vous trouverez également des ressources à explorer dans nos différentes séries :
- Fiches Chimie et… produites par la Fondation de la Maison de la chimie en partenariat pour la plupart avec le ministère de l'Éducation nationale :
- Dossiers pédagogiques lycée (séries générales et technologiques) réalisés par Nathan en partenariat avec la Fondation de la Maison de la chimie et Mediachimie
- Des ressources pour l'orientation
Enfin si l’utilisation des microcontrôleurs en physique-chimie dans le cadre des nouveaux programmes de physique-chimie du lycée vous intéresse, vous pouvez également regarder des ressources proposées par L’Actualité chimique :
Modes opératoires, liste produits et matériels ; conseils et notions à développer, explications.
Les modes opératoires proposés permettent de mettre en évidence l’interaction lumière matière et tout particulièrement l’excitation de molécules par l’absorption du rayonnement UV puis l’émission de lumière colorée par ces mêmes molécules lors de la désactivation.
Objets de ces 3 expériences
- Expérience 1 - Émission de lumière colorée par une molécule fluorescente soumise aux UV
La luminescence est un phénomène d’émission de lumière, ici visible donc colorée, par réarrangement électronique dans une molécule, par suite d’excitation de celle-ci par les UV. Quand ce phénomène n’a lieu que durant l’exposition à une source énergétique et cesse avec l’arrêt de l’exposition, le phénomène est appelé fluorescence (étudié ici). Si le phénomène perdure après l’arrêt à l’exposition aux UV il s’agit de phosphorescence (ce 2ème phénomène n’est pas étudié dans ces 3 expériences). - Expérience 2 - Chimiluminescence : émission de lumière provoquée par une réaction chimique réalisée avec le luminol
La chimiluminescence consiste en une émission de lumière visible provoquée par une réaction chimique. - Expérience 3 - Expérience combinée de chimiluminescence et de fluorescence réalisée avec du luminol et de la fluorescéine
Il est possible de combiner le phénomène de chimiluminescence et de fluorescence. Il y a alors émission de lumière visible par une molécule fluorescente préalablement excitée par l’énergie libérée par une réaction chimique.
Acquis préalables et notions générales à faire comprendre au cours des expériences
Rappeler que la lumière blanche est composée de lumières colorées et présenter un spectre obtenu par décomposition de la lumière blanche.
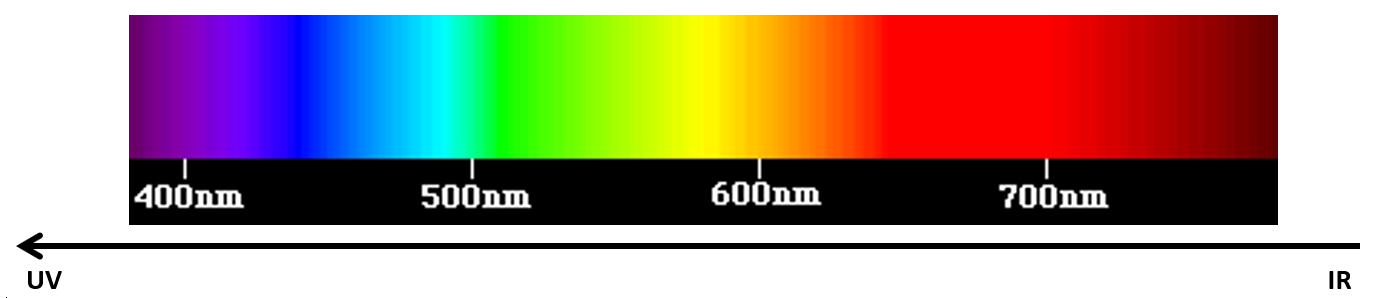
Spectre de la lumière visible
Rappeler que la lumière blanche est la superposition intégrale de toutes ces lumières (synthèse additive).
Observer que lorsqu’on va du rouge vers le bleu on va vers des rayonnements de plus en plus énergétiques.
Les UV sont des rayonnements de forte énergie (juste à gauche du violet sur le graphe) mais invisibles à nos yeux (ils nous paraissent incolores).
Faire comprendre la notion de niveau d’énergie et d’excitation des molécules puis de retour à un état plus stable.
Accompagner éventuellement le discours d’une représentation graphique des niveaux d'énergie.
Faire comprendre que s’il y a émission de lumière colorée par une molécule cela diffère de la couleur des objets qui nous entourent, qui elle résulte de l’absorption d’une partie de la lumière blanche provenant du soleil (absorption sélective ou synthèse soustractive).
Faire observer que le phénomène de fluorescence n'est observable que durant l'exposition à une source d’énergie (UV ou libération d’énergie provoquée par une réaction chimique) et que cela cesse dès qu'on arrête l'excitation.
Expérience 1 - Émission de lumière colorée par une molécule fluorescente soumise aux UV
Matériel
- 2 récipients au choix (éprouvette, bécher de 150 ou 200 mL, fiole jaugée ….) le plus photogénique !
- 1 lampe UV 365 nm
Produits
- Fluorescéine : en faire une solution bien jaune
- Schweppes® tonic (seul le tonic contient de la quinine)
- Papier blanc
- Surligneurs « fluos » de diverses couleurs
Mode opératoire
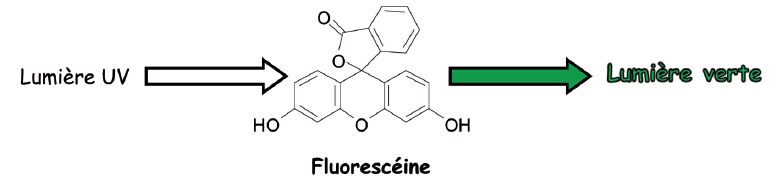
- Introduire dans le récipient choisi la solution de fluorescéine. Observer la couleur jaune à la lumière du jour (cette couleur jaune résulte de l’absorption sélective du bleu par la fluorescéine).
- Éclairer par la lampe UV et observer la lumière verte « flashie » (ou vert brillant) qui apparait sous UV et disparait sans UV.
- Insister ici sur le fait qu'il y a émission de lumière par la molécule (c’est ce qui donne l’aspect brillant).
- Puis arrêter les UV et retrouver la couleur jaune mat (sans émission de lumière).
- Faire de même avec du Schweppes® tonic. On observe une lumière bleue.
- Faire de même avec papier blanc. On observe une lumière bleue.
- Faire de même avec des encres de surligneurs préalablement étalées sur un papier.
Explications à adapter selon le public, élèves de lycée ou grand public
La fluorescéine est une molécule qui présente en son sein des électrons qui peuvent acquérir de l’énergie, cad monter à un niveau supérieur instable. Les électrons sont dits dans un état excité et tendent à revenir à un état stable. Lors de ce retour à l’état stable, ils émettent de l’énergie sous forme lumineuse. Ici il s’agit de la lumière verte.
Ce phénomène s’arrête si on éteint la lampe UV. Ce phénomène est appelé fluorescence. Et la fluorescéine est dite une molécule fluorescente.
On peut proposer un résumé du type :
Source : Le laboratoire des couleurs – Anne Guillerand - BUP vol. 104 ( Déc. 2010)
Avec du Schweppes® on observe une lumière brillante bleue sous UV. Elle est dû à la molécule fluorescente de quinine présente dans le Schweppes®.
.png)
formule de la quinine
Avec du papier blanc
Pourquoi observe-t-on que le papier blanc émet du bleu quand on l’éclaire par la lampe UV ?
Dans la composition du papier il a été ajouté des produits fluorescents dits azurants (comme l’azur : bleu).
Pour faire un lien avec la vie de tous les jours, on trouve aussi ces additifs dans les lessives pour améliorer la sensation de blanc des tissus (« plus blanc que blanc » comme disent certaines publicités ou comme le caricaturait Coluche). Cette impression est due au fait que la lumière du soleil contient aussi des UV qui excitent les électrons des azurants.
C’est le même effet que l’on observe avec les chemises blanches dans les boites de nuits où l’on danse en lumière dite noire (qui sont en réalité des UV proches du visible).
Le phénomène est le même avec les traces de surligneurs qui ont été étalées sur du papier. Leur encre visible et résistante à la lumière sans pour autant masquer le texte lui-même,contient des agents fluorescents.
On peut citer d’autres composés fluorescents connus :
- Nombreux minéraux : fluorites (à l’origine du nom de la propriété), quartz, topaze…
- Monde végétal et vivant : chlorophylle, certains champignons, scorpions…
- Produit pharmaceutique : éosine
- Tubes d’éclairage fluorescents
- Utilisation de cette propriété dans l'art, aussi bien dans des peintures utilisant des pigments fluorescents que pour analyser les constituants des couches supérieures de peintures
- Utilisation pour certains diagnostics médicaux
Expérience 2 - Chimiluminescence : émission de lumière provoquée par une réaction chimique réalisée avec le luminol
Matériel
- 1 balance au 1/100e avec capsules plastiques pour pesées + spatules
- 2 grandes éprouvettes de 500 mL
- 1 très grande éprouvette de 1000 mL
- 2 éprouvettes de 5 mL ou pipettes graduées de 5 mL
- 1 pipette graduée de 3 mL ou 5 mL
- 1 propipette
- 1 cristallisoir
Produits
- luminol 0,1 g (le nom du luminol en nomenclature est la 5-amino-1,2,3,4-tétrahydrophtalazine-1,4-dione)
- solution d’hydroxyde de sodium NaOH (soude) à 10% 5 mL
- eau distillée (1 L)
- ferricyanure de potassium (ou (hexacyanoferrate(III) de potassium) solide 1,5 g
- eau oxygénée (ou solution aqueuse de peroxyde d’hydrogène) à 30% (3 mL)
Mode opératoire
- Préparer sous hotte devant le public ou avoir préparé à l’avance (sauf l’ajout de l’eau oxygénée qui doit se faire au dernier moment)
- Éprouvette A (ou fiole jaugée A facile à boucher si réalisée à l’avance) : dissoudre 0,1 g de luminol dans 400 mL d’eau et ajouter 5 mL de soude à 10%.
- Éprouvette ou fiole jaugée B : dissoudre 1,5 g de ferricyanure de potassium dans 400 mL d’eau. Ajouter à la dernière minute 3 mL d’eau oxygénée à 30%
- Rendre sombre la pièce, verser simultanément le contenu des 2 éprouvettes A et B dans un grand entonnoir déposé sur la grande éprouvette à pied : il se produit une magnifique lumière bleue !
On peut aussi dans l’éprouvette B ne mettre que l’eau et l’eau oxygénée et le mode opératoire est alors le suivant.
Introduire quelques cristaux de ferricyanure de potassium solide dans la grande éprouvette où aura lieu l’expérience. Rendre sombre la pièce, verser simultanément le contenu des 2 éprouvettes A et B via un grand entonnoir dans la grande éprouvette à pied : il se produit une magnifique lumière bleue !
Notions à développer sous forme de commentaires et à adapter selon le public pendant la démonstration
Présentation préalable des produits présents dans les éprouvettes :
Éprouvette B :
L’eau oxygénée : que tout le monde connait et a dans sa pharmacie ; mais ici elle est beaucoup plus concentrée. C’est un produit très réactif et oxydant, surtout si elle est concentrée.
Le ferricyanure est un composé contenant du fer à l’état oxydé [Fe (III)] C’est ici un catalyseur c’est à dire un produit qui va accélérer la réaction que l’on veut observer.
Éprouvette A :
La soude : elle créé un milieu basique propice à la réaction (on peut dire que tout le monde connait la soude soit sous ce nom soit sous forme de Destop par exemple et en a dans sa cuisine sous les lavabos !! ce qu’il ne faut pas faire pour protéger les enfants !!!).
Le luminol est une molécule complexe fragile en présence d’oxydant telle que l’eau oxygénée.
Si le public est un peu plus averti on peut ajouter que la fragilité concerne une partie seulement de la molécule, là où il y a 2 atomes d’azote liés entre eux. On peut aussi montrer le dessin de la molécule ou un modèle moléculaire et montrer les 2 atomes d’azote concernés.
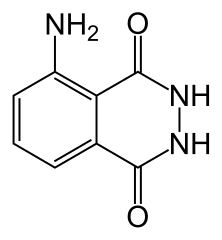
formule du luminol
Explications
Quand les 4 produits sont mis en contact, le luminol et l’eau oxygénée en milieu basique, en présence de ferricynanure de potassium (comme catalyseur) réagissent vivement (ce qui libère une forte énergie) et il se forme du diazote, de l’eau et un di-anion aminophtalate dérivé du luminol, dans un état excité. Cet état résulte de l’énergie libérée par la réaction. Puis ce di-anion se désactive et émet une lumière bleue. La réaction chimique a ainsi créé de l’énergie que l’on observe sous forme lumineuse.
On peut proposer un résumé du type :
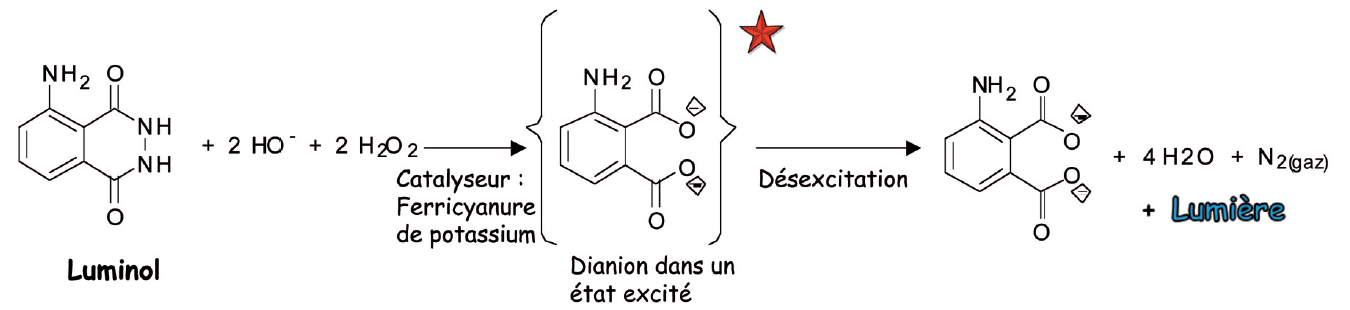
Source : Le laboratoire des couleurs – Anne Guillerand - BUP vol. 104 ( Déc. 2010)
Exemples dans la vie courante
- Cette expérience est réalisée par la police scientifique pour rechercher des traces de sang. En effet l’hémoglobine du sang contient du fer à l’état oxydé Fe(II) qui en présence de l’eau oxygénée passe à l’état de Fer(III) qui joue alors le rôle de catalyseur (à la place du ferricyanure que nous avons utilisé). Ce procédé a été repris dans un certain nombre de séries TV policières !
- Dans le monde animal, tout le monde a eu l’occasion de voir, lors de promenades nocturnes, des vers luisants ou des lucioles émettre des petites lumières jaunes à verdâtre. Cette lumière résulte d’une réaction chimique, propre à l’animal, dans le corps de la luciole. On parle aussi de bioluminescence. Ces émissions de lumière permettent aux couples de se trouver pour assurer la reproduction.
- Certains planctons et phytoplanctons sont aussi bioluminescents. Ce processus pouvant à la fois servir selon l’espèce pour le camouflage, l’attraction sexuelle, mais aussi la répulsion ou la communication.
Si on est en présence d’un public un peu plus averti, on peut préciser que dans les réactions de bioluminescence observées dans divers organismes vivants, le composé chimique à l'origine de la luminescence est presque toujours la luciférine. Celle-ci émet de la lumière en subissant une oxydation par le dioxygène grâce à l'intervention d’une enzyme, la luciférase qui joue le rôle de catalyseur.
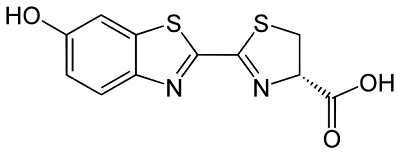
formule de la luciférine
Expérience 3 - Expérience combinée de chimiluminescence et de fluorescence réalisée avec du luminol et de la fluorescéine
- Même matériel et mêmes produits qu’en 2 + solution de fluorescéine ou fluorescéine en poudre.
- Même mode opératoire qu’en 2, mais ajouter dans la solution A initiale de la fluorescéine en poudre ou en solution, de manière à obtenir une solution bien jaune.
- On peut sans doute utiliser pour cette derrière expérience les produits en quantités divisées par 2.
- Observer alors une lumière verte
Explications
La même réaction chimique du luminol et de l’eau oxygénée conduit au di-anion qui en se désactivant excite la molécule de fluorescéine. Celle-ci en se désactivant à son tour donne la couleur verte qu’elle émettait sous UV (rappel de la 1ère expérience).
Cela peut avoir lieu avec tout autre molécule fluorescente ajoutée. On obtiendra l’émission de la couleur caractéristique de la molécule ajoutée.
Exemples dans la vie courante
Les bâtons lumineux festifs que l’on peut acheter lors de concerts ou fêtes et que l’on doit casser délicatement. Lors de la fracture du petit tube de verre intérieur, qui séparait les produits, les réactifs sont mis en contact et il se produit une réaction comparable à celle que nous venons d’observer, avec l’eau oxygénée, le luminol et la fluorescéine.
Il y a différentes couleurs selon les réactifs fluorescents introduits dans chacun des bâtons.
Le phénomène s’arrête quand tous les produits chimiques contenus dans le bâton ont été consommés.
Illustration : Capture d'écran vidéo Fluorescence © Mediachimie/Blablareau au labo
Source : luminol, fluorescéine, UV, émission de lumière, bioluminescence, investigation policière, sang,
 |
Pourquoi les champions de marathon sont-ils presque tous des Africains vivant en altitude ?
|
Pourquoi les champions de marathon sont-ils presque tous des Africains vivant en altitude ?
Rubrique(s) : Question du mois

L'athlète kényan Kelvin Kiptum, qui avait battu le record du monde du marathon en 2 h 00 min 35 s lors du marathon de Chicago le 8 octobre dernier, soit 34 secondes de mieux que le précédent record établi par le double champion olympique kényan Eliud Kipchoge lors du marathon de Berlin en 2022, est décédé dans un accident de la circulation ce 11 février 2024. Quand on pense que de 2000 à 2020, sauf en 2004 où c’était un Italien, ce sont des Kényans, Éthiopiens et Ougandais qui ont été médaillés d'or, et que de 1956 (1) à 2000 on a eu pour chaque olympiade des Africains sur le podium du marathon, on peut croire qu'il ne s'agit pas d'une coïncidence. Alors, quelle est l’explication ?
Explications plausibles
Il y a probablement une part d'explication que les outils des sciences sociales permettent de comprendre : les Africains ne participent aux jeux que relativement récemment. Les meilleurs sportifs préfèrent l'athlétisme sur piste et le marathon a mis plus de temps à être pratiqué que les autres distances. On ne trouve pas de marathoniens ivoiriens, togolais ou namibiens, mais essentiellement des Éthiopiens ou des Kényans. Pourquoi ?
Il y a une raison physiologique : ces pays ont des altitudes moyennes d'environ 1300 m et comportent de hauts plateaux (Vallée du Rift). Les populations vivent donc le plus souvent en altitude. Or en altitude, par suite de la baisse de la quantité d'oxygène, il y a augmentation de la fréquence cardiaque. Au bout d'un certain temps, l'organisme augmente sa production d'érythropoiétine, l'hormone qui dirige la synthèse des globules rouges. Ces globules devenant plus nombreux, il y a un meilleur transport d'oxygène et la fréquence cardiaque peut diminuer, ainsi que l'essoufflement. Et ces effets durent plusieurs semaines. C'est aussi pourquoi les athlètes vont s'entraîner en altitude (le Centre national d'entraînement en altitude de Font-Romeu est à 1850 m).
Vivant en altitude, Kényans ou Éthiopiens ont des modes de vie proches : les enfants vont à l'école à pied, souvent en courant, car c'est loin. Le parcours est accidenté et ils ne portent pas de chaussures de sport ; ils sont souvent pieds nus (cela leur donne un meilleur style de course les forçant à atterrir sur la pointe du pied). Cela leur procure un "entraînement" constant en altitude. Enfin les modes de vie restent rigoureux, et ils font tout à pied. On lira avec profit le travail de fin d'études de Nicolas Tilman (2). La nourriture est moins riche, et ils sont minces (Eliud Kipchoge, médaille d'or en 2020 mesure 1,67 m et pèse 52 kg), avec " de petits mollets ". C'est très important d'après le physiologiste Bengt Saltin (3) (4) car avec en moyenne 400 g de moins pour chaque jambe, il leur faut environ 8% de moins d'énergie pour la soulever. Ils utilisent aussi plus d'oxygène dans chaque inspiration, car leurs nombreux trajets à pied en courant ont augmenté leur capacité VO2(i). Selon Véronique Billat (5), directrice du laboratoire d'étude de la physiologie de l'exercice de l'INSERM, les Kényans courent par à-coups à l'entraînement, placent des accélérations, ralentissent, repartent et cela sur des terrains accidentés ; ils développent ainsi des fibres musculaires intermédiaires, entre lentes et rapides.
Fonctionnement de l'hémoglobine
L'organisme humain n'a que peu de réserve en oxygène. Il lui faut donc constamment en absorber. C'est le rôle de la respiration. Le transport de cet oxygène des poumons vers les organes qui en ont besoin se fait grâce à l'hémoglobine des globules rouges. Les muscles vont stocker cet oxygène grâce à une protéine, la myoglobine.
La myoglobine (figure 1) est une protéine contenant un hème (figure 2), où peut s'insérer un ion Fer(II), Fe2+. C'est lui qui fixe l'oxygène, donnant l'oxy-myoglobine.
L'hémoglobine (figure 3) est un tétramère, dont chaque sous-unité est proche de la myoglobine. Elle contient donc 4 ions Fe(II), Fe2+, et peut fixer jusqu'à 4 molécules de dioxygène(ii). Mais si on regarde les courbes de fixation du dioxygène sur ces deux protéines (figure 4), on voit une différence : la myoglobine le fixe rapidement et est vite saturée (à une pression partielle d'environ 25 mmHg). L’hémoglobine a une fixation sigmoïdale : elle fixe peu de dioxygène à faible pression partielle, puis de plus en plus ensuite à mesure que la pression est élevée. Cette différence vient de l'interaction entre les sous-unités de l'hémoglobine : la fixation du dioxygène modifie la structure de la protéine, la rendant plus apte à en fixer. On dit qu'il y a coopérativité entre les sous-unités. Ce phénomène se dénomme allostérie, phénomène découvert à l'Institut Pasteur par François Jacob et Jacques Monod (Prix Nobel 1965).

Figure 1. Myoglobine. Source : Wikimedia Commons. Domaine public.
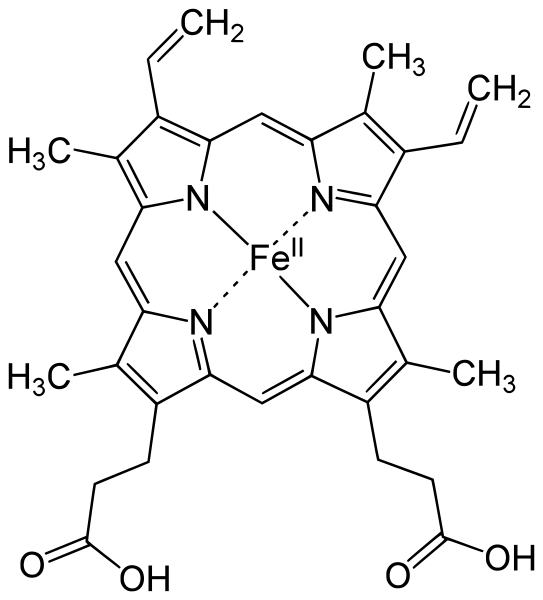
Figure 2. Hème. Il s'agit d'une porphyrine, molécule formée de 4 cycles pyrroliques. Un Fe2+ se trouve au centre. On trouve des tétrapyrroles dans d'autres molécules biologiques, comme la chlorophylle, où c'est un Mg2+ qui est au centre. Source : Wikimedia Commons. Domaine public.
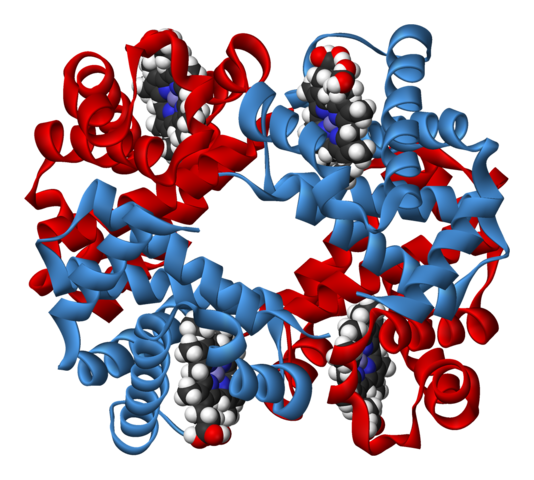
Figure 3. Hémoglobine. Il y a 4 sous-unités, semblables à la myoglobine.On voit les 4 porphyrines. Source : Wikimedia Commons. Domaine public.
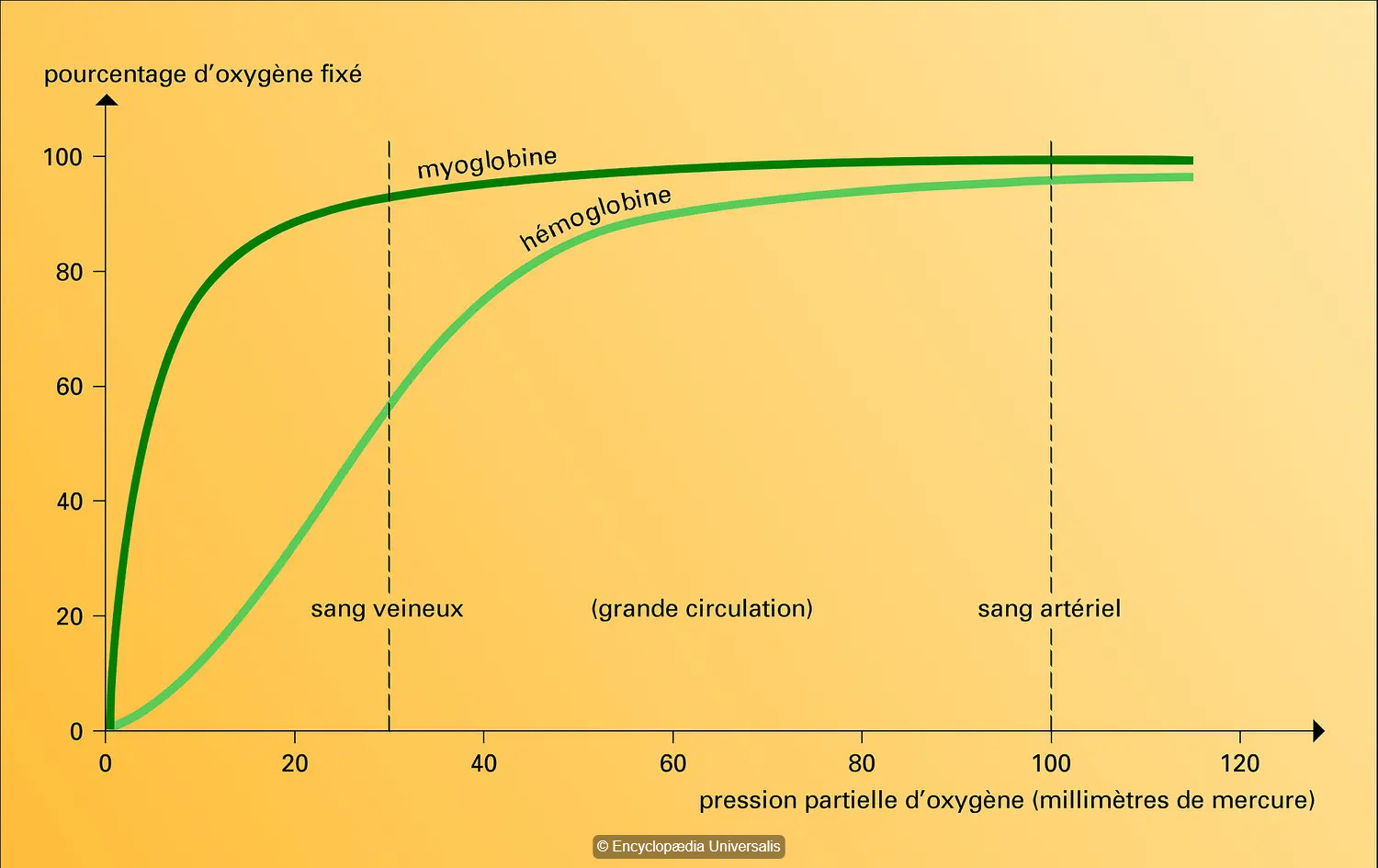
Fig. 4 Fixation de l'oxygène par la myoglobine et l'hémoglobine. © Encylopaedia Universalis sous licence CC BY-NC
Les conséquences sont que :
- au niveau des poumons où la pression en oxygène est forte, l'hémoglobine le fixera aisément, à 100% (plateau). Elle est alors de couleur rouge vif (sang artériel)
- au niveau des organes, la pression est faible, donc l’affinité diminue, et la protéine accepte de donner son oxygène, là encore de manière allostérique : le départ de chaque oxygène rend le départ du suivant plus facile. Elle devient alors rouge foncé, proche du bleu (sang veineux). On n’a pas cette régulation pour la myoglobine, pour laquelle l’affinité est toujours forte, supérieure à celle de l'hémoglobine : elle ne perd donc pas son oxygène, même à faible pression partielle et est donc capable de le stocker dans les muscles.
Pour en revenir à nos athlètes, on comprend pourquoi l'entraînement en altitude, en augmentant la quantité de globules rouges, donc d'hémoglobine, donc la capacité à fixer et transporter l'oxygène permet à leurs muscles de mieux résister à la fatigue. Si on associe l'altitude à un mode de vie conduisant à un entraînement (involontaire) dès l'enfance, on comprend mieux les performances des athlètes d'Afrique de l'Est, sans avoir besoin de rechercher d'éventuelles caractéristiques génétiques.
Nicole Moreau
(i) La consommation maximale d'oxygène ou VO2 max est le volume maximal de dioxygène qu'un sujet humain peut consommer par unité de temps lors d'un exercice dynamique aérobie maximal. Rapportée à l'unité de masse corporelle, elle s'exprime en ml/min/kg. Cette valeur est un excellent indicateur de la performance potentielle du sujet dans les épreuves d'endurance : plus elle est élevée, meilleure sera la performance éventuellement réalisée.
(ii) L'hémoglobine fixe aussi le CO2, et participe à son élimination de l'organisme. A noter aussi l'affinité de l'hémoglobine pour le monoxyde de carbone, CO et l'ion cyanure CN-, d'où la toxicité de ces éléments.
Pour en savoir plus
(1) En 1956, Abebe Bikila, médaille d'or, Éthiopien, avait couru pieds nus ! Il réitérera son exploit en 1960, mais avec des chaussures.
(2) Cité par Véronique Billat La course à pied. Une histoire de Noirs. Origines d’une telle suprématie de Nicolas Tilman
(3) Bengt Saltin (1935–2014), Bangsbo J, Kjær M, Hellsten Y., J Physiol. 2014 Dec 1;592(23):5149-51. doi: 10.1113/jphysiol.2014.285411
(4) Mollets noirs et blancs mollets, Revue Jeune Afrique (2004)
(5) Fiche Wikipedia relative à Véronique Billat
Illustration : Marathon de Francfort (2017), JeLuF, travail personnel, CC BY-SA 4.0, Lien
 |
Des textiles d'athlètes pour les volontaires des JOP Paris 2024
|
Des textiles d'athlètes pour les volontaires des JOP Paris 2024
Rubrique(s) : Éditorial

À J -125, la tenue des 45 000 volontaires des Jeux Olympiques et Paralympiques élaborée par Décathlon a été dévoilée. Ces tenues, puisque plusieurs pièces (chaussures, chaussette, pantalon double fonction, tee-shirts, chapeau, banane, marinière transformable, chapeau, sac) constituent ce bagage vestimentaire, ont été testées par les athlètes et élaborées par le fabricant en répondant aux critères suivants : déperlance, élasticité, résistance, ergonomie.
Cet uniforme des volontaires fortement identifiable allie fonctionnalité et confort. Il est annoncé comme éco-conçu, moderne et modulable. Dans une volonté d’éco-conception et d’éco-responsabilité, l’ensemble de cette panoplie, unisexe, a été réalisée avec une part importante de Made in France.
La chimie, une fois de plus, a œuvré pour proposer des textiles adaptés aux volontaires. Si dans ce cas la quête de performances sportives n’est pas de mise, il n’empêche que les textiles proposés répondent en tous points à ceux des sportifs de haut niveau et donc aux contraintes de température extérieure, de température du corps et aux critères fixés ci-dessus par le COJO.
Pour en savoir plus sur le sujet consultez nos articles :
- Des textiles pour sportifs. Apport de la chimie pour améliorer confort et performances
- La chimie dans le sport : chimie et matériaux
- Combinaisons en néoprène® calcaire ou en néoprène® aux coquilles d’huîtres : renouvelables ou non ? (Question du Mois)
- Sport et chimie (liste de ressources)
Alors ouvrons grands les jeux !
Jean Gomez
Crédit illustration : © Paris 2024 x Decathlon
 |
GPJJC 2024 - Investigations
|
GPJJC 2024 - Investigations
Rubrique(s) : Événements

Des étudiants en journalisme partent à la conquête de la Chimie ! La Fondation de la Maison de la Chimie a lancé le Grand Prix : les jeunes journalistes de la chimie. Quatre binômes d’étudiants en journalisme ont été choisi pour réaliser un sujet (article + interview vidéo) sur l’univers de la chimie.
- Sarah Costes et Roméo Marmin – École publique de journalisme de Tours (EPJT)
- Candice Antiga et Taslime Maazouzi – Centre de formation des journalistes (CFJ)
- Caroline Barathon et Cléa Dubray – École de journalisme de Grenoble (EJDG)
- Morgane Anneix et Juliette Laffont – École de journalisme Sciences Po Paris
Les investigations sont lancées, les binômes disposent désormais d’une période de 3 mois pour peaufiner leurs productions, souhaitons leur bonne chance.
La cérémonie de remise du Grand Prix aura lieu le 27 juin 2024 à la Maison de la Chimie. Rendez-vous fin juin sur Mediachimie pour visionner et lire les productions de l’édition 2024 du GPJJC et surtout connaître le binôme vainqueur du GPJJC 2024.
Le colloque « Chimie, recyclage et économie circulaire » qui a eu lieu le 8 novembre 2023 au sein de la Fondation de la Maison de la Chimie, a mis en lumière certains enjeux du recyclage des matériaux dont les progrès à réaliser dans la collecte des déchets mais aussi les objets usagés et la nécessité de sans cesse innover pour améliorer les procédés existants.
Tout cela s’inscrit dans la transition écologique nécessaire pour évoluer vers un nouveau modèle économique et social qui apporte une solution globale et pérenne aux grands enjeux environnementaux de notre siècle et aux menaces climatiques qui pèsent sur notre planète. La chimie est bien entendu très sollicitée pour y parvenir.
Dans ce dossier, après avoir défini les contours de l’économie circulaire, nous aborderons le recyclage de quelques familles de matériaux.
Chimie, recyclage et economie circulaire
- Terminale générale, spécialité physique-chimie — Partie « Constitution et transformations de la matière » — 3. A et C : Prévoir l’état final d’un système, siège d’une transformation chimique — 4. Élaborer des stratégies en synthèse organique
- Première STI2D et terminale STI2D, programmes de physique-chimie et mathématiques —Partie « Matière et matériaux » / Oxydo-réduction
- Terminale STL, programmes de physique-chimie et mathématiques — Partie « Constitution de la matière » / Réactions d’oxydo-réduction
Suite au tragique incendie de la cathédrale Notre-Dame de Paris le 15 avril 2019, un vaste chantier de rénovation a vu le jour, avec pour objectif ambitieux de reconstruire le monument à l’identique. Quatre ans et demi plus tard, et à un an de sa réouverture au public prévue le 8 décembre 2024, la charpente est achevée et la flèche qui vient tout juste d’être posée culmine à nouveau à 96 mètres de haut. Si le public se réjouit de voir la cathédrale renaître de ses cendres, la prochaine étape de reconstruction de la toiture ravive néanmoins des inquiétudes suite au choix de garder le plomb comme matériau de couverture. En effet, lors de l’incendie, plusieurs centaines de tonnes de ce métal à la toxicité avérée sont parties en fumée et se sont dispersées dans l’atmosphère parisienne.
Comment peut-on mesurer l’impact de l’incendie de Notre-Dame sur la pollution au plomb à Paris ?
Parties des programmes de physique-chimie associées
- Radioactivité et datation
- Terminale, spécialité physique-chimie — Thème « modéliser l’évolution temporelle d’un système, siège d’une transformation » partie B
- Première, enseignement scientifique — Thème « Une longue histoire de la matière »
- Terminale, spécialité SVT — Thème « À la recherche du passé géologique de notre planète »
À travers l’utilisation de documents de nature diverse, issus du site Mediachimie, le lecteur prendra conscience, si ce n’est pas déjà le cas, de la richesse de ce site et pourra poursuivre sa quête d’informations.
- Programmes du tronc commun de tous les baccalauréats professionnels dans la discipline « Prévention-Santé-Environnement » - Thématique A : « L’individu responsable de son capital santé ».
- Programmes spécifiques de physique-chimie pour les classes de première et de terminale Bac professionnel propres au groupement de spécialités 5.
Le Groupement 5 rassemble les spécialités de baccalauréats professionnels mobilisant des compétences professionnelles qui nécessitent de solides connaissances dans le domaine de la chimie. Il réunit les spécialités de secteurs professionnels variés : l’industrie chimique, la bio-industrie, la cosmétologie, la teinturerie, les textiles, la plasturgie, l’esthétique, la gestion des pollutions et la protection de l’environnement, la verrerie, les plastiques et composites…
Source : Dossier réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
