Démonstrateur de chimie au jardin royal des plantes médicinales, passionné et enthousiaste, Guillaume François Rouelle forme les chimistes de l’époque révolutionnaire (Lavoisier, Macquer, Sage… ) et ses cours sont suivis par des philosophes (Diderot, Rousseau), des économistes, des magistrats, des gens du monde. Ses leçons de chimie accompagnées de démonstrations attirent alors une foule considérable d’auditeurs. Mais il était très distrait…
L'allélopathie, vous connaissez ? C'est l'étude des communications entre les plantes.
Source : Clins d'oeil de la Fondation Internationale de la Maison de la Chimie
Le CO2, menace ou ressource ? Marc Fontecave, au Collège de France, veut le transformer en source d'énergie.
Source : Clins d'oeil de la Fondation Internationale de la Maison de la Chimie
De l'analyse des planètes à celle des œuvres d'art. Au Musée d'art et d'histoire de Bayeux, Philippe Walter montre un outil, développé par la NASA et le Laboratoire d'archéologie moléculaire et structurale, qui intéresse beaucoup le conservateur du musée.
Source : Clins d'oeil de la Fondation Internationale de la Maison de la Chimie
Les couleurs sont une perception de notre cerveau des ondes électromagnétiques dans un domaine bien précis de longueurs d’onde. Sur l’exemple de la couleur rouge nous vous proposons de comprendre ce qui peut expliquer la couleur d’une solution, d’établir un modèle et de s’en servir comme outil de mesure.
Première générale - Enseignement de spécialité
Objectif : Comprendre ce qui peut expliquer la couleur d’une solution, son lien avec la concentration d’une espèce colorée et comment s’en servir pour déterminer la quantité d’une espèce colorée dans un échantillon.
Constitution et transformation de la matière
Thème 1 - Suivi de l’évolution d’un système, siège d’une transformation.
Partie A - Détermination de la composition du système initial à l’aide de grandeurs physiques.
Notions et contenus : Absorbance, spectre d’absorption, couleur d’une espèce en solution, loi de Beer-Lambert.
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
Depuis l’Antiquité, les Hommes utilisent le vinaigre pour ses multiples propriétés : conserver, soigner, désinfecter, digérer les substances grasses… En cosmétique, par ses propriétés astringentes, il servait à nettoyer et tonifier la peau…
Aujourd’hui, c’est l’assaisonnement par excellence pour rehausser le goût, aseptiser les huîtres crues par ses propriétés antiseptiques et antifongiques ou pour le plaisir avec quelques échalotes finement hachées ! Adoucissant, il nous sert à détartrer la cafetière ou autres appareils électroménagers, à faire briller l’argent et le chrome, à laver nos vitres et toute verrerie sans laisser de traces…
Première STL
Objectif : Déterminer la composition du vinaigre et étudier sa qualité de détartrant.
Constitution et transformation de la matière
Acides et Bases, pKa, domaines de prédominance
Concentration, densité, dilution
Schéma de Lewis
Électronégativité, liaison covalente polarisée, lien structure / propriétés physiques
Fonction chimique
Concentration, densité, dilution, quantité de matière
Mesures et incertitudes : Sources d’erreur. Expression du résultat. Valeur de référence
Synthèses chimiques et analyses physico-chimiques : Hydrogène labile. Dosage direct par titrage. Fiches données sécurité
Activité expérimentale : Identification et dosage par changement de couleur de l’acide contenu dans le vinaigre
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
Le dioxyde de carbone, CO2, est une molécule essentielle à la vie. Sans elle il n’y aurait pas de photosynthèse et la vie sur Terre n’existerait pas. Cependant, cette molécule est fortement responsable de l’effet de serre. C’est pour cela que les scientifiques cherchent à développer des méthodes pour diminuer son émission ou pour la stocker afin de la recycler.
Seconde Physique-Chimie
Objectif : Découvrir les voies de stockage et de recyclage pour répondre aux enjeux environnementaux d’une molécule à effet de serre : le CO2
Constitution et transformation de la matière
Thème 2 - Modélisation des transformations de la matière et transfert d’énergie
Partie B - Transformations chimiques
Notions et contenus : Modélisation macroscopique d’une transformation chimique par une réaction chimique. Écriture symbolique d’une réaction chimique. Stoechiométrie, réactif limitant.
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
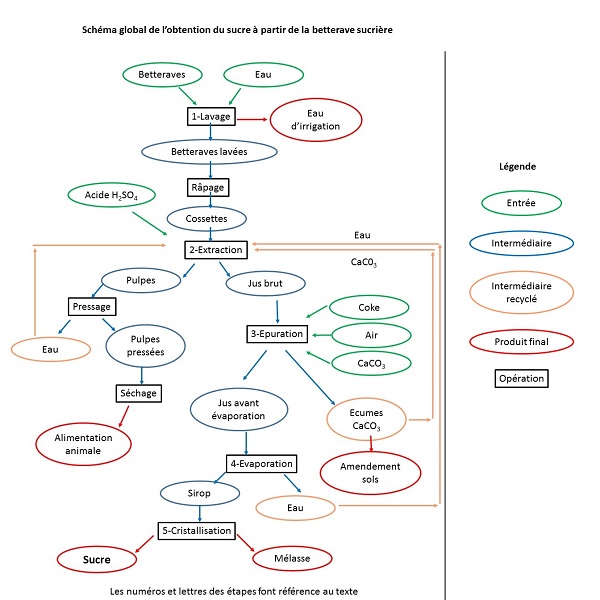
Le sucre est produit à l’échelle mondiale à partir de canne à sucre (70 à 80 %) ou à partir de betterave à sucre. La France est le premier producteur mondial de sucre de betterave : 46 000 personnes travaillent dans cette filière et la production pour 2017/2018 a été de 6,1 Mt de sucre dont 3,35 Mt exportées [1]. C’est une activité saisonnière car la racine de betterave doit être traitée sitôt l’arrachage réalisé.
L’obtention du sucre à partir de betteraves a été introduite par Chaptal au début du 19e siècle, suite au blocus imposé par l’Angleterre à la France sous Napoléon 1er. En 1911 un décret impérial ordonnait l’ensemencement de 32 000 hectares de betteraves [2] [3]. Aujourd’hui ce sont 485 000 hectares en France qui fournissent la betterave sucrière [1].
Il ne faut pas confondre le sucre (saccharose) avec les sucres (fructose, glucose..). La racine de la betterave contient 18 à 20 % de saccharose, 77 % d’eau et d’autres composés nommés « non-sucres » (des sucres, du potassium, du sodium, des acides minéraux et organiques et des matières organiques azotées) [4] [8].
Le procédé d’obtention du sucre a évolué afin de répondre aux exigences du développement durable : limiter les rejets, CO2 compris, diminuer la consommation d’énergie et d’eau et favoriser le recyclage.
1- Lavage
Les racines de betteraves, reçues à la sucrerie à l’automne, sont immédiatement traitées par un lavage pour ôter la terre, les feuilles, et les cailloux (réutilisables). L’eau de lavage est majoritairement recyclée dans l’atelier de lavage ou stockée (lagunage) puis utilisée au printemps en irrigation [4] [6] [7].
2- Découpage, extraction du jus brut et obtention des pulpes
On réalise l’extraction par diffusion (extraction par différence de concentration entre l’intérieur des cellules et l’eau d’extraction). Les betteraves sont découpées sous forme de cossettes qui circulent à contre-courant de l’eau. Cette eau est issue en partie du pressage des pulpes (eau de presse) et en partie de condensats provenant de l’évaporation de l’eau du jus de betterave (cf. § 4.Concentration du jus).
Les conditions optimales sont une température comprise entre 70°C et 80°C et un pH de 5,6. Comme le pH de l’intérieur des cellules vaut 6,3 il faut à la fois acidifier la solution mais aussi lui conférer un pouvoir tampon ; on ajoute donc à l’eau d’extraction de l’acide sulfurique et du carbonate de calcium (nommé aussi écumes). On récupère ainsi le jus brut, ou jus vert, contenant le saccharose et, à part, les cossettes traitées, nommées pulpes. Celles-ci sont ensuite pressées pour récupérer l’eau de presse qui sera réinjectée pour l’extraction du jus brut, puis séchées afin d’être valorisées en alimentation animale [4].
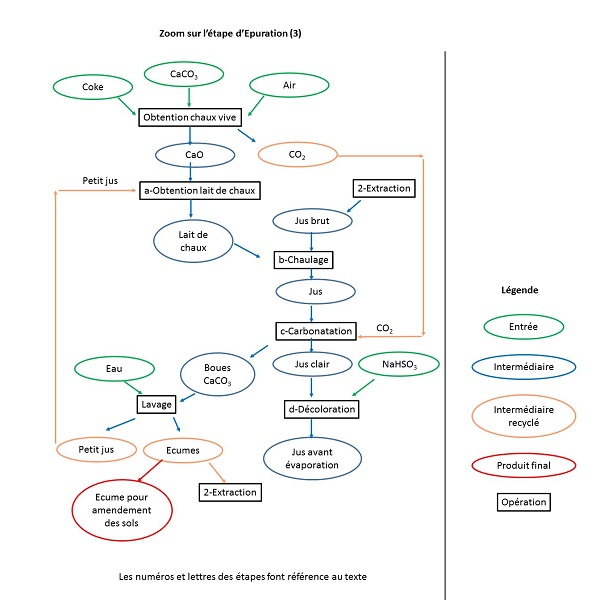
3- Épuration du jus
Le jus brut, vert-noir, acide et mousseux contient des impuretés minérales et organiques. L’épuration se fait en 4 étapes : chaulage, carbonatation, décalcification et décoloration [4].
a- Obtention du lait de chaux, réalisée au sein de l’usine en 2 étapes
À partir du calcaire (CaCO3), on obtient de la chaux selon :
CaCO3(s) → CaO(s) + CO2(g)
Cette réaction nécessite un apport de chaleur qui est fourni par la réaction de combustion du coke (C). Le dioxyde de carbone est recyclé dans l’étape de carbonatation (cf. 3.c. Carbonatation).
La chaux vive est ensuite mélangée au petit jus issu du lavage des boues (cf. 3.c. Carbonatation) pour obtenir le lait de chaux selon :
CaO(s) + H2O(l) → Ca(OH)2(aq)
b- Chaulage
En ajoutant le lait de chaux au jus brut, les ions calcium, Ca2+, précipitent les bases conjuguées de différents acides (oxalique, citrique, phosphorique…) et favorisent la coagulation des protéines. Le jus perd alors sa mousse, et la coloration brun-noir s’atténue. Les ions hydroxydes, OH-, précipitent certains cations (aluminium, fer ou magnésium), réagissent sur les ions ammonium et les amides pour former de l’ammoniac, décomposent le sucre inverti (mélange de glucose et fructose provenant de la décomposition du saccharose) en divers sels d’acides et saponifient les matières grasses.
c- Carbonatation
La chaux en excès est éliminée, en introduisant le dioxyde de carbone obtenu dans l’étape (a), ce qui fait précipiter le carbonate de calcium selon :
Ca(OH)2(aq) + CO2(g) → CaCO3(s) + H2O(l)
On obtient un jus sucré clair de pH voisin de 11. Les boues de carbonate de calcium ont entrainé les autres précipités et sont légèrement sucrées. Elles sont lavées pour récupérer le petit jus recyclé dans l’étape a. Par ailleurs les écumes (riches en CaCO3), sont vendues pour l’amendement des sols.
d- Décalcification et décoloration
À cette étape du procédé le jus obtenu contient encore des ions calcium. Un passage sur des résines échangeuses d’ions les remplace par des ions sodium, Na+. L’ajout d’une solution d’hydrogénosulfite de sodium (NaHSO3) ou de dioxyde de soufre (SO2) permet une décoloration du jus, par réduction des substances organiques colorantes (caramel…).
4- Concentration du jus
La concentration du jus se fait par évaporation de l’eau (environ 80 % en masse du jus). L’optimisation des procédés d’évaporation limite au maximum les coûts énergétiques [5]. On obtient un sirop contenant environ 70 % de matières sèches dissoutes (nommées « Brix») dont le saccharose représente environ 92 % (on parle de taux de pureté du Brix) [6]. La concentration est proche de la limite de solubilité du saccharose.
5- Cristallisation du sucre à partir du sirop
Après trois étapes de cristallisation, appelées jets, (succession de cuisson, malaxage et essorage), on obtient du saccharose pur et l’on récupère une liqueur enrichie en « non sucre » et impuretés nommée mélasse. Celle-ci a un Brix de l’ordre de 80 % qui contient encore 62 % de saccharose [5]. À partir du sirop le rendement massique est de 85 % en saccharose et 15 % en mélasse.
En résumé, le sucre (100 % de saccharose) est un produit biosourcé, issu du végétal et renouvelable, qui nécessite de nombreuses étapes pour son extraction de la betterave à sa purification. Le procédé génère divers produits secondaires qui sont valorisés : cailloux pour chaussées, pulpes pour l’alimentation animale, écumes pour amendement des sols, eau de lavage des betteraves pour épandage [8].
Afin de limiter les coûts et l’impact environnemental, l’eau utilisée est principalement celle issue de la betterave elle-même et de nombreux recyclages sont mis en œuvre pour en limiter la consommation [9].

Sucre © Cozine / Adobe Stock
Pour approfondir et illustrer ce sujet :
[1] Sucre, produits sucrés : Chiffres-clés de consommation 2018-2019 sur le site lesucre.com
[2] L’approvisionnement en sucre sous le Bloc continental de Denis Brançon et Claude Viel, L'Actualité Chimique n° 205 (Juillet 1997) p. 34-38
[3] Le sucre de betterave et l'essor de son industrie : Des premiers travaux jusqu'à la fin de la guerre de 1914-1918 de Denis Brançon et Claude Viel, Revue d’histoire de la pharmacie n°322 (1999) pp. 235-246
[4] Procédés de transformation en sucrerie (partie I) de Martine Decloux Techniques de l’Ingénieur F 6150 (2002)
[5] Procédés de transformation en sucrerie (partie II) de Martine Decloux Techniques de l’Ingénieur F 6151 (2003)
[6] vidéo le sucre naturellement : CRDP et CEDUS
[7] vidéo Au cœur d’une sucrerie sur le site lesucre.com
[8] Schémas de la fabrication du sucre de betterave sur le site du Syndicat National de la fabrication du Sucre
[9] Les entrées et sorties d’eau sur le site du Syndicat National de la fabrication du sucre