La recherche de nouvelles molécules à partir de plantes ou d’organismes marins reste un enjeu majeur pour l’élaboration de cosmétiques, de médicaments, de produits agro-alimentaires ou phytosanitaires.
La nature, gigantesque fournisseur de molécules, fournit des idées à l’Homme pour élaborer des molécules plus complexes ou tout simplement pour comprendre les raisons pour lesquelles une plante donnée possède par exemple une certaine activité thérapeutique.
Première générale - Enseignement de spécialité
Objectif : Découverte des différentes étapes de synthèse en chimie organique et utilisation de celle-ci dans le quotidien.
Constitution et transformation de la matière
Thème 3 - Propriétés physico-chimiques, synthèses et combustions d’espèces chimiques organiques
Partie B - Synthèses d’espèces chimiques organiques
Notions et contenus : Étapes d’un protocole. Rendement d’une synthèse.
Activité expérimentale : Comment isoler un produit de synthèse ?
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
 |
Colloque Chimie et nouvelles thérapies - les vidéos sont en ligne !
|
Colloque Chimie et nouvelles thérapies - les vidéos sont en ligne !
Rubrique(s) : Événements

Le colloque " Chimie et nouvelles thérapies " a eu lieu le 13 novembre 2019. Retrouvez dès maintenant l'intégralité du colloque en vidéo.
La Fondation de la Maison de la Chimie et Les Éditions Nathan se sont associées depuis cinq ans pour proposer aux enseignants et aux élèves des dossiers pédagogiques conformes aux nouveaux programmes des lycées pour les enseignements des classes de 2de et les enseignements de spécialités des classes de 1res et terminales générales, technologiques et professionnelles, ainsi que des fiches orientation pour éclairer les parcours et les métiers liés à la chimie et des ressources spécifiques pour le Grand Oral du Bac.
Cette année 2024/2025 ce partenariat se prolonge avec de nouvelles ressources sur le thème " Chimie et Eau " pour les classes de premières et de terminales générales, technologiques et professionnelles.
- accéder aux dossiers
- voir le sommaire | télécharger le sommaire (PDF)
Nous mettons à disposition des dossiers thématiques complets qui devraient sans nul doute permettre de découvrir ou approfondir votre connaissance des ressources scientifiques riches et actuelles (conférences, vidéos, textes…) proposées par le site www.mediachimie.org et de les partager avec les élèves pour enrichir leur connaissance sur chacun des sujets traités.
Vous pouvez retrouver :
- les dossiers Chimie et Eau
accéder aux dossiers
voir le sommaire | télécharger le sommaire (PDF) - les dossiers Chimie et Sport
accéder aux dossiers
Classes de 1res et de terminales de bac professionnel : voir le sommaire | télécharger le sommaire (PDF)
Classes de 1res et de terminales de bac général et technologique : voir le sommaire | télécharger le sommaire (PDF) - les dossiers Grand Oral (2021/2022 et 2022/2023) :
accéder aux dossiers | voir les sommaires
télécharger le sommaire 2022/2023 (PDF) | télécharger le sommaire 2021/2022 (PDF) - les 10 fiches orientation :
accéder aux fiches - les 20 dossiers de classes de terminales :
accéder aux dossiers | voir le sommaire | télécharger le sommaire (PDF) - les 20 dossiers de classes de seconde et première :
accéder aux dossiers | voir le sommaire | télécharger le sommaire (PDF)
Retrouvez toutes les ressources de Mediachimie pour les enseignants dans l'Espace Enseignants et parcourez également l'Espace Métiers pour découvrir les métiers liés à la chimie.
Liste des dossiers disponibles
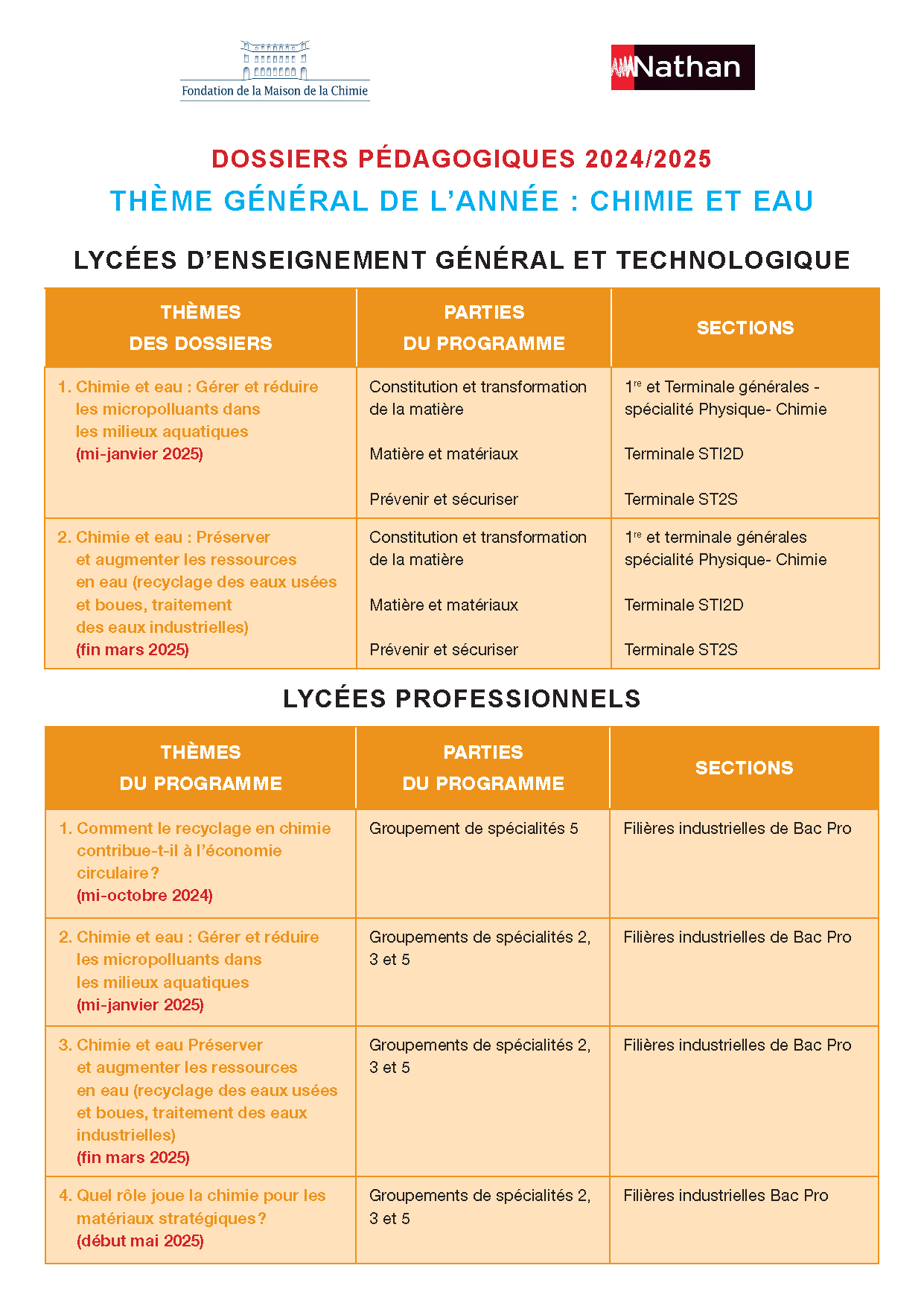
Dossiers Chimie et Eau 2024/2025
- Classes de premières et de terminales de bac professionnel
- Dossier 1 : Comment le recyclage en chimie contribue-t-il à l'économie circulaire ? (lycées professionnels)
- Dossier 2 : Gérer et réduire les micropolluants dans les milieux aquatiques (lycées professionnels)
- Dossier 3 : Le traitement des eaux usées et leur réutilisation (lycées professionnels) [NOUVEAU]
- Dossier 4 : Quel rôle joue la chimie pour les matériaux stratégiques ? (lycées professionnels) [NOUVEAU]
- Classes de secondes, de premières et de terminales de bac général et technologique
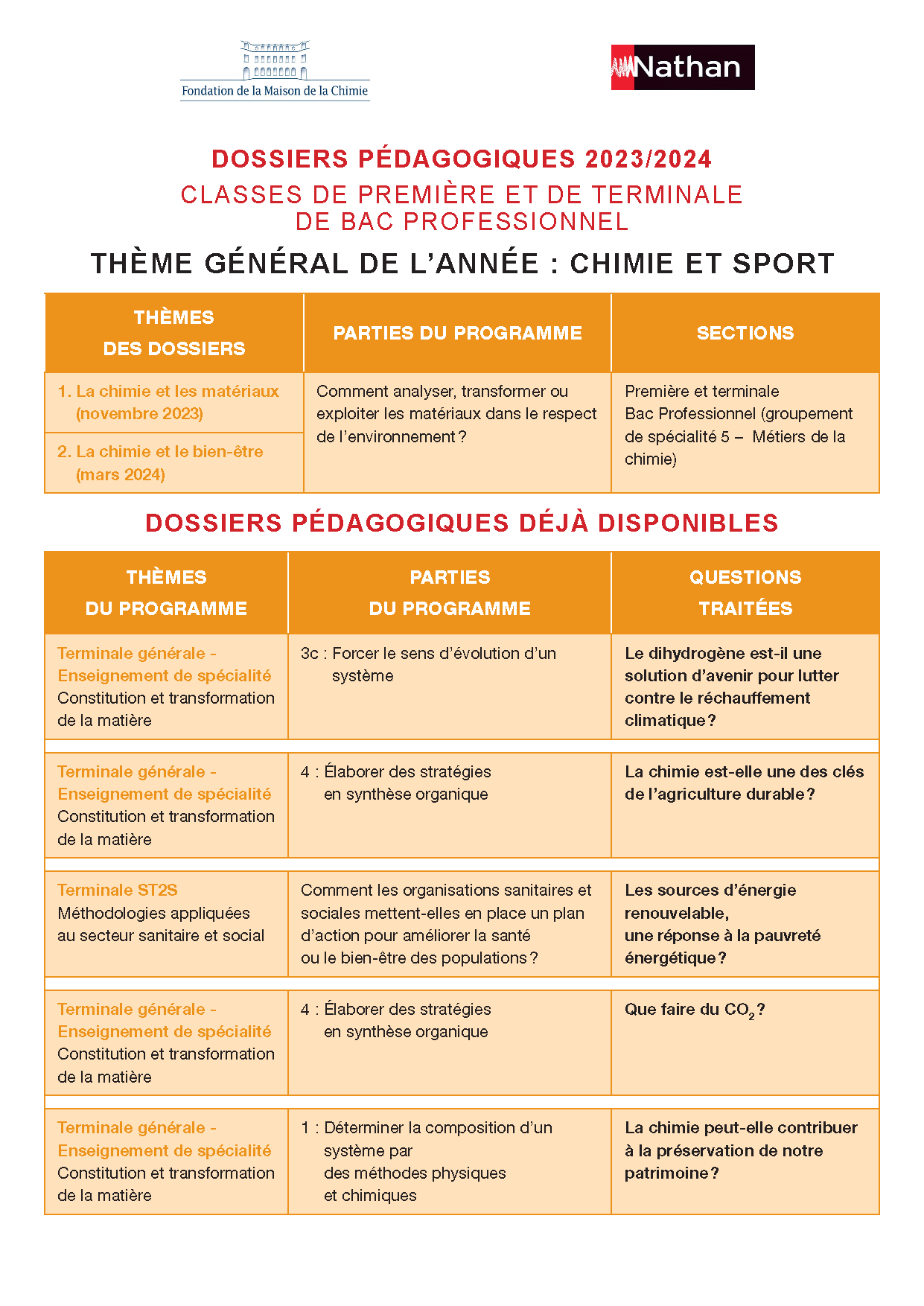
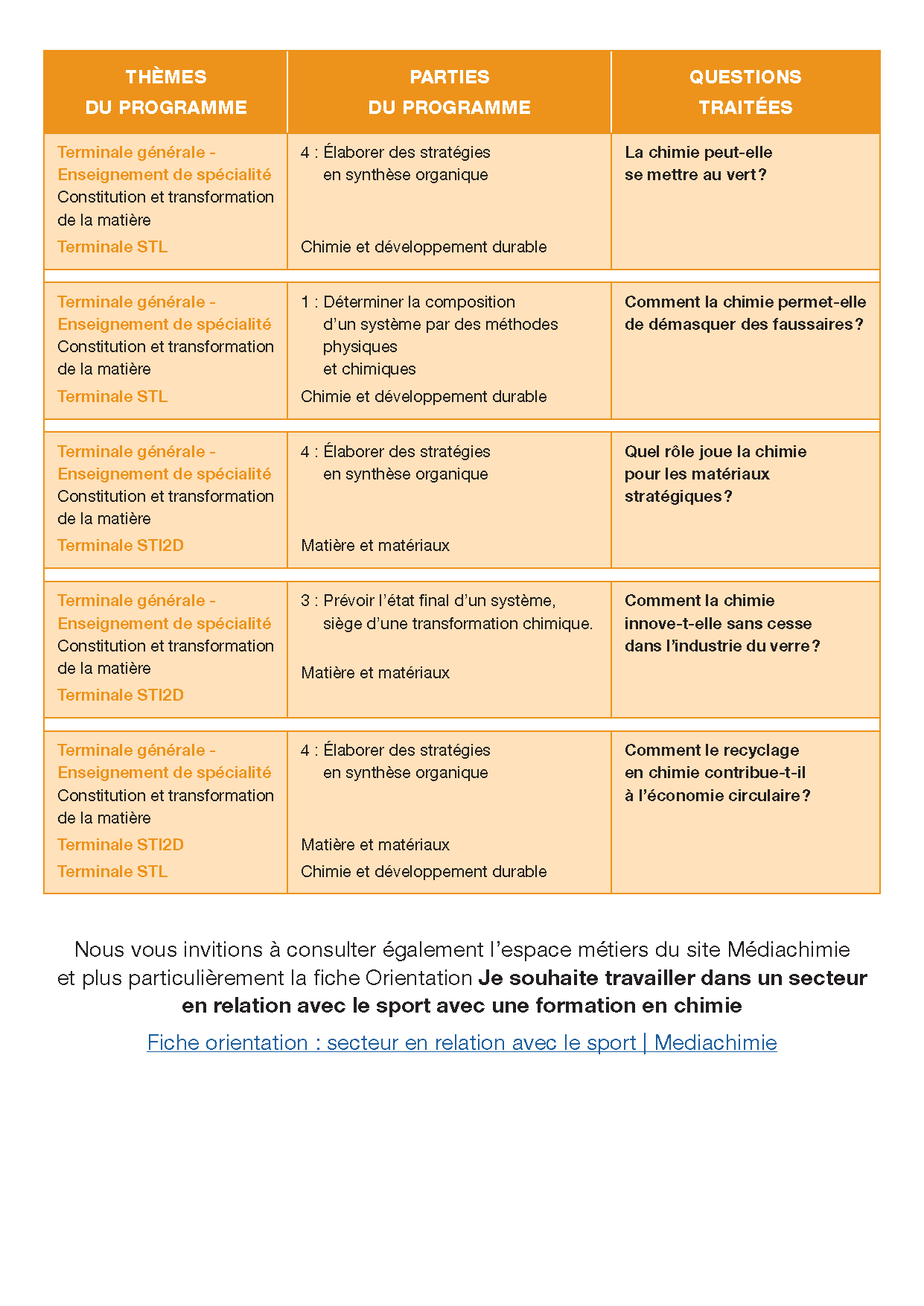
Dossiers Chimie et Sport 2023/2024
- Classes de premières et de terminales de bac professionnel
- Classes de premières et de terminales de bac général et technologique
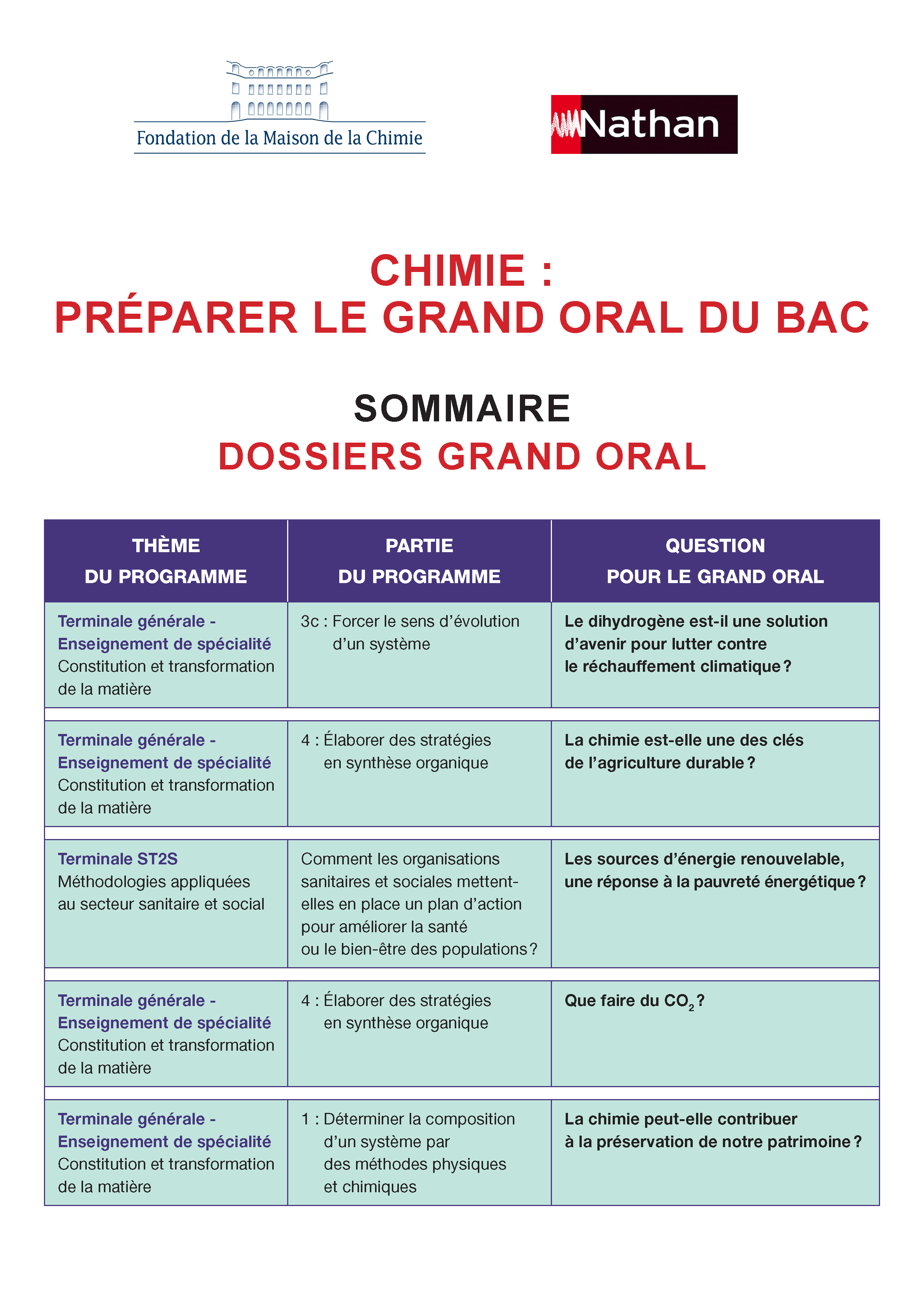
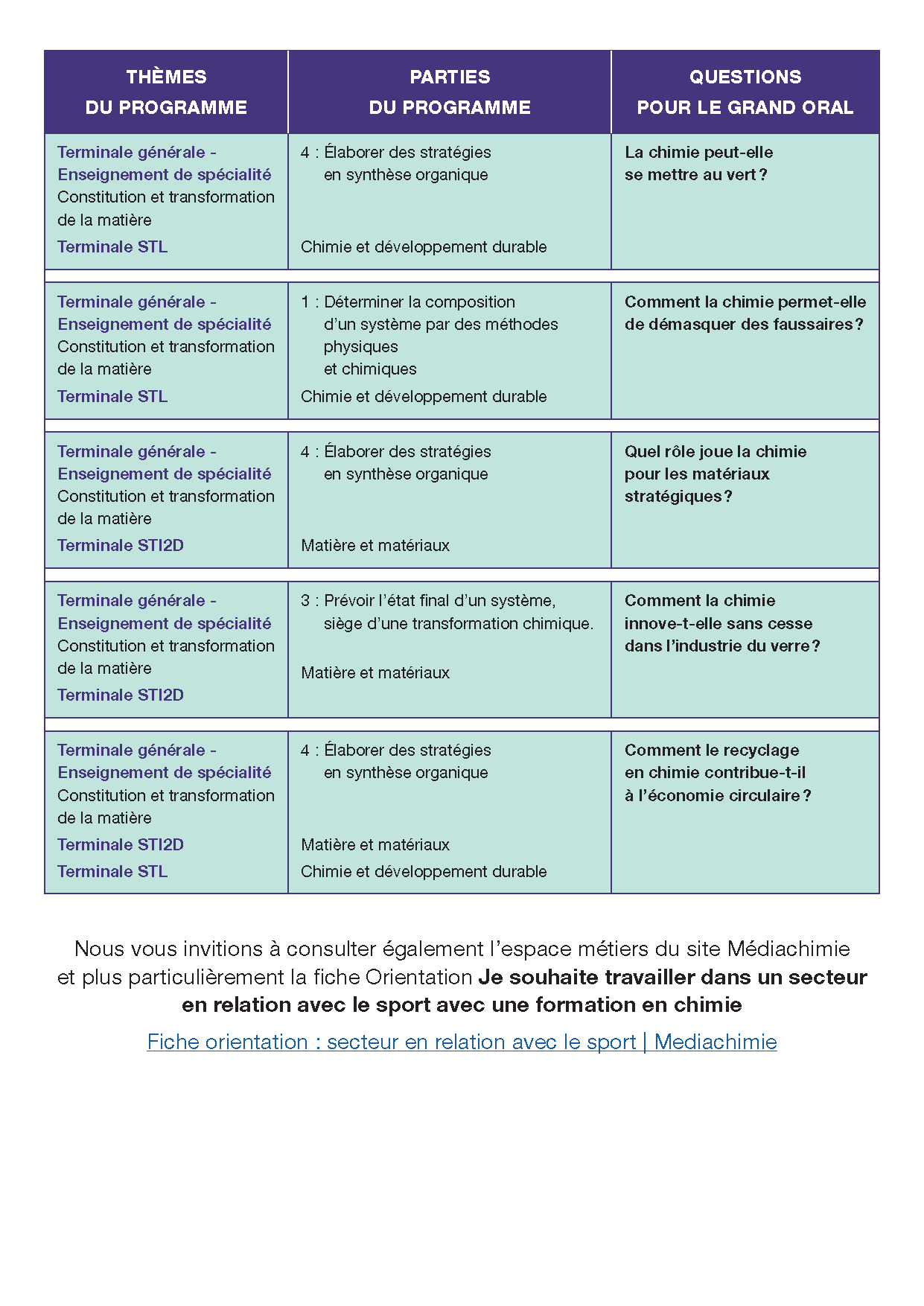
Dossiers Grand Oral :
- Dossiers 2022/2023
- Dossiers 2021/2022
- Le dihydrogène est-il une solution d’avenir pour lutter contre le réchauffement climatique ?
- La chimie est-elle une des clés de l’agriculture durable ?
- Les sources d'énergie renouvelables, une réponse à la pauvreté énergétique ?
- Que faire du CO2 ?
- La chimie peut-elle contribuer à la préservation de notre patrimoine ?
Terminale spécialité PC :
- La chimie des acides et des bases
- Mesurer le pH d'une solution
- Identifier un groupe caractéristique ou une espèce chimique
- Déterminer une quantité de matière à l'aide d'un titrage
- Effet d'un catalyseur
- Équation d'une réaction nucléaire
- Datation à l'aide de noyaux radioactifs
- Équilibre chimique et quotient de réaction
- Les acides α-aminés - acides faibles
- L'électrolyse et les applications industrielles
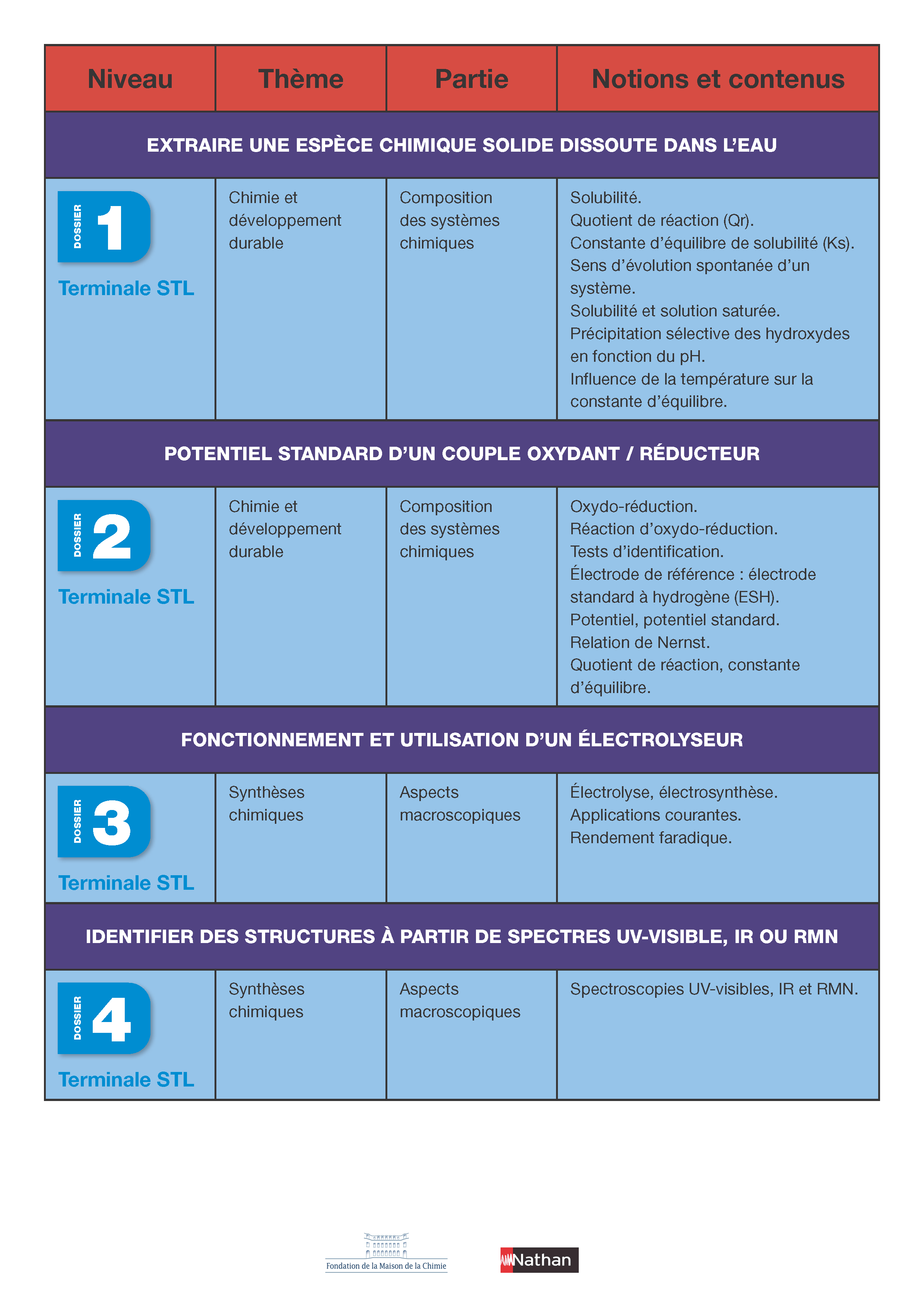
Terminale STL :
- Extraire une espèce chimique solide dissoute dans l'eau
- Potentiel standard d'un couple oxydant / réducteur
- Fonctionnement et utilisation d'un électrolyseur
- Identifier des structures à partir de spectres IR ou RMN
Terminale ST2S :
- Comment la qualité de l'air est-elle contrôlée ?
- Comment l'action d'un antioxydant peut-elle contribuer à la protection solaire ?
De la Première à la Terminale :
- La lumière : couleurs et modèle ondulatoire
- Les réactions d'oxydo-réduction dans les titrages colorimétriques
- L'eau, une ressource essentielle à la vie
- De la structure à quelques propriétés physiques de la matière
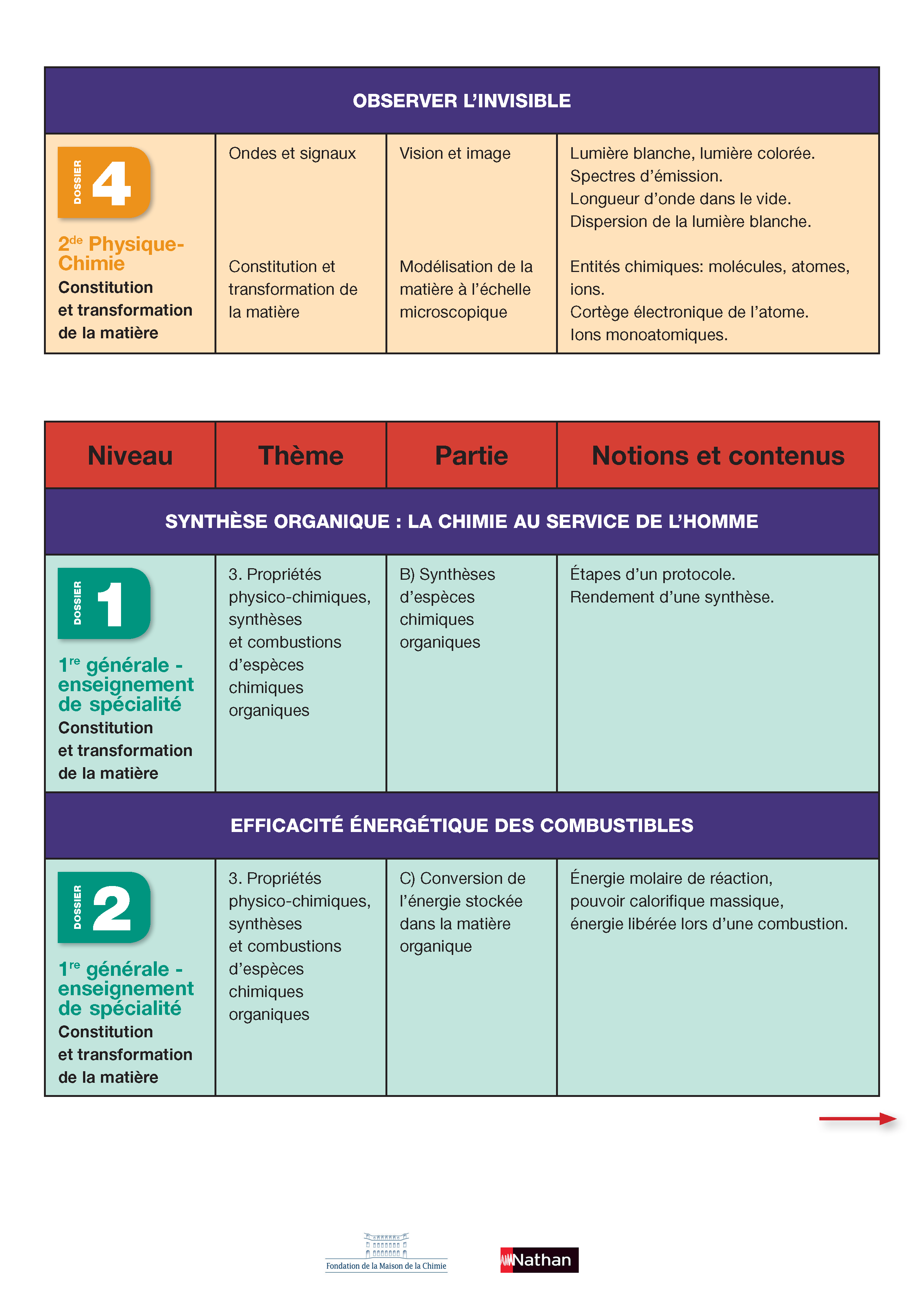
Première générale - enseignement de spécialité :
- Synthèse organique : la chimie au service de l'Homme
- Efficacité énergétique des combustibles
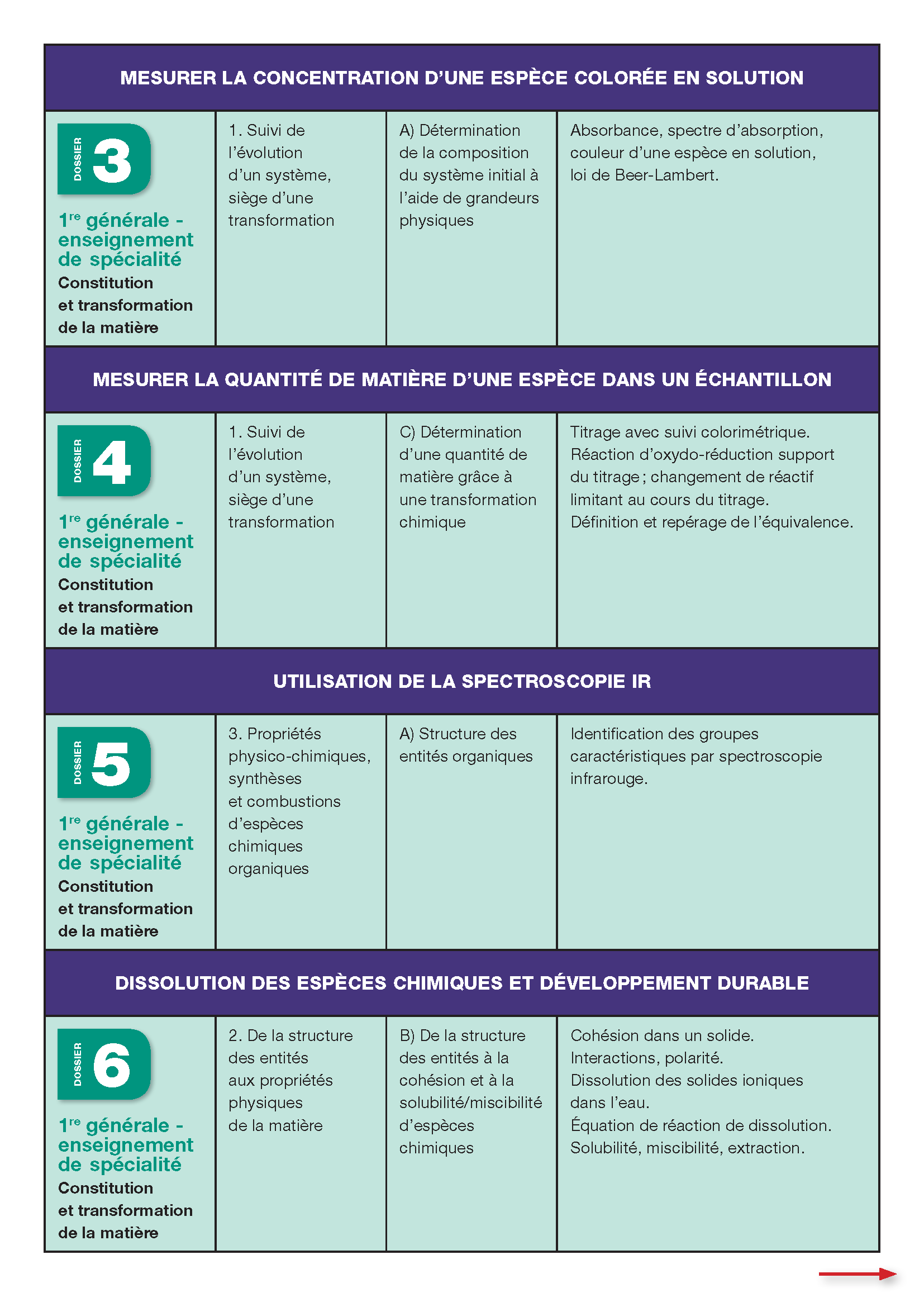
- Mesurer la concentration d'une espèce colorée en solution
- Mesurer la quantité de matière d'une espèce en solution dans un échantillon
- Utilisation de la spectroscopie I.R.
- Dissolution des espèces chimiques et développement durable
- Extraire des espèces chimiques d'un solvant
- La chimie du savon
- La chimie des explosifs
- La lumière : couleurs et modèle ondulatoire
- Les réactions d'oxydo-réduction dans les titrages colorimétriques
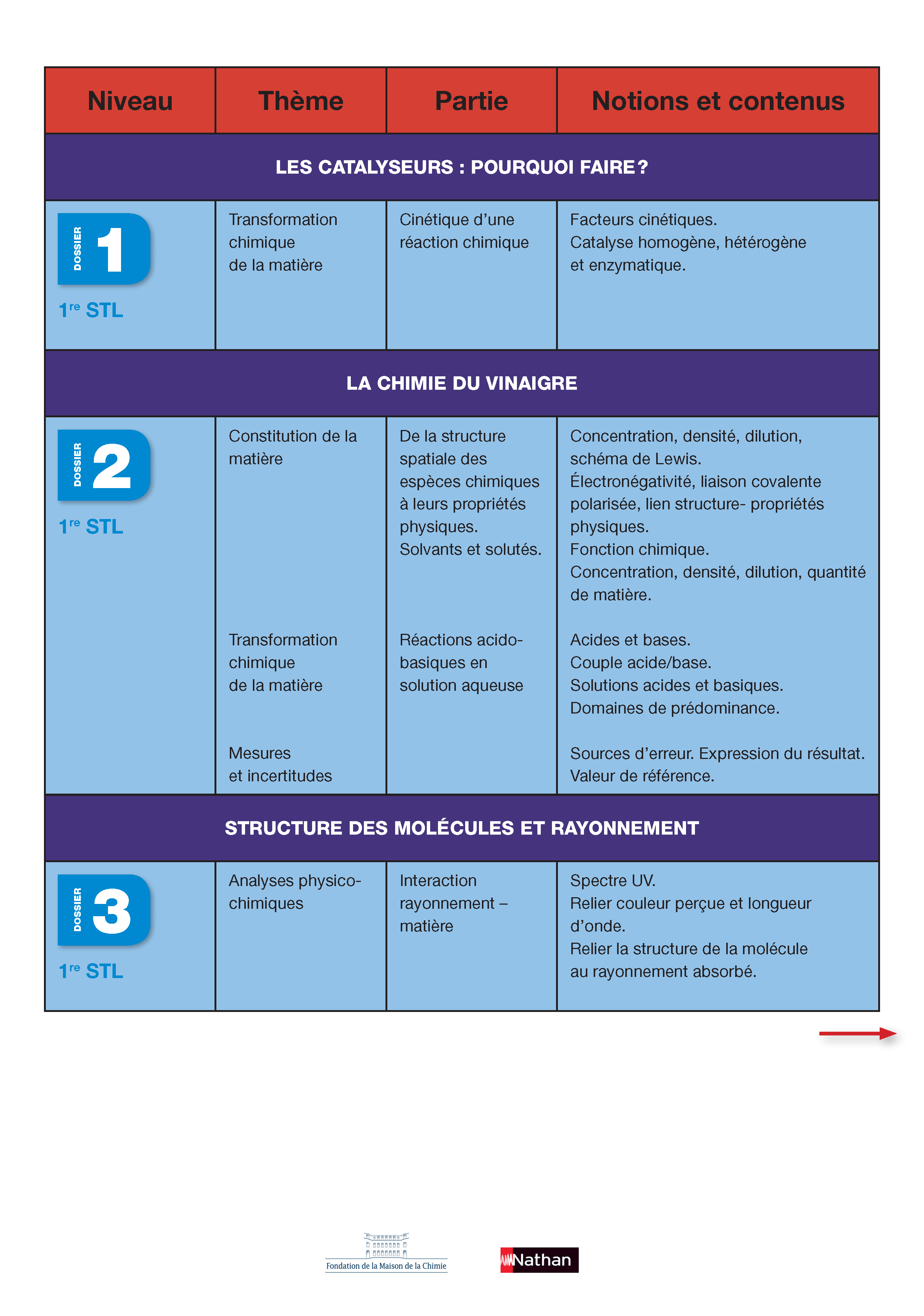
Première STL :
- Les catalyseurs : pour quoi faire ?
- La chimie du vinaigre
- Structure des molécules et rayonnement
- Images en couleur et vision
- De la structure à quelques propriétés physiques de la matière
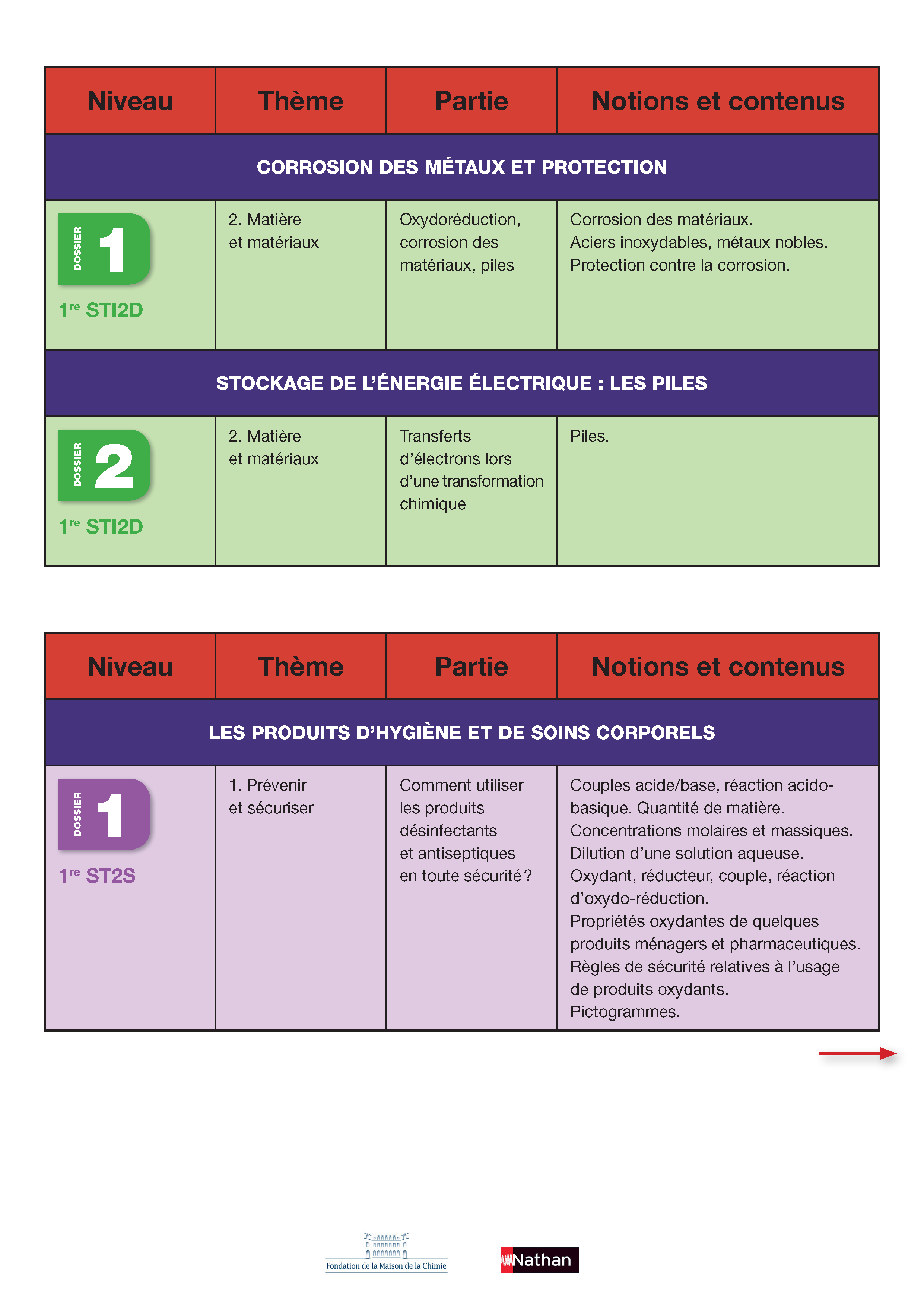
Première STI2D :
Première ST2S :
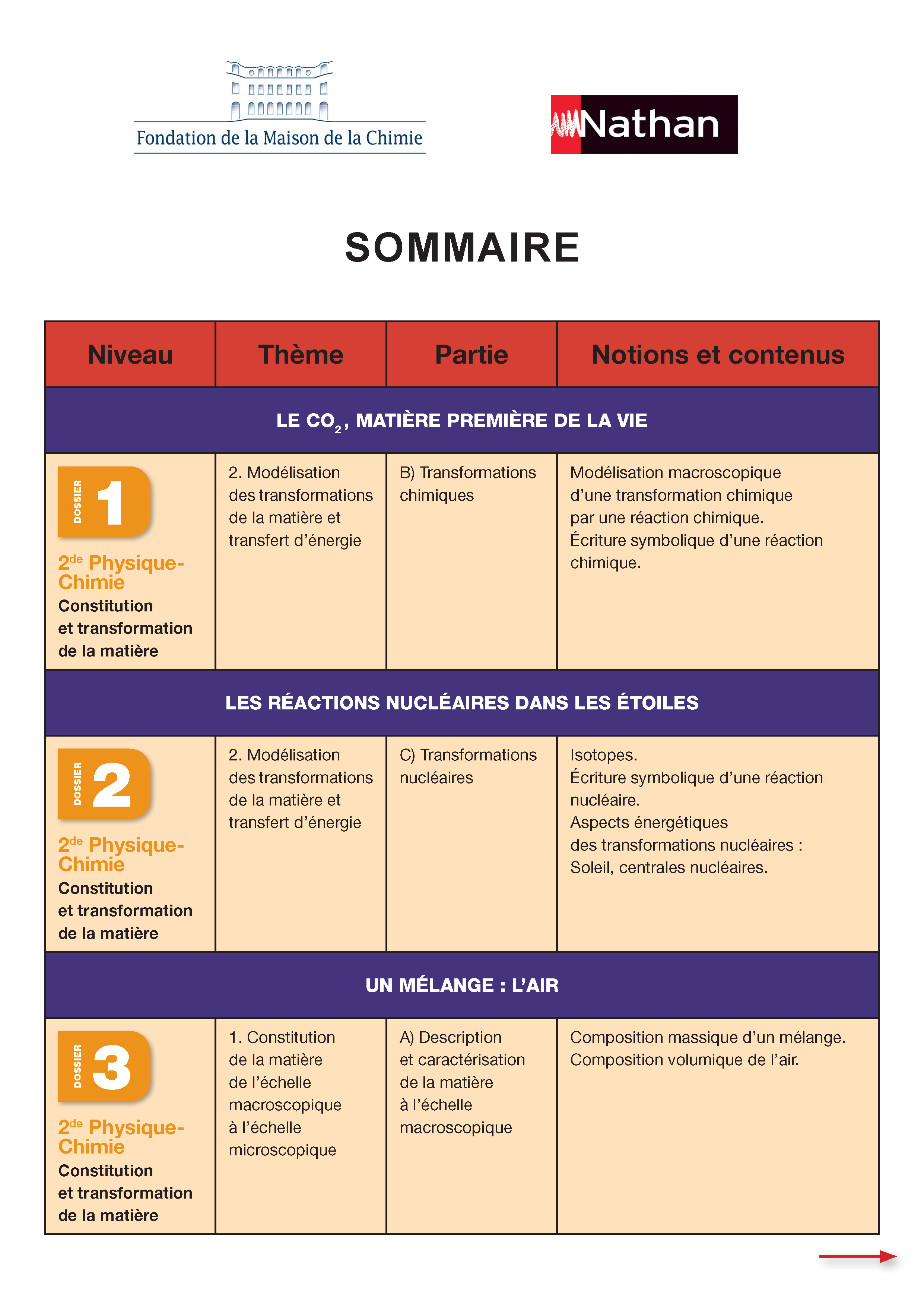
Seconde Physique-Chimie
- Le dioxyde de carbone, matière première de la vie
- Les réactions nucléaires dans les étoiles
- Observer l'invisible
- Un mélange : l'air
Liste des fiches d'orientation disponibles
- Fiche orientation : secteur de l'environnement et du développement durable
- Fiche orientation : secteur de la santé et du médicament
- Fiche orientation : secteur de l'automobile
- Fiche orientation : secteur du traitement de l'eau
- Fiche orientation : secteur de l'aéronautique
- Fiche orientation : secteur de l'enseignement et de la recherche
- Fiche orientation : secteur de la police scientifique
- Fiche orientation : secteur des énergies renouvelables
- Fiche orientation : secteur de la cosmétique et des parfums
- Fiche orientation : secteur en relation avec le sport
Sommaire des dossiers pédagogiques Chimie et Eau 2024/2025
Sommaire des dossiers pédagogiques Chimie et Sport 2023/2024
Sommaire des dossiers Grand Oral
Sommaire des dossiers des classes de terminale
Sommaire des dossiers des classes de seconde et première
Cette vidéo très pédagogique présente des nanomédicaments mis au point pour atteindre des zones inaccessibles par les médicaments classiques dans les poumons dans le cas de : pneumopathies obstructives de tuberculose, de HIV (SIDA), de cancer. Les avantages de ces nouveaux médicaments et leur mode d’action sont présentés de façon accessible à tous.
La visite des laboratoires permet de voir leur fabrication de ces nanomédicaments et les protocoles d’évaluation de leur efficacité et de leur toxicité. D’autres applications potentielles importantes sont aussi présentées.
Source : Clins d'oeil de la Fondation Internationale de la Maison de la Chimie
 |
Pourquoi ne faut–il pas jeter les piles ?
|
Pourquoi ne faut–il pas jeter les piles ?
Rubrique(s) : Question du mois

Les piles alcalines, les piles boutons, les batteries ont envahi notre vie de tous les jours. Elles apportent l’énergie électrique aux jouets, aux lampes torches, aux téléphones et tablettes portables, aux véhicules automobiles… Notons bien en français la distinction « pile » chargée une fois pour toute et qui se décharge à l’utilisation et « batterie » ou accumulateur qui délivre un courant grâce à une réaction électrochimique réversible et qui peut se recharger.
90 % des piles sont des piles « alcalines ». On trouve les « piles bâtons » cylindriques qui ont une anode constituée de zinc métallique (Zn) en poudre et d’un électrolyte gélifié contenant de l’hydroxyde de potassium (KOH). La cathode est constituée d’un mélange de dioxyde de manganèse (MnO2) et de carbone graphite (C) le tout enserré dans un cylindre d’acier.
Les piles boutons comportent souvent un gel de zinc et de potasse (KOH) et de l’argent (Ag), puisque le mercure (Hg) est maintenant interdit.
Les batteries rechargeables sont diverses :
- batteries nickel-cadmium (1), Ni-Cd, pour les outils de bricolage autonomes ;
- batteries nickel-hydrures métalliques de terres rares et de nickel (2), Ni–MH, pour les ordinateurs et les téléphones ;
- et de plus en plus de batteries Li-ion (3) (ion lithium) qui comportent une anode en graphite et des cathodes avec des oxydes mixtes de cobalt de type LiCoO2 , ou nickel, ou manganèse.
Sachant que l’on utilise environ 33 000 tonnes de piles et batteries en usage par an, cela représente environ 10 000 tonnes de zinc et 8 000 tonnes de fer et nickel sans oublier le cuivre.
Il ne faut donc surtout pas les jeter dans la nature ou dans les poubelles car vous dispersez alors partout des métaux lourds comme Zn, Fe, Co, Mn, et pire, des métaux pouvant être toxiques comme Ni ou Cd ainsi que des métaux rares et coûteux comme Cu, Ag et des terres rares : néodyme (Nd), praséodyme (Pr), dysprosium (Dy) et lanthane (La).
Une attitude d’éco-citoyen responsable exige aussi une économie des ressources naturelles et c’est une raison de plus pour mettre piles et batteries dans les bacs spécialisés de recyclage que l’on rencontre dans toutes les grandes enseignes de supermarchés ou de bricolage.
| Sur 100 piles utilisées | ||
| 30 sont jetées aux ordures ou dans la nature | 35 sont stockées ou en usage chez les particuliers | 35 sont recyclées par les filières existantes |
L’objectif est de développer les procédés de recyclage par broyage, puis hydrométallurgie et pyrométallurgie pour récupérer les alliages ferreux et affiner les métaux non ferreux ou rares.
Les directives européennes de recyclage sont d’en atteindre au moins 45 % par des organismes nationaux agréés, comme Corepile ou Sorelec, qui, en France, se partagent le recyclage d’un peu plus de 12000 tonnes de piles et batteries.
Dans le cas particulier de l’industrie automobile, où la plupart des véhicules sont équipés de batteries au plomb et acide sulfurique, il y a obligation de les recycler. Plus de 95 % sont désossées, l’acide est neutralisé, le plomb refondu et le polypropylène des caissons lavé et transformé en granulés recyclables.
Avec l’augmentation des véhicules électriques et des millions de tonnes de batteries ion–lithium qui s’annoncent, des filières spécialisées vont se mettre en place pour récupérer et recycler Cu, Co, Ni, Mn et Li.
Donc quand vos piles ou batteries ne fonctionnent plus, ne les jetez plus n’importe où et pensez recyclage, les chimistes s’en occupent pour une seconde vie (4).
Jean-Claude Bernier et l'équipe Question du mois de Mediachimie
(1) Une des électrodes est en oxyde de nickel hydraté NiO(OH) et l’autre est en cadmium, Cd.
(2) Une des électrodes est composée d’un hydrure métallique à base de lanthane (terre rare) et de nickel, de type LaNi5 et l’autre de l'oxyhydroxyde de nickel, NiO(OH). L’électrolyte est de la potasse.
(3) L’Académie suédoise vient de couronner en 2019 les inventeurs des batteries ion-lithium par le prix Nobel de chimie. Pour en savoir plus voir l'éditorial Un Nobel de chimie populaire
(4) Pour en savoir plus, voir la vidéo de l'ADEME ressource Comment transformer nos déchets électroniques en or et autres métaux précieux
Conférence au Salon européen de l'éducation
Rubrique(s) : Événements

Le vendredi 22 novembre Mediachimie sera présent au Salon européen de l'éducation pour une conférence sur le thème :
La chimie, science de l’innovation, recrute !
Découvrez les formations et les métiers qui embauchent sur le site d’orientation mediachimie.org
Hall 7, salle 2, de 13h à 14h
Conférence animée par Gérard Roussel et Freddy Minc de l’équipe Mediachimie.org
Balade parisienne des éléments
Rubrique(s) : Événements

Déambulation dans les lieux historiques de la chimie
Mercredi 11 décembre 2019
Départ 21 bd Morland 75004 Paris
Le mercredi 11 décembre 2019, entre 9h et 18h, est organisée la première promenade des éléments. Le départ se fera au 21 Boulevard Morland, 75004 et se terminera à l’ENCPB (11 rue Pirandello, 75013 Paris).
Au total 10 km (un quart de marathon) de déambulations dans les rues de Paris, plus d’une vingtaine de points d’arrêt, des visites de lieux méconnus avec pour thème les éléments chimiques, leur découverte, les scientifiques, les laboratoires...
Le nombre de place est limité à 25. Les inscriptions sont gratuites mais obligatoires auprès de x.bataille @ encpb.org.
Un budget de 30€ est à prévoir pour le repas et les visites.
Prévoir une bonne paire de chaussures.
Les organisateurs,
Xavier Bataille
Vangelis Antzoulatos,
Eric Jacques
 |
Espace Enseignants / Réforme du lycée
|
Espace Enseignants / Réforme du lycée
Rubrique(s) : Événements

Dans le cadre des nouveaux programmes du lycée général et technologique, Mediachimie.org réalise l’actualisation de l’entrée lycée de l’Espace enseignant en proposant un ensemble de ressources adaptées aux nouveaux enseignements et classées selon les orientations des nouveaux programmes.
L’enseignement scientifique en classe de première est dès à présent disponible pour la chimie, ainsi que des ressources en SVT pour tous niveaux de lycée.
Les entrées des classes de seconde et première seront déployées progressivement avant fin décembre 2019, puis les entrées en classes de terminales.
 |
Diffusion en direct du colloque Chimie et nouvelles thérapies
|
Diffusion en direct du colloque Chimie et nouvelles thérapies
Rubrique(s) : Événements

Vous qui n’aurez pas la possibilité de venir à la Fondation de la Maison de la Chimie le 13 novembre 2019, vous pourrez assister en direct au « Colloque Chimie et nouvelles thérapies »
sur Mediachimie ou sur Youtube.
La captation des conférences sera par la suite disponible en ligne et leur mise à disposition sera indiquée sur la page d'accueil de Mediachimie.
Colloque Histoire et Mémoire
Rubrique(s) : Événements

Dans le cadre des 80 ans du CNRS, l'A3, association des anciens et amis du CNRS, organise en partenariat avec le Comité pour l’histoire du CNRS, un colloque intitulé "Histoire et Mémoire".
Lundi 4 novembre 2019
de 9h à 18h
Auditorium Marie Curie du Campus Gérard Mégie du CNRS
3 rue Michel-Ange, Paris
La journée sera organisée autour de tables rondes, dont le thème sera les Assises de la recherche qui se sont tenues depuis la création du CNRS et leurs impacts sur l’établissement. Des anciens qui ont vécu le monde de la recherche et du CNRS, participeront à ces tables rondes. Le colloque "Histoire et Mémoire" sera clôturé par Antoine Petit, Président-directeur général du CNRS.


.png)