Les représentations de la matière animée et inanimée, que les chimistes ont successivement élaborées, les concepts dont ils se sont servis pour en parler, ainsi que les lois qui ont permis de repérer, de comprendre et d’agir sur les facteurs d’orientation, de déclenchement et de conduite des transformations chimiques, sont au cœur de notre science.L’enseignement a contribué à sélectionner des informations. Les enseignants retiennent ou proposent des classements et hasardent des généralisations qui influent sur la recherche en lui fixant des orientations, un langage, parfois des fils conducteurs. Ce fut le cas de la réception du traité élémentaire de Lavoisier ou du concept de série homologue en chimie organique introduit par Charles Gerhardt.
C'est une découverte révolutionnaire passée inaperçue, une grande avancée en catalyse homogène qui donnera une réaction majeure utilisée en pétrochimie. Tout commence en 1964, avec R.L. Banks et G.C. Bailey, de la Phillips Petroleum, qui transforment du propène en éthène et butène par chauffage en présence d’un catalyseur au molybdène. Mais cette belle découverte restait inexpliquée. […]
Louis Vicat (1786-1861), polytechnicien et ingénieur des Ponts et Chaussées, chargé de construire un pont sur la Dordogne, découvre à cette occasion en 1817 grâce aux analyses qu’il a réalisées, les éléments chimiques qui composent le ciment hydraulique artificiel (à base de chaux et d’argile).
Vicat ne dépose pas de brevet mais publie ses travaux dans des revues scientifiques : les ingénieurs peuvent profiter librement de ses découvertes, et, à partir des années 1830, l’industrie cimentière se développe progressivement grâce à ses recherches.
La construction des quais, jetées, phares et autres ouvrages maritimes nécessite l’emploi de mortiers hydrauliques capables de résister à la fois aux effets mécaniques des tempêtes comme à l’attaque chimique de l’air et de l’eau de mer, des milieux chargés de sels particulièrement corrosifs.
Vicat étudie alors les mortiers utilisés par les Romains dans la construction de ports sur la Méditerranée, ouvrages dont la longévité fait l’admiration des ingénieurs, et en détermine les composants. Cela l’amène à chercher en France les matières premières nécessaires pour obtenir des ciments artificiels aussi performants. Les articles qu’il publie à ce sujet vont permettre l’essor des travaux maritimes dans les ports français.
Mais des installations portuaires récentes, notamment sur la façade Atlantique, présentent rapidement de graves dégât : un concours est lancé en 1854 par la Société d’encouragement pour l’industrie nationale, à l’initiative de son président, le chimiste Jean-Baptiste Dumas (1800-1884), pour trouver la composition d’un ciment capable de durcir dans l’eau de mer et résistant à ses effets à long terme.
Vicat décide de relever le défi : il envoie un long mémoire intitulé « Recherche sur les matériaux connus dans l’art de bâtir sous les noms de Chaux, Ciments et Pouzzolanes, en tant que propres aux travaux à la mer », où il précise ses premières analyses, et définit la composition précise des ciments hydrauliques artificiels destinés aux travaux maritimes. Il est récompensé par la Société d’encouragement en 1857.
Pour en savoir plus :
- Leblanc F., Mortiers hydrauliques. Rapport fait par M. Félix Leblanc sur le concours relatif à l’étude des mortiers déjà employés ou destinés aux constructions à la mer, Bulletin de la Société d'Encouragement pour l'Industrie Nationale vol. 56, tome IV, 2ème série, 1857, p. 548-551
- Ciment, Produit du jour de la SCF, sur le site de la SCF
- Ciments courants, sur le site lelementarium.fr
Louis Vicat / Wikimedia
Pure découverte scientifique au départ, l’eau oxygénée ou peroxyde d’hydrogène a été un composé aux propriétés que le chimiste Louis-Jacques Thenard (1777-1857) a étudiées de manière systématique en 1818 tout en cherchant des applications possibles. Celles-ci devaient par la suite offrir de multiples débouchés industriels qui restent toujours d’actualité.
La découverte d’un nouveau composé chimique
Chimiste de renom, connu pour ses nombreuses contributions en chimie, Thenard s’est toujours préoccupé de mettre la science au service de l’industrie. Avant sa découverte, il avait été remarqué par la mise au point d’un bleu de cobalt (ou bleu Thenard) en 1803, utilisé dans la peinture à l’huile pour remplacer le lapis-lazuli. Il avait aussi contribué à la conception d’une nouvelle méthode de fabrication de la céruse (carbonate de plomb) et le procédé avait été industrialisé par le chimiste Roard à Clichy. Thenard était aussi connu pour avoir fait des recherches avec son collègue Joseph Gay-Lussac à l’École polytechnique entre 1808 et 1811 sur l’isolement du sodium et du potassium par électrolyse, ainsi que par des études sur plusieurs composés organiques dont ils avaient élucidé la composition. Formé par Vauquelin, Thenard était en effet un excellent analyste. Élu membre de l’Académie des sciences en 1810, Thenard, devint baron en 1825 en reconnaissance pour sa contribution à la préservation contre l’humidité des peintures sur la coupole du Panthéon. Il fut élu en 1832 président de la Société d’encouragement pour l’industrie nationale.
De la découverte à l’invention
Dans les années 1810, lors de recherches sur les composés dérivés de métaux, Thenard observa qu’un oxyde de baryum en milieu acide donnait lieu à la formation d’une solution aqueuse qui montrait un dégagement gazeux inattendu. Sa curiosité fut satisfaite lorsqu’il constata qu’il s’agissait d’un dégagement de dioxygène de la solution. Et l’analyse de ce liquide révéla qu’il contenait une proportion inhabituelle d’oxygène par rapport à la composition de l’eau ordinaire. D’où le nom d’ « eau oxygénée » qu’il donna à ce nouveau composé. Ses recherches pour identifier et décrire le nouveau composé devaient donner lieu à une série de mémoires présentés à l’Académie des sciences.
Composé de formule H2O2, le peroxyde d'hydrogène, nom actuel de l’eau oxygénée, est un liquide clair, légèrement plus visqueux que l'eau, incolore en solution. Thenard s’intéressa aux puissantes propriétés oxydantes du composé et aux applications possibles.
Des applications multiples
Voulant trouver une première application pratique de l’« eau oxygénée », Thenard et son ami le peintre et chimiste Léonor Mérimée pensèrent qu’un essai pouvait être fait pour enlever des taches brunes sur une gravure ancienne. Au moyen d’un pinceau fin, le produit fut mis au contact avec les taches du papier. Celles-ci étant dues à du sulfure de plomb donc brunes, le traitement les transforma en sulfate de plomb blanc. Le résultat étant positif, c’était le premier succès de l’eau oxygénée dans le blanchiment d’un papier, un procédé qui sera industrialisé par la suite.
Toutefois à cette époque, les applications n’étaient pas encore nombreuses. À part les beaux-arts, c’est la médecine qui a employé le produit comme désinfectant. L’emploi à l’échelle industrielle sera réalisé par la suite au moment où des industries auront besoin d’un composé de blanchiment ou de désinfection en grandes quantités.
Si le procédé de préparation de Thenard a été poursuivi jusqu’au XXe siècle, toutefois le procédé électrolytique a supplanté le procédé chimique original. Le peroxyde d’hydrogène est alors produit par électrolyse de l’acide sulfurique ou de l’hydrogénosulfate d’ammonium avec oxydation anodique, puis hydrolyse de l’acide peroxodisulfurique H2S2O8 ou du peroxodisulfate d’ammonium formé. La distillation permet alors de produire des solutions plus concentrées et plus stables.
Le peroxyde d'hydrogène sert beaucoup pour le blanchiment de la pâte à papier et des textiles. C’est un procédé écologique sans chlore. Il est aussi utilisé pour le traitement des eaux, des sols et des gaz (désulfuration, deNox, etc.) ou comme désinfectant des piscines.
À basse concentration, environ 5%, il sert à décolorer les poils et cheveux, d’où l'expression de« blonde peroxydée », ou, comme fixateur, pour achever une permanente. Il peut servir aussi pour le blanchiment des dents. Désinfectant pour un traitement local il sert au nettoyage des plaies, réputé contre le tétanos et contre indiqué pour les bactéries aérobies (ex : staphylocoque). L'eau oxygénée a été utilisée pendant plusieurs années comme révélateur d'hémoglobine en police scientifique. Cette découverte a été faite par le chimiste allemand Christian Schönbein (1799-1868).
À haute concentration, il peut servir de comburant pour la propulsion de fusées. En se décomposant dans le réacteur il fournit le dioxygène nécessaire à la combustion des combustibles auxquels il est associé. Enfin, le peroxyde d'hydrogène est aussi utilisé lors de la fabrication d'explosifs peroxydés comme le peroxyde d'acétone ou TATP.
Pour en savoir plus :
- Louis-Jacques Thenard: un savant et un acteur de la première industrialisation.
- Produits du jour de la société chimique de France (peroxyde d’hydrogène)
- Découverte du peroxyde d’hydrogène (eau oxygénée)
- Fabrication industrielle de l’eau oxygénée

Guyton de Morveau (1737-1816), avocat de Dijon, se passionnait pour la chimie. Il fut l’un des premiers convaincus de la justesse des théories de Lavoisier et l’un des fondateurs de l’École polytechnique. Il est l’auteur d’un Traité des moyens de désinfecter l’air.
En 1773, dit-il, l’hiver avait été si rigoureux que la terre était gelée à une grande profondeur, de sorte qu’on ne pouvait y creuser les tombes. Les cadavres, recouverts de chaux, furent entreposés dans les caves de l’église Saint-Médard. L’odeur devint bientôt si insupportable qu’il fallut fermer l’église. On avait en vain essayé des fumigations de vinaigre et allumé des brasiers sur lesquels on jetait différents parfums et des herbes odorantes. On sait aujourd’hui que l’odeur de cadavre est due à différentes amines volatiles, issues du catabolisme des protéines, prosaïquement dénommées cadavérine, putrescine, etc. Ayant remarqué que les vapeurs de chlorure d’hydrogène (HCl) et d’ammoniac (NH3) se combinent en chlorure d’ammonium, solide ionique inodore, Guyton en fit l’essai en grand le 6 mars. Du sel commun fut ajouté à de l’acide sulfurique concentré dans une grande cloche de verre renversée. La cloche fut placée sur un bain de cendres froides progressivement chauffées par un grand réchaud. Le chlorure d’hydrogène qui s’en dégageait se combinait avec les amines nauséabondes volatiles en composés solides. Le lendemain, après avoir aéré pour renouveler l’air, toute mauvaise odeur avait disparu. Quatre jours après l’église fut rendue au culte, selon lui, « sans danger et même sans inquiétude ».
Le procédé fut appliqué pour désinfecter l’air des hôpitaux militaires sous la Convention, le Directoire et le Premier Empire. Les destructeurs d’odeurs modernes visent toujours à limiter la diffusion des molécules malodorantes par transformation chimique (oxydation ou hydrogénation des huiles), adsorption (charbon actif) et encapsulation, par exemple.
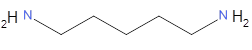
cadaverine
En savoir plus :
- Quelques rencontres historiques entre la chimie et les sciences de la santé, Josette Fournier, L’Actualité chimique (janvier 2004) pp. 9-18
- Traité des moyens de désinfecter l’air, de prévenir la contagion et d’en arrêter les progrès, Guyton de Morveau
Ces composés azotés d’un intérêt immense, du point de vue physiologique au moins, sont très nombreux mais bien mal connus au milieu du 19e siècle. Auguste Laurent rectifie l’analyse d’un grand nombre, les répertorie et précise la notion de molécule et de structure. Magnifiques exemples du talent de manipulateur du chimiste, elles marquent aussi un moment déterminant dans son itinéraire de théoricien de la chimie organique.
Ressource proposée par MB *
Source : Revue d’histoire de la pharmacie, 89e année, n° 331 (2001) pp. 303-314
L’atome n’est qu’une hypothèse car son existence n’a pas été prouvée par l’expérience mais les hypothèses permettent d’expliquer les faits observés et font avancer le raisonnement. Dans la matière, les atomes oscillent de manière continue dans les solides et les liquides, ils se déplacent en ligne droite dans les gaz. Il existe des corps simples qui ne contiennent qu’un seul type d’atomes. Il en existe 65 en 1877. Peut-être en trouvera-t-on d’autres ou bien se réduiront-ils à 2 ou 3 ? Les corps composés sont des combinaisons de corps simples.
Ressource proposée par CM *
Source : L'atome, Le Magasin pittoresque, A45 (1877) pp. 5-7, disponible sur le site gallica.bnf.fr
Cet article présente quatre ouvrages. Un seul, celui sur Nicolas Lemery (1645-1715) est en français, les autres sont en anglais. Lemery développe une chimie pratique et il émet aussi des hypothèses pour expliquer la réaction. Son ouvrage Cours de Chymie publié en 1675 aura dix autres éditions, il sera traduit en anglais, en allemand… Il dote les particules de pointes et de pores qui interagissent entre elles. Il s’intéresse aussi à la perte ou à l’augmentation de la matière. Ce sont les cahiers de laboratoire d’Antoine Laurent Lavoisier (1743-1794) que l’auteur de l’ouvrage décortique. Les expériences sont décrites. Les réactifs et les produits sont pesés, mais il faut séparer les produits des réactifs restants puis les produits. Justus von Liebig (1803-1873) met au point une méthode d’analyse organique. Il publie un ouvrage sur la chimie agricole et un sur la chimie animale qui seront diffusés en Angleterre. Pour Liebig, c’est la chimie qui résoudra les problèmes de nutrition et de santé. Charles Adolphe Wurtz (1817-1884) fait de grandes découvertes en chimie organique comme les amines primaires, le glycol. C’est un ardent défenseur de la théorie atomique qu’il peut exposer au Collège de France.
Ressource proposée par CM *
Source : De Nicolas Lemery à Adolphe Wurtz : Sur quelques ouvrages d’histoire de la chimie, Revue d’histoire des sciences, Vol. 57, n°2 (2004) pp. 493-508
Dans cet article sur la formule développée des substances aromatiques et du benzène, Kekulé s’appuie sur la théorie de l’atomicité des éléments chimiques, c’est-à-dire du nombre de liaisons que forment chacun des éléments. Il considère la tétratomicité du carbone (on dit aujourd’hui tétravalence) et la monoatomicité de l’hydrogène ou du chlore. Ses observations l’ont conduit à admettre que les substances aromatiques ont en commun un noyau formé d’une chaîne de six atomes de carbone fermée. Il s’efforce d’en déterminer la constitution d’après les combinaisons que forment les carbones avec d’autres éléments. Dans cet article la représentation du benzène qu’il utilise est une chaîne fermée, aplatie et repliée sur elle-même. Il évoque, une autre forme possible « triangulaire » et acceptée par d’autres chimistes, mais il la rejette à cause des inconvénients qu’elle entraîne sans autre précision. Dans un article publié l’année suivante aux Annalen der Chemie und Pharmacie (1866, 61, p. 129-196), il pose la question de la symétrie du benzène qui peut être sénaire ou ternaire, c’est-à-dire respectivement représentée par un hexagone régulier ou un triangle isocèle, et affirme sa préférence pour la représentation hexagonale.
Ressource proposée par BB *
Source : Bulletin de la Société Chimique de Paris,T.3 (1865) pp. 98-110
Marie Curie compte au nombre des « grands hommes » de l'histoire des sciences, en même temps qu'elle offre à la mémoire sociale une figure de la femme, capable de susciter glorification, réticence et récupération. Son statut de scientifique lui assure l'image d'une femme d'exception, plutôt que celle d'une scientifique d'exception. Jacqueline Chervin explique ici pourquoi, lorsqu'on cherche de quel type de portrait bénéficie le personnage, on ouvre une réflexion beaucoup plus large sur la façon dont une figure historique recouvre une somme de perspectives d'interprétation quasi infinie. La façon dont Marie Curie apparaît dans les médias, émissions télévisées, films… est analysée.
Ressource proposée par BB *
Source : Communication et langages, 152 (2007) pp. 55-67
Dès 1899, soit trois ans avant la publication en 1902 par E. Rutherford et F. Soddy de leur théorie sur la transmutation des éléments chimiques par désintégration radioactive, Marie Curie a émis l'hypothèse que le rayonnement soit une émission de matière, accompagnée d'une perte de poids des substances radioactives. L’année suivante cette hypothèse est répétée par Pierre et Marie Curie lors du Congrès international de Physique de 1900. C’est le début de l’histoire de la transformation des éléments.
Ressource proposée par BB *
Source : La contribution de Marie Curie à l'explication de la nature de la transformation radioactive, Revue d'histoire des sciences, 32(4) ( 1979) pp. 339-343




