Après un rapide rappel de la formation des planètes et les méthodes d’étude de leurs atmosphères (in situ et à distance grâce aux spectres continus thermiques, d’émission et d’absorption), la chimie réductrice des planètes géantes est exposée, suivie de la chimie des planètes telluriques (Vénus, Mars et Titan). Les équilibres chimiques sont expliqués, mais aussi les processus hors équilibre (photochimie, interactions surface-atmosphère, chimie des chocs par impact cométaire). C’est ce qu’on appelle la planétologie comparée.
Plus d'information sur la conférence sur le site de l'ESPCI Paris
Source : Vidéos des conférences expérimentales de l’espace Pierre-Gilles de Gennes – Canal U-TV - ESPGG - ESPCI Paris - Conférence du 5 décembre 2011
La formulation est l’art des mélanges et de leur stabilité et ne met pas en jeu de réactions chimiques. L’objectif final est d’obtenir un produit qui aura des propriétés fonctionnelles précises. L’aspect final de ce produit formulé est apparemment homogène à l’échelle macroscopique mais est en réalité hétérogène à l’échelle microscopique.
Différents types de dispersion
Les matières premières utilisées ne sont en général pas solubles entre elles. Elles sont dites « incompatibles ». Elles constituent un ensemble de particules à disperser. Ces particules peuvent être solides, liquides ou gazeuses.
Pour réaliser cette dispersion il est nécessaire de choisir un milieu qui sera soit une phase aqueuse, soit une phase solvant organique. Le résultat portera selon le cas les noms de émulsions, suspensions, mousses ou encore aérosols.
Dans une approche simplifiée, les différents cas en fonction des particules à disperser sont regroupés dans le tableau ci-dessous.
| Composant à disperser | Type de dispersion |
|---|---|
| liquide dans liquide ou solide | émulsion |
| solide dans liquide ou solide | suspension |
| gaz dans liquide ou solide | mousse |
| liquide dans gaz | aérosol |
Si les particules à disperser sont de très petites tailles (comprises entre 1 nm et 1 µm) on est dans le domaine des gels ou colloïdes.
Pour assurer les performances techniques du produit formulé mais aussi sa conservation et sa stabilité dans son conditionnement et lors de son usage, il faut travailler d’une part sur la taille des particules du principe actif à disperser et d’autre part sur l’ajout d’autres ingrédients appelés additifs. Ceux-ci sont très dépendants du type de produit final réalisé. Ils doivent de plus, dans tous les cas, respecter des normes pour protéger l’environnement et l’utilisateur.
Rôle des différents ingrédients
Citons quelques additifs régulièrement présents :
- Les tensio-actifs ont un rôle de toute première importance pour assurer que la dispersion soit pérenne, c’est à dire que les ingrédients ne se séparent pas (aspect macroscopique homogène). Ils sont aussi appelés surfactants ou agents de surface et émulsifiants s’ils stabilisent une émulsion.
- Certains réactifs permettent d’ajuster le pH tout en ne déstabilisant pas l’interaction entre les tensio-actifs et les particules à disperser.
- Les conservateurs permettent de lutter contre les micro-organismes susceptibles de se multiplier au sein d’un produit (fongicides, bactéricides….).
- Les produits antioxydants, appelés anti-oxygène, permettent de lutter contre l’oxydation.
- Les additifs rhéologiques influent sur la viscosité, la capacité à se déformer et sur l’élasticité des matériaux sous l’action de contraintes.
La compréhension des phénomènes mis en jeu et la réalisation des produits formulés nécessitent de faire appel à plusieurs disciplines dont la physico-chimie et en particulier l’étude des interactions intermoléculaires, la chimie analytique, le génie chimique, la rhéologie et la chimie des colloïdes.
Pour approfondir
- « La formulation aujourd’hui : une introduction » par Alain Durant, l’Actualité Chimique n° 407 (mai 2016) pp. 24-26
- Manuel de Formulation » (PDF) par Vangélis Antzoulatos , disponible gracieusement en ligne au format pdf sur le site Eduscol, est un outil pédagogique qui permet d‘aborder l’ensemble des questions touchant à la formulation pour des étudiants Post-Bac et leurs enseignants.
- L’ouvrage « Couleur et habitat "vert" » par Daniel Grenier, in La chimie et l’habitat (EDP Sciences, 2011), ISBN : 978-2-7598-0642-3, p. 239, traite de l’exemple des peintures et nous fait découvrir une nouvelle chimie de formulation utilisant des matières premières renouvelables.
Applications industrielles
En tant qu’activité industrielle, la formulation est omniprésente dans la chimie de spécialités et constitue aujourd’hui l’un des secteurs clés de l’industrie chimique. Certaines industries telles que peintures, cosmétiques, adhésifs, détergents, lubrifiants, encres, pneumatiques… sont des industries de formulation à part entière.
La formulation joue aussi un rôle essentiel dans la conception des médicaments. Elle est appelée dans ce cas la galénique.
On peut se faire une idée de l’ensemble des spécialités concernées ici.
Compte tenu des très nombreux domaines d’applications, trois secteurs ont été sélectionnés et approfondis en fonction de leur importance industrielle. Vous trouverez prochainement sur le site Mediachimie trois « zooms sur… » complémentaires concernant la cosmétique qui est un marché où la France est leader mondial, les produits agroalimentaires et les ciments qui correspondent aux deux premiers marchés en tonnages.

© Liubov Kulchitskaja, Maksym Yemelyanov et efks / 123RF
Socle :
- Les systèmes naturels et les systèmes techniques
- Les représentations du monde et l'activité humaine
Programme Cycle 4 :
- L’énergie et ses conversions
Source : D’après l’article Se loger, se déplacer : peut-on se libérer de l’addiction aux énergies fossiles ? de Daniel Quénard publié dans l’ouvrage « La chimie et l’habitat », EDP Sciences, 2011, ISBN : 978-2-7598-0642-3
Socle :
- Les systèmes naturels et les systèmes techniques
- Les représentations du monde et l'activité humaine
Programme Cycle 4 :
- L’énergie et ses conversions : Identifier les sources, les transferts, les conversions et les formes d’énergie
Source : D’après l’article Les matériaux stratégiques pour l’énergie de Bruno Goffé publié dans l’ouvrage « Chimie et enjeux énergétiques », EDP Sciences, 2013, ISBN : 978-2-7598-0973-8
Socle :
- Les systèmes naturels et les systèmes techniques (travail sur la prise de conscience de l’impact de l’activité humaine sur l’environnement)
- Les représentations du monde et de l’activité humaine (travail sur la compréhension des problématiques actuels qui peuvent se poser à l’humanité, mais aussi sur la nécessité de considérer l’humanité dans le futur)
Programme Cycle 4 :
- Décrire la constitution et les états de la matière
- Identifier les sources, les transferts, les conversions et les formes d’énergie
Source : Les enjeux de la chimie dans la production d'électricité. L’importance de la chimie dans le secteur nucléaire, D’après l’article Les enjeux de la chimie dans la production d’électricité de Jean-Pierre West publié dans l’ouvrage « Chimie et enjeux énergétiques », EDP Sciences, 2013, ISBN : 978-2-7598-0973-8
Socle :
- Les systèmes naturels et les systèmes techniques (travail sur la prise de conscience de l’impact de l’activité humaine sur l’environnement)
- Les représentations du monde et de l’activité humaine (travail sur la compréhension des problématiques actuelles qui peuvent se poser à l’humanité, mais aussi sur la nécessité de considérer l’humanité dans le futur)
Programme Cycle 4 :
- Décrire la constitution et les états de la matière
- Identifier les sources, les transferts, les conversions et les formes d’énergie
Source : Les enjeux de la chimie dans la production d'électricité. Et demain, quelles énergies ?, D’après l’article Les enjeux de la chimie dans la production d’électricité de Jean-Pierre West publié dans l’ouvrage « Chimie et enjeux énergétiques », EDP Sciences, 2013, ISBN : 978-2-7598-0973-8
Certaines activités industrielles peuvent créer des pollutions de sols avec des éléments métalliques (ETM - Éléments Traces Métalliques). La phytoremédiation consiste à dépolluer les sols en utilisant des plantes susceptibles de fixer les métaux lourds, de survivre et aussi de se reproduire dans ces conditions a priori hostiles. Elle permet aussi de re-végétaliser des terrains.
Les différentes techniques utilisées [1] [2]
La phytoextraction permet d’extraire des polluants du sol et de les stocker dans les racines et les feuilles. Seules certaines plantes sont capables de cette hyper-accumulation sélective.
La phytostabilisation consiste à planter des espèces tolérantes qui limitent le flux de polluants vers les profondeurs du sol et les immobilisent.
La rhizofiltration extrait les ETM au niveau du rhizome des plantes (interface sol–racine).
Des exemples de plantes « hyper-accumulatrices » de métaux
Certaines plantes très spécifiques poussent naturellement sur des sols pollués. Par exemple, plusieurs variétés de tourbe se comportent en filtre de piégeage. Certaines permettent de fixer le mercure, d’autres le cuivre, le zinc et le plomb [3].
Les sites à ciel ouvert d’exploitation minière du nickel, du cobalt et du chrome en Nouvelle Calédonie détruisent le paysage. L’arbuste endémique Grevillea exul exul est utilisé pour la re-végétalisation des sols miniers et s’avère être un hyper-accumulateur de plusieurs métaux [2].
« Un exemple d’économie circulaire ; la start-up Econick extrait des sols pollués ou naturellement riches en métaux, des sels métalliques comme le nickel. Les cristalleries Daum à Nancy testent d’ores et déjà depuis un an les oxydes de nickel pour la teinte « vert-gris » de leurs produits… » [4].
Coût et limites
Ces techniques, par rapport aux techniques classiques physicochimiques, ont un coût peu élevé pouvant s’adapter à des surfaces de l’ordre de dizaines d’hectares. Elles valorisent la biomasse et permettent de maintenir la structure des sols. Cependant ces méthodes sont limitées à quelques mètres de profondeur [5].
Le recyclage : ou comment la plante devient une nouvelle ressource pour la métallurgie
La biomasse polluée peut être utilisée pour récupérer les métaux : on parle alors de phytomine.
La biomasse ainsi purifiée retrouve son caractère d’origine.Les métaux obtenus par la phytomine sont très purs et peuvent être utilisés directement comme catalyseurs [2]. On parle d’écocatalyse.
Or les catalyseurs de réactions industrielles utilisent des métaux précieux qui sont coûteux et sont souvent l’objet de convoitise entre États. La phytoremédiation ouvre la possibilité de créer des catalyseurs hétérogènes à activité accrue par rapport à des catalyseurs préparés classiquement par les procédés classiques de la métallurgie. Ainsi du palladium extrait par phytoremédiation et nommé « EcoPd » est utilisé comme catalyseur pour réaliser des réactions de couplage, par exemple de Heck (entre un halogénure d’alkyle et un alcène). Dans ce cas et il n’est plus besoin d’utiliser le palladium traditionnellement complexé par des ligands tels que les phosphines Pd(P(Ph3))4 , ce qui les rend très pratiques en synthèse appliquée ! [6]
La phytoremédiation est aussi utilisée pour des extractions de polluants organiques de sols et d’eaux [3] [7].
La remise en état de terrains pollués
Par exemple le CEA a lancé le projet DEMETERRES pour dépolluer les sols et des eaux contaminés par des métaux radioactifs tels que le césium et le strontium. Ce procédé sera mis en œuvre pour le traitement des millions de mètres cube de terre polluée à Fukushima [3].
Pour approfondir et illustrer ce sujet nous avons sélectionné les ressources suivantes :
[1] Le chapitre « Phytoremédiation des sols contaminés : des plantes pour guérir les sols », de J. L. Morel, in La chimie et la nature, EDP Sciences (2012), ISBN : 978-2-7598-0754-3, p. 157 est très complet sur le sujet.
[2] La vidéo « Dépolluer les sols avec des plantes » diffusée par TV Arte FUTUREMAG - ARTE
Claude Grison, directrice de recherche en écologie scientifique au CNRS à Montpellier, présente comment dépolluer le sol d’un site minier dans les Cévennes dont les teneurs en zinc, cadmium et plomb sont très élevées. Une autre approche, canadienne, est développée pour traiter, par des saules, les sols pollués aux hydrocarbures.
[3] La vidéo « La boue et le roseau » présente une réalisation de dépollution dans une bioferme travaillant en collaboration avec des équipes du CNRS.
[4] « À Nancy, Econick produit des métaux bio-sourcés grâce à des plantes dépolluantes » publié par Philippe Bohlinger le 21 décembre 2017, Traces Ecrites News, L'actualité économique du Grand Est et de Bourgogne Franche-Comté
[5] Le dossier « Des plantes pour dépolluer » (PDF) de la revue Les Savanturiers (octobre 2017) explique en termes simples les phénomènes pour un public de collégiens.
[6] L’article « Phytotechnologies remédiatrices et chimie verte : une symbiose d'avenir . » de Claude Grison et al., dossier détachable de L’Actualité Chimique n°414 (janvier 2017) pages I-XII, présente un rapprochement prometteur entre la nature, l’écologie et la chimie.
[7] Le chapitre « Biochimie naturelle et traitement de l'eau : de la chimie des écosystèmes et des cocktails… » par Éric Blin, in La chimie et la nature, EDP Sciences (2012), ISBN : 978-2-7598-0754-3, p. 185

Mine de nickel en Nouvelle-Calédonie © FB
Guyton de Morveau (1737-1816), avocat de Dijon, se passionnait pour la chimie. Il fut l’un des premiers convaincus de la justesse des théories de Lavoisier et l’un des fondateurs de l’École polytechnique. Il est l’auteur d’un Traité des moyens de désinfecter l’air.
En 1773, dit-il, l’hiver avait été si rigoureux que la terre était gelée à une grande profondeur, de sorte qu’on ne pouvait y creuser les tombes. Les cadavres, recouverts de chaux, furent entreposés dans les caves de l’église Saint-Médard. L’odeur devint bientôt si insupportable qu’il fallut fermer l’église. On avait en vain essayé des fumigations de vinaigre et allumé des brasiers sur lesquels on jetait différents parfums et des herbes odorantes. On sait aujourd’hui que l’odeur de cadavre est due à différentes amines volatiles, issues du catabolisme des protéines, prosaïquement dénommées cadavérine, putrescine, etc. Ayant remarqué que les vapeurs de chlorure d’hydrogène (HCl) et d’ammoniac (NH3) se combinent en chlorure d’ammonium, solide ionique inodore, Guyton en fit l’essai en grand le 6 mars. Du sel commun fut ajouté à de l’acide sulfurique concentré dans une grande cloche de verre renversée. La cloche fut placée sur un bain de cendres froides progressivement chauffées par un grand réchaud. Le chlorure d’hydrogène qui s’en dégageait se combinait avec les amines nauséabondes volatiles en composés solides. Le lendemain, après avoir aéré pour renouveler l’air, toute mauvaise odeur avait disparu. Quatre jours après l’église fut rendue au culte, selon lui, « sans danger et même sans inquiétude ».
Le procédé fut appliqué pour désinfecter l’air des hôpitaux militaires sous la Convention, le Directoire et le Premier Empire. Les destructeurs d’odeurs modernes visent toujours à limiter la diffusion des molécules malodorantes par transformation chimique (oxydation ou hydrogénation des huiles), adsorption (charbon actif) et encapsulation, par exemple.
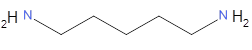
cadaverine
En savoir plus :
- Quelques rencontres historiques entre la chimie et les sciences de la santé, Josette Fournier, L’Actualité chimique (janvier 2004) pp. 9-18
- Traité des moyens de désinfecter l’air, de prévenir la contagion et d’en arrêter les progrès, Guyton de Morveau
Au début du XIXe siècle, les chimistes se voient submergés par le nombre de nouvelles matières organiques qu’ils entreprennent de mieux connaitre. L’analyse progresse en particulier grâce à Gay-Lussac et Thenard, Berzelius et au tube à cinq boules que Liebig ne va pas tarder à mettre au point.
Provenant d’organismes vivants – les autres étaient dites inorganiques – ces matières étaient réputées ne pas pouvoir être préparées en laboratoire car elles requéraient, pour leur formation, le concours d’une force, d’un élan, spécifique du vivant : la force vitale.
En 1828, Friedrich Wöhler réalise la « synthèse » de l’urée, saluée par tous comme marquant un tournant décisif pour la science. Il a préparé ce que seule la nature (animale) avait jusqu’alors pu produire. Les matières issues du vivant sont donc régies par les mêmes lois, connues, de la chimie minérale et l’homme (le chimiste) devient une sorte de démiurge des temps modernes. Tel est du moins le point de vue de Bertelot.
Wöhler est tout à fait ravi d’avoir préparé cette substance, synthèse partielle à partir de composés dont il ne donne pas la provenance (isocyanate d’argent et sel d’ammoniac, ou isocyanate de plomb et ammonique liquide). Il n’en revient pas d’avoir préparé une substance artificielle qui a en tout point les propriétés de l’urée tellement étudiée par Proust et d’autres.
Voici comment Wôhler en parle à son ami Berzelius, dans sa lettre du 22 février 1828 : « Je devrais recevoir bientôt une lettre de toi, mais comment attendre davantage ? Je ne peux, pour ainsi dire pas retenir mes eaux chimiques… il me faut te le dire : je peux faire de l’urée sans avoir besoin de reins, qu’il soient d’animal, d’homme ou de chien. Le cyanate d’ammonium est de l’urée… »
Berzelius lui répond le 7 mars : « A la vérité, Herr Doktor a trouvé l’art d’accéder à l’immortalité. L’aluminium et l’urée artificielle, voilà deux choses tout à fait différentes et qui se suivent de si près ! Ce seront deux pierres précieuses enchâssées dans votre couronne de laurier. Et… si par hasard l’urée artificielle venait à manquer ? On pourra alors recourir au pot de chambre ! »
Le nom de Liebig est connu de tous, et même en France. Un chimiste, allemand, connu de tous ? C’est que la soupe Liebig existe toujours. Tout supermarché la vend. En fait, il s’agissait, à l’époque, d’extrait de viande.
La petite histoire raconte que Justus Liebig (1803-1873) avait un ami dont la petite fille ne mangeait plus et dépérissait à vue d’œil. Liebig, célèbre réformateur de la chimie organique moderne et fondateur de la chimie agricole, lui fit préparer un bouillon de viande très riche que la fillette accepta de prendre à petites doses. Elle recouvra la santé.
Il n’empêche. C’est le désir de lutter contre le gaspillage qui a animé nos premiers écolo-chimistes, qu’ils inventent des fosses à fumier, pour limiter la déperdition du pouvoir fertilisant des fumiers de ferme (Boussingault), ou qu’ils songent aux extraits de viande. En effet, dans les années 1860, les bœufs du Brésil et d’Uruguay étaient abattus pour leur seul cuir ! Une dizaine d’années plus tôt, Liebig, dans ses Lettres sur la Chimie, avait consacré de longues pages à vanter les qualités de l’extrait de viande qui réparerait bien mieux les forces épuisées des malades que ces bouillons d’os que l’on donne dans les hospices, à l’Hôtel-Dieu en particulier. « Des os de quatre bœufs, on pourrait réellement en créer un cinquième », disait d’Arcet, l’industriel qui construisait et installait les appareils extracteurs dans les grands établissements philanthropiques parisiens. Liebig avait combattu les tenants de la gélatine, qui n’a aucune valeur nutritive, et la controverse entre les plus grands chimistes de l’époque, sous la présidence de Magendie, avait occupé l’Académie des Sciences des dizaines d’années durant.
Giebert, qui s’occupait au départ de la construction de voies ferrées dans ces pays d’Amérique du Sud, fonde donc, avec l’accord de Liebig, la société Fray Bentos Giebert et Cie, qui prépare à partir de 1864 le fameux extrait de viande : une tonne de viande de bœuf donne vingt-cinq kilos d’extrait.
Giebert attribua à Liebig la fonction de Directeur de la société avec un revenu de 1000 livres par an, et une rétribution de 5000 Livres à condition que la société prenne le nom de Liebig ; sa gloire et son renom permettant de se placer sur le marché financier de Londres et de devenir la Liebig Extract of Meat Company.
En savoir plus
- La chimie du XVIIe au XIXe siècle à travers la vie de quatre chimistes, au sujet de De Nicolas Lemery à Adolphe Wurtz : Sur quelques ouvrages d’histoire de la chimie, Danièle Fauque, Revue d’histoire des sciences, Vol. 57, n°2 (2004) pp. 493-508
- La science et la technologie de l'alimentation vues par la chimie du bouillon, Hervé This
