Dans cette première pièce, le professeur « Blouseblanche » propose à ses jeunes invités de faire remonter à la surface un drôle de sous-marin. Lors de cette expérience, découvrez un œuf « Kinder » dans une posture bien inhabituelle. À l’intérieur de l’œuf se trouve la combinaison qui vous ouvrira d’autres pièces. Serez-vous à la hauteur de la situation ?
Les différentes utilisations et les supports dédiés
- Pour une résolution utilisant uniquement des supports papier :
- Le livret élève à distribuer (énigme papier)
- Le guide enseignant (énigme papier)
- Pour une résolution mixant supports papier et numérique :
- Le livret élève à distribuer (énigme numérique)
- Le guide enseignant (énigme numérique)
- Les vidéos de présentation de l'énigme et la résolution sont accessibles via un QRcode sur le livret élève
- Les QRcodes des vidéos des indices sont dans le guide enseignant (à imprimer pour distribuer aux élèves si besoin)
Pour le niveau cycle 3, Mediachimie et la Fondation La main à la pâte vous propose une série d’énigmes destinée à vos élèves avec l’objectif de faire le point sur de notions abordées en classe d’une façon ludique basée sur le questionnement et l’expérimentation.
Ces énigmes pourront être abordées en choisissant le support le plus adapté à votre pratique : numérique ou version papier.
Chaque énigme proposera un livret élève, un guide enseignant et des aides sous forme d’indices pour débloquer chaque situation.
Le professeur « Blouseblanche » est un scientifique atypique. Il vit dans un étonnant manoir aux multiples pièces. Régulièrement Fadi et Sarah, passionnés de sciences, viennent lui rendre visite pour suivre ses expériences passionnantes. Mais cette fois-ci « Blouseblanche » a lancé un défi à ses jeunes invités. Il leur propose de résoudre une série d’énigmes scientifiques afin de pouvoir évoluer dans les différentes pièces de son manoir. Immergez-vous dans l’antre du professeur, découvrez les indices dévoilés par sa tablette, vivez une expérience inédite en choisissant le support qui vous convient le mieux : numérique ou version papier.




Énigme 1 : Un sous-marin bien étrange !
Énigme 2 : Le gâteau des savants !
Énigme 3 : Un mélange magique
Les différentes utilisations et les supports dédiés
- Pour une résolution utilisant uniquement des supports papier :
- Le livret élève à distribuer (énigme papier)
- Le guide enseignant (énigme papier)
- Pour une résolution mixant supports papier et numérique :
- Le livret élève à distribuer (énigme numérique)
- Le guide enseignant (énigme numérique)
- Les vidéos de présentation de l'énigme et la résolution sont accessibles via un QRcode sur le livret élève
- Les QRcodes des vidéos des indices sont dans le guide enseignant (à imprimer pour distribuer aux élèves si besoin)
Pour travailler dans le secteur de l'enseignement et de la recherche publique avec une formation en chimie.
sources d’orientation et de réflexions / domaines d'activité / exemples de métiers / formations /compétences attendues / informations employeurs et emplois / données du secteur
Les domaines d’activité
- Enseignement
- Recherche & développement
Source : Fiche orientation réalisée par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
Pour travailler dans le secteur de l'aéronautique avec une formation en chimie.
sources d’orientation et de réflexions / domaines d'activité / exemples de métiers / formations /compétences attendues / informations employeurs et emplois / données du secteur
Les domaines d’activité
- Contrôle qualité
- Conception - Production
- Recherche et développement
- Marketing - Ventes
Source : Fiche orientation réalisée par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
Pour travailler dans le secteur du traitement de l'eau avec une formation en chimie.
sources d’orientation et de réflexions / domaines d'activité / exemples de métiers / formations /compétences attendues / informations employeurs et emplois / données du secteur
Les domaines d’activité
- Analyse laboratoire et contrôle qualité
- Qualité, hygiène, santé et environnement (QHSE)
- Procédés
- Épuration et traitement de l’eau
Source : Fiche orientation réalisée par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
La couleur est le plus beau trait d’union entre la science et l’art. De Leonard de Vinci aux designers contemporains, en passant par Goethe ou Sonia Delaunay, les Hommes se sont toujours intéressés à la lumière et à la restitution de ses couleurs.
Première STL (PCM-SPCL)
Objectifs : Comprendre le phénomène de la perception des couleurs.
Étudier comment produire de la couleur.
Interpréter les modifications apparentes sur une couleur lorsqu’on la juxtapose à d’autres couleurs.
Chimie et développement durable / Analyses physicochimiques
Interaction rayonnement-matière
Image, couleur et vision
Vision des couleurs. Synthèses additive et soustractive des couleurs.
Filtres. Codage RVB. Photon, énergie d’un photon.
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
La découverte de la combustion par le dioxygène est imputable au chimiste français Lavoisier, en 1775. Selon le philosophe des sciences Thomas Samuel Kuhn, la découverte de la combustion par le dioxygène constitue une révolution scientifique majeure dans l’histoire des sciences. Elle a constitué un changement de modèle, en remplaçant l’ancienne théorie chimique, qui expliquait la combustion par la présence d’un fluide présent au sein des corps combustibles.
La combustion par le dioxygène a eu au XIXe siècle, et plus encore au XXe siècle, de nombreuses applications industrielles. Elle a cependant conduit pendant l’ère industrielle à l’émission massive de dioxyde de carbone, qui est un gaz à effet de serre contribuant pour une large part aux phénomènes de dérèglement climatique. Comment maintenir les besoins en matière d’énergie tout en préservant notre environnement ?
Première générale - Enseignement de spécialité
Objectif : Définir les énergies engagées dans une réaction de combustion et les associer aux énergies mises en jeu lors des ruptures et formations de liaisons.
Constitution et transformation de la matière
Thème 2 - Propriétés physico-chimiques, synthèses et combustions d’espèces chimiques organiques
Partie C - Conversion de l’énergie stockée dans la matière organique
Notions et contenus : Énergie molaire de réaction, pouvoir calorifique massique, énergie libérée lors d’une combustion.
Source : Dossier pédagogique réalisé par les Éditions Nathan en partenariat avec La Fondation de la Maison de la Chimie et Mediachimie
Séquences pédagogiques La main à la pâte
Rubrique(s) : Événements

La Fondation de la Maison de la Chimie et la Fondation La main à la pâte se sont associées pour proposer aux enseignants et aux élèves des séquences pédagogiques de la petite section à la classe de 3eme conformes aux programmes de l’enseignement obligatoire.
Dans l’attente de découvrir toutes les propositions pédagogiques, vous pouvez d’ores et déjà découvrir les premières ressources, Sur la palette de l’artiste pour le cycle 2 et Atomes à modeler pour le cycle 4, ainsi que le résumé des séquences que nous proposerons en 2020.
Dans le cadre de ce partenariat, il sera également proposé aux professeurs des écoles et de collège des modules de formation (en présentiel et à distance) pour qu’ils puissent mettre en œuvre un enseignement de la chimie attractif et novateur au sein de leur classe.
Pour avoir plus d’informations sur l’offre de formations : https://www.maisons-pour-la-science.org/
Quels sont les secrets du « SLIME » ?
Rubrique(s) : Question du mois

Le « slime », cette pâte visqueuse avec laquelle les enfants et les adolescents aiment jouer, fait l’objet d’un très grand nombre de vidéos sur Internet, qui présentent des protocoles variés pour sa réalisation. De nombreuses entreprises se sont également engouffrées dans la brèche et proposent des kits regroupant les substances nécessaires à sa confection, ainsi que de quoi le colorer et le texturer.
De la colle au « slime » ou avec quoi en fabriquer ?
Un des protocoles de confection consiste à dissoudre un peu de colle blanche dans un petit volume d’eau, d’ajouter quelques gouttes de collyre ophtalmique et d’homogénéiser vigoureusement (1).
L’ensemble s’épaissit, se décolle des parois du récipient en verre et prend la consistance liquide/solide caractéristique du « slime ».
Les procédés varient, mais tous présentent plusieurs points communs. Dans tous les cas il faut :
- de la colle PVA (pour polyvinylacétate), ou une autre substance comme de l’amidon présent dans la maïzena ou la farine, ou encore de la gomme de cellulose présente dans le dentifrice ;
- de l’eau ;
- un additif : collyre ophtalmologique ou du carbonate de calcium ou des tensioactifs anioniques présents dans le liquide vaisselle.
Quelles sont les caractéristiques et le rôle de chacun de ces ingrédients ?
La colle blanche
La colle blanche est une émulsion de PVA dans l’eau. Le PVA est un polymère constitué de molécules organiques de grande taille, appelées macromolécules. Celles-ci sont insolubles dans l’eau. La colle blanche a été obtenue en ajoutant de l’eau et un tensioactif, afin que les macromolécules se trouvent dispersées en fines gouttelettes dans l’eau. Ainsi elles ne s’agglomèrent pas en une phase unique, ce qui donne à la colle ses propriétés mécaniques d’écoulement et sa relative fluidité.
D’un point de vue structural, la macromolécule constituant le polymère PVA est décrite par la répétition d’un motif comportant une fonction acétate [–(CH2–CH(OCOCH3))–]. Une chaîne est schématisée ci-après :
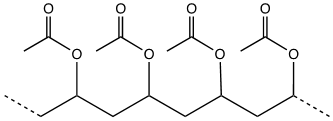
Lorsque la colle sèche, l’eau s’évapore et les macromolécules forment un réseau enchevêtré à 3 dimensions. Les macromolécules présentent alors de nombreuses interactions des unes avec les autres (2), ce qui confère sa rigidité au matériau. L’image d’un plat de spaghettis cuits congelés permet de se figurer cet état figé caractéristique de la colle sèche !
Ajouter de l’eau à la colle
En rajoutant de l’eau à la colle, les macromolécules sont encore plus espacées les unes des autres, la suspension se comporte alors comme un véritable liquide, assez visqueux. Les spaghettis nagent dans l’eau !
Le collyre ophtalmique et son rôle
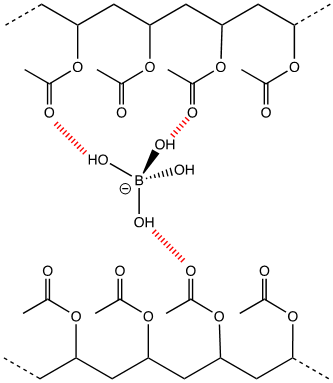
Le collyre ophtalmique est une solution aqueuse de borax (Na2B4O7, 10 H2O) et d’acide borique. Il se créé in situ des ions borates B(OH)4– dont la présence assure au « SLIME » ses propriétés mécaniques ludiques. En effet, les ions borate créent des ponts, ou réticulations, entre les chaines. Il s’agit d’un nouveau réseau d’interactions faibles, majoritairement des Liaisons Hydrogène, (LH) (3) entre les macromolécules.
Les chaines ne sont plus aussi libres que dans la colle diluée à l’eau mais elles gardent une certaine cohésion, ce qui donne l’aspect visqueux du « slime ». En revanche, ces liaisons restent faibles, elles peuvent se rompre et se reformer facilement.
Les différences de propriétés entre la colle séchée, la colle liquide et le « slime »
Rappelons qu’ils sont tous les trois constitués des mêmes macromolécules. Les différences proviennent de plusieurs points.
• Dans la colle séchée, il n’y a qu’un réseau 3D de macromolécules de PVA. L’ensemble est donc solide, car les chaines ne peuvent glisser les unes sur les autres.
• Dans la colle liquide, les macromolécules sont espacées, non emmêlées, ce qui lui confère son caractère liquide (quoique visqueux).
• Dans le « slime », il y a de l’eau, ce qui espace les chaines et leur permet de glisser les unes sur les autres. Les points de réticulation assurent à la matière une certaine cohésion tout en restant rompables et reformables. Le « slime » se comporte à la fois comme un solide et comme un liquide.
Quelques expériences expliquées
- Doubler la quantité d’eau de la recette : le « slime » devient trop liquide.
- Ne pas ajouter d’eau du tout : au contraire le « slime » est trop compact, cassant, les chaines ne peuvent plus autant « glisser les unes sur les autres ».
- Mettre une galette de « slime » sur un verre renversé : la substance s’écoule comme un liquide.
Le déposer dans un récipient : il en prend lentement la forme.
Posé sur une surface lisse, le gel s'étale très lentement en forme de flaque circulaire.
Dans tous ces cas, le « slime » se comporte comme un liquide visqueux. Les macromolécules glissent doucement les unes contre les autres mais les liaisons hydrogène assurent la cohésion de l’ensemble. - Lorsqu'on laisse évoluer le « slime » sous son propre poids, il s'étire doucement : il flue (coule) sans se rompre. En effet, les LH ne suffisent pas à rendre le solide rigide et indéformable.
- Lorsqu'on tire dessus d'un coup sec il se coupe net car les LH ne sont pas très fortes. Une fois cassé on peut le reformer en un seul morceau car la rupture des LH est réversible. Deux morceaux de gel peuvent ainsi rapidement fusionner lorsqu'on les accole.
- Mettre une boule de « slime » dans le creux de sa main et enfoncer rapidement son doigt dedans : une empreinte est réalisée comme dans le cas d’un solide. La viscosité augmente lorsqu’une contrainte mécanique lui est appliquée, car on contraint les chaines de macromolécules à s’enchevêtrer.
- Si on lance la boule, celle-ci rebondit assez bien sur une surface lisse, sans se déformer. Toutefois le « slime » n'est pas vraiment élastique au point de rebondir fortement. En effet pour cela il faut utiliser des chaînes macromoléculaires bien plus longues.
Antoine Éloi et l’équipe question du mois
(1) Consignes de sécurité : ne vous touchez pas le visage ni les yeux durant vos expériences, ne mangez pas les produits et lavez-vous les mains à la fin. Plus d’infos sur : le Dacryosérum, l’acétate de vinyle et le PVA.
(2) Entre les macromolécules il peut y avoir des interactions électrostatiques qui les retiennent les unes aux autres. Il s’agit des interactions de Van der Waals.
(3) Les LH sont des interactions qui s’établissent ici entre certains atomes d’oxygène des macromolécules et les groupes OH des ions borate (figurées en hachures rouges).
Illustration : jarabee123 / Adobe Stock
 |
Pollution à Paris : une expérience grandeur nature
|
Pollution à Paris : une expérience grandeur nature
Rubrique(s) : Éditorial

On a lu et entendu des arguments contradictoires sur l’influence du confinement imposé après le 15 mars sur la pollution à Paris. Une polémique avec sans doute quelques intentions électorales opposait les partisans d’une réduction drastique de la circulation automobile aux automobilistes convaincus que la pollution n’était pas seulement imputable à leurs engins. La réduction de la circulation automobile de plus de 80% en mars et avril était bien sûr une façon de vérifier les deux options et dire si la pollution à Paris avait vraiment diminué.
Notons en passant que le discours dominant repris par tous les media véhicule souvent des approximations. Il ne faut que se pencher sur les résultats d’un sondage Ipsos de 2018, qui posait la question : la pollution dans vos villes augmente-t-elle ou diminue-t-elle ? Les réponses étaient : elle augmente beaucoup pour 63%, un peu pour 25%, elle ne diminuait que pour 1% des sondés. En réalité depuis 20 ans grâce au sans plomb, à la désulfuration des carburants, aux pots catalytiques et au AdBlue, la chimie et les progrès en catalyse (1) ont réussi à faire diminuer nettement l’émission des polluants : -87% pour le CO, -80% pour C6H6, -44% pour NOx, -70% pour les particules fines, -80% pour SO2, et -100% pour le plomb (*).
Il était donc très intéressant de se faire une opinion basée sur des chiffres de mesures officielles d’Airparif et non sur des impressions vagues ou tendancieuses (2).
En effet l’île-de-France est particulièrement bien fournie en capteurs spécialisés par polluant et dispersés de façon très intelligente pour gommer tous aléas climatiques ou accidentels. C’est près de 110 stations qui traquent et mesurent SO2, CO, O3, NOx, PM2,5, PM10 24 heures par jour et 365 jours par an (3).
Airparif donne chaque jour l’indice Atmo et l’indice européen Citeair noté de 0 à 100 et il a été possible de consulter les graphiques mensuels (0 à 50 vert, 50 à 70 orange, plus de 70 rouge).
Pour février 2020 les indices sont tous verts avec une moyenne de 30 sauf 2 jours orange à 50. Jusqu’au 15 mars on est aussi dans une moyenne de 30 après le 15 apparaissent 6 jours consécutifs orange avec des indices supérieurs à 50-60 puis deux jours, le 27 orange et le 28 rouge avec un indice à 80. Pour le mois d’avril : 7 jours orange au-dessus de 50 jusqu’au 21 avril, ce qui est assez comparable à avril 2019 avec 14 jours orange au-dessus de 50.
On aurait vite fait pour certains de dire que les moyennes des indices de pollution pendant le confinement sont plus élevées qu’en période normale alors que le trafic automobile a diminué de plus de 80% et l’activité économique de plus de 30% et donc que la pollution a été plus importante durant le confinement à Paris. En réalité les choses sont bien plus complexes. Pour les 6 polluants mesurés l’indice Citeair est « l’indice du pire », il ne fait pas une moyenne pondérée des sous-indices. Si par exemple pour SO2, NOx, O3, PM10 les mesures donnent respectivement 50, 30, 70, 40 l’indice Citeair prendra le plus élevé (70) sans tenir compte des autres même s’il y a amélioration pour l’un.
On peut alors faire des moyennes en teneur réelles à partir des chiffres Airparif. De février jusqu’au 15 mars et du 16 mars au 20 avril sur le tableau suivant (**) :
| stations | sans confinement | avec confinement | différence | |
| trafic | 83 | 14 | 83% | |
| PM10 | 23 | 17,6 | 24,4 | +39% |
| PM 2,5 | 13 | 7,9 | 14,7 | +87% |
| NOx | 40 | 57 | 36 | -37% |
| O3 | 22 | 56,6 | 67,5 | +19% |
| CO | 5 | 0,124 | 0,006 | -71% |
| SO2 | 6 | 0,66 | 0,58 | -12% |
On peut alors voir que la baisse de la circulation a fait nettement baisser la teneur en oxydes d’azote mais pas dans les mêmes proportions que la baisse de la circulation (40% comparée à 80%), ainsi que la teneur en oxyde de carbone et oxyde de soufre (4). On pourrait aussi y ajouter que les émissions de CO2 ont aussi baissées. Par contre, et c’est un peu paradoxal, on constate une augmentation des particules fines dont on sait qu’elles sont encore plus nocives que les oxydes d’azote ainsi que la teneur en ozone qui tendrait à dire que la qualité de l’air s’est détériorée au cours du confinement.
Plusieurs explications sont proposées par les spécialistes. Tout d’abord les particules notamment les PM2,5 les plus petites peuvent provenir de l’agriculture avec une saison printanière marquée en Île- de-France et aussi du chauffage au bois lors des soirées plus fraiches (5). Pour l’ozone on sait que les réactions entre les oxydes d’azote et les composés organiques volatils conduisent à sa production, on peut soupçonner les émissions volatiles des arbres et parcs reverdis et non taillés durant la période, plus importantes qu’en hiver (6).
La conclusion est que si le confinement et la baisse drastique de la circulation automobile a montré une diminution des oxydes d’azote et de carbone, elle n’a pas mis en évidence une remontée spectaculaire de la qualité de l’air dans Paris. D’autres sources de pollutions, le chauffage au fuel ou au bois, les vents apportant les poussières et aérosols de l’agriculture y contribuent. C’est donc, malgré les contraintes sanitaires de la distanciation, les recours aux transports en commun et pour les plus riches au véhicule électrique qui devraient être encouragés, en sachant cependant que cela ne résoudra pas l’équation complexe de la pollution des grandes villes.
Jean-Claude Bernier
Mai 2020
(*) Ch Gerondeau, L’air est pur à Paris… mais personne ne le sait ! (éd. L’artilleur, 2018)
(**) Rémi Prud’homme, Confinement : moins de voitures, plus de pollution
Pour en savoir plus
(1) Un exemple de matériau spécifique : pots catalytiques et dépollution automobile
(2) Démocratiser l’information environnementale pour mieux respirer en ville
(3) Les défis de la santé et du bien-être en ville : pollution atmosphérique, nuisance thermique, odeurs
(4) Comment assainir l’atmosphère des villes ? L’hydrotraitement
(5) Ah, un bon feu de bois dans la cheminée !
(6) Chimie atmosphérique et climat
Illustration : Avenue de la Grande Armée, Paris 26 mars 2020, Eric Salard/FlickR, Licence CC BY-SA 2.0
