Pourquoi les batteries électriques au lithium peuvent-elles s'enflammer ?

Les batteries lithium-ion qui équipent de nombreux appareils électriques sont largement utilisées car elles stockent l’énergie électrique sous un très petit volume et sont rechargeables. Cependant, elles peuvent être la source d’incendie ou d’explosion (toutefois assez rares). Ceci est dû à leur composition et/ou à une éventuelle mauvaise utilisation.
De quoi est constituée une batterie au lithium ?
Le fonctionnement de la batterie est basé sur une réaction chimique d’oxydo-réduction avec transfert d’ions lithium, Li+, entre deux électrodes plongées dans un électrolyte (1) (2) (3) (4.a).
Une batterie au lithium est une association de plusieurs cellules ou accumulateurs(i). Chaque cellule (voir fig. 1) délivre une tension de quelques volts et se compose :
- d’une électrode en carbone graphite, qui est le pôle négatif et l’anode quand la batterie débite ;
- d’une électrode en oxyde mixte métallique à base de lithium, de cobalt, de nickel et de manganèse (LiNixCoyMnzO2), pôle positif et cathode quand la batterie débite. Le cobalt peut éventuellement être substitué par du nickel ou de l’aluminium pour augmenter la puissance de la pile ;
- d’un séparateur constitué de films polymères(ii) qui empêche les courts-circuits électriques entre les deux électrodes ;
d’un électrolyte conducteur composé :
- d’hexafluorophosphate de lithium (LiPF6), qui est bon conducteur ionique mais instable à la chaleur ; en se décomposant, il peut générer de l’acide fluorhydrique (HF), hautement toxique(iii) ;
- et de solvants organiques, mélange de carbonates (carbonates d’éthylène, de diméthyle, de diéthyle, etc.), qui ont pour but d’améliorer la stabilité et le transport des ions. Mais ils sont inflammables.
La composition de cet électrolyte, non aqueux (à la différence des accumulateurs au plomb) le rend inflammable, ce qui participe au risque d’incendie.
- d’une plaque de cuivre à l’anode et d’une plaque d’aluminium à l’autre extrémité, pour collecter le courant produit.
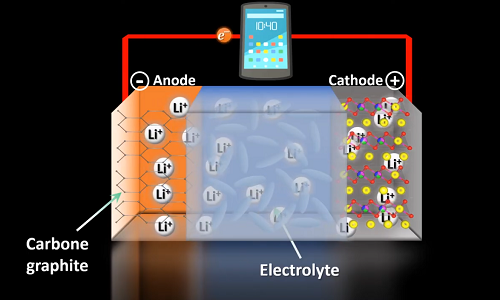
Figure 1 : schéma d’une cellule d’une batterie lithium-ion lors de sa décharge
Source : capture d’écran vidéo "Accumulateur « Lithium–Ion » : une révolution technologique portable !", R. Blareau et F. Brénon [1]
L’emballement thermique
L’inconvénient majeur de ce type de technologie est le risque d’embrasement soudain. Les batteries prennent feu à cause d’un phénomène appelé emballement thermique. C’est une réaction en chaîne, non contrôlée, due à une surchauffe initiale dans une cellule, au-delà de 100°C, et qui gagne les cellules voisines. Une batterie endommagée ou mal utilisée peut entraîner cet emballement thermique avec risque d’incendie ou d’explosion, émission de gaz toxiques et pollution.
Causes principales de l’emballement thermique
⇒ et comportements à adopter pour les éviter
Court-circuit interne : si les électrodes viennent en contact par endommagement de la membrane qui les sépare.
⇒ Il faut donc éviter de percer ou d’écraser une batterie. Le contact avec l’oxygène de l’air enflamme les composants instables.
⇒ Par ailleurs, l’accumulation de lithium, sous forme d’aiguilles (dendrites), peut percer le séparateur. Ce phénomène est inhérent au fonctionnement de la batterie au lithium.
Surcharge électrique qui entraîne la surchauffe de la batterie.
⇒ Utiliser toujours le chargeur adapté.
⇒ Surveiller une éventuelle surchauffe lors de la recharge.
Chaleur extrême : elle accélère les réactions chimiques, les composés organiques s’enflamment et se décomposent en libérant des produits toxiques ou corrosifs.
⇒ Ne pas laisser l’objet exposé en plein soleil et le conserver à température ambiante.
Choc : il peut par exemple engendrer un contact entre les électrodes.
⇒ Eviter les chocs mécaniques, chutes, écrasement…
Concrètement, les phénomènes mis en jeu et leur enchainement dans l’emballement thermique sont très complexes et font l’objet de nombreuses études afin de limiter ces risques(iv).
Le dispositif coupe-circuit mis en place dans les batteries
Les concepteurs de batteries ont mis en place un dispositif électronique coupe-circuit, dit BMS (battery management system). Celui-ci assure d’une part l’équilibrage entre les cellules afin que le niveau de charge reste identique au sein de chacune d’elles. D’autre part, en cas d’utilisation en dehors des conditions normales (surtension, surcharge, température trop haute, décharge trop basse), il met la batterie en sécurité en ouvrant le circuit interne de la batterie, ainsi plus aucun courant ne peut alors être délivré.
Évolution des batteries lithium-ion
La gestion des gaz toxiques dégagés en cas d’emballement est aussi essentielle à la sécurité de ces batteries. En évitant la propagation aux cellules voisines, voire à l’extérieur s’il y a détérioration, on limite le risque de dégagement de gaz toxiques et d’expulsion violente, voire explosive, de particules de plastique fondu, de métaux.
En conséquence, la conception des batteries évolue pour réduire, voire supprimer, le risque d’emballement thermique (3). Par exemple :
- L’accumulateur LFP dont la cathode est faite de phosphate de lithium et de fer (LiFePO4), bien que moins puissant en énergie, ne présente pas de risque d’emballement.
- Avec des électrolytes gélifiés, à base de sels de lithium et de conducteurs inorganiques, il n’y a pas de gaz émis.
- Assurer l’assemblage compact des cellules, isolées par des séparateurs centraux, constitués d’une couche de polymère plastique ou de céramique, résistants aux chocs et à la chaleur permet d’éviter la propagation.
- En phase de développement, la batterie à électrolyte solide où le séparateur joue aussi le rôle d’électrolyte, assure une sécurité maximale et une puissance supérieure. On parle de « all-solid-state batteries » (ASSB), pour « batteries tout solide » dont certaines ont des électrolytes à base de sulfures inorganiques (4.b).
En conclusion
La plupart des outils utilisés tous les jours fonctionnent grâce à l’énergie fournie par les batteries au lithium. Si leur fabrication en grand nombre doit éviter tout vice de fabrication, leur utilisation dans des conditions bien contrôlées devrait limiter tout risque d’accident. Rappelons que ces batteries, comme les autres, ne doivent en aucun cas être jetées mais rapportées dans des dépôts appropriés. Au cas où vous constateriez un feu de batterie (5) et tout spécialement dans un espace confiné, alertez les pompiers immédiatement, ne cherchez pas à intervenir vous-même et quitter le lieu.
L'utilisation de la vermiculite(v), que ce soit dans des extincteurs spécialisés ou sous forme de granulés, constitue une méthode efficace pour prévenir et éteindre ces incendies.
(i) Lors de la charge de l’accumulateur branché aux bornes d’un générateur de courant, l’énergie électrique reçue est convertie en énergie chimique via une réaction chimique réversible d’oxydo-réduction.
Lors de la décharge de l’accumulateur, la réaction chimique a lieu en sens inverse et l’énergie chimique associée est convertie en énergie électrique (courant électrique produit).
(ii) Par exemple, ces films peuvent être en polyoléfines microporeuses, tels que le polyéthylène (PE), le polypropylène (PP) ou des stratifiés de polyéthylène et de polypropylène. Pour aller plus loin : Examen de la suppression des incendies de batteries lithium-ion (en anglais) Energies (2020), 13(19), 5117
(iii) HF est mortel par inhalation, par contact cutané et en cas d'ingestion. Il provoque de graves brûlures de la peau et de graves lésions des yeux. HF est aussi un produit qui attaque le verre. Voir la fiche toxicologique de HF sur le site de l’INRS.
(iv) Examen critique des méthodes de prédiction et d'alerte précoce de l'emballement thermique des batteries lithium-ion (en anglais), Energy Material Advances (2023) 4, 0008
(v) La vermiculite est un composé naturel constitué d’aluminosilicate de magnésium, de calcium et de fer. Il existe par exemple des extincteurs LithEx à base d'AVD (Dispersion de Vermiculite Aqueuse) composés de vermiculite et d'eau.
Pour en savoir plus
[1] Accumulateur « Lithium–Ion » : une révolution technologique portable ! R. Blareau et F. Brénon, vidéo Blablareau au labo/Mediachimie
[2] Le lithium, un élément chimique indispensable pour notre mobilité actuelle, É. Bausson, Chimie et… en fiches, Mediachimie.org
[3] Le stockage de l’énergie électrochimique en technologie Lithium-ion, I. Lucas et A. Gajan sur le site CultureSciences-Chimie
[4] Comment la chimie peut-elle répondre aux problèmes posés par les batteries électriques ? résumés et conférences du colloque Les défis de la chimie du 19 juin 2025 et tout particulièrement :
[4.a] Conférence Les batteries Li-ion : état de l’art et perspectives, P. Simon
[4.b] Conférence Batteries "tout solide" Li-ion, innovation et perspectives, V. Buissette (Syensqo)
[5] Synthèse des travaux sur l’extinction des feux de batteries Li-Ion de véhicules électriques sur le site de l’INERIS
Crédit illustration : Cre-AI-Tor / Adobe Stock
